名校
解题方法
1 . 钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为________ ;Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为________
(2)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱____ >______
(3)H2S的键角_______ (填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由_____
(4)Cu3N的晶胞结构如图,N3-的配位数为______ ,Cu+半径为apm,N3-半径为bpm,阴阳离子看成刚性小球,并彼此相切,则Cu3N的密度为_____ g·cm-3。(阿伏加德罗常数用NA表示,列出表达式即可)

(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱
(3)H2S的键角
(4)Cu3N的晶胞结构如图,N3-的配位数为

您最近一年使用:0次
2020-11-29更新
|
86次组卷
|
2卷引用:甘肃省静宁县第一中学2021届高三上学期第三次模拟考试化学(普通班)试题
名校
解题方法
2 . 缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是( )
| A.NH3、BF3、CCl4中只有BF3是缺电子化合物 |
| B.BF3、CCl4中心原子的杂化方式分别为sp2、sp3 |
| C.BF3与NH3反应时有配位键生成 |
| D.CCl4的键角小于NH3 |
您最近一年使用:0次
解题方法
3 . 东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子排布式为________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____________ 。
②1 mol [Ni(NH3)6]2+含有σ键为___ mol。
③氨的沸点高于膦(PH3),原因是________ 。
(3)某镍白铜合金的立方晶胞结构如图所示,该合金的化学式为________ 。

(1)镍元素基态原子的价电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②1 mol [Ni(NH3)6]2+含有σ键为
③氨的沸点高于膦(PH3),原因是
(3)某镍白铜合金的立方晶胞结构如图所示,该合金的化学式为

您最近一年使用:0次
解题方法
4 . 下列说法中错误的是( )


A.从CH4、NH 、SO 、SO 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、PO 、PO 也为正四面体结构 也为正四面体结构 |
| B.12g金刚石晶体中,平均含有2NAC—C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2020-11-22更新
|
195次组卷
|
3卷引用:四川省乐山十校2020-2021学年高二上学期半期联考化学试题
四川省乐山十校2020-2021学年高二上学期半期联考化学试题山东省滨州市博兴县、阳信县2020-2021学年高二下学期联合期中考试化学试题(已下线)3.2 分子晶体与共价晶体(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
5 . 关于CO2说法正确的是( )
| A.CO2是直线型结构 | B.碳原子采取sp3杂化 |
| C.CO2分子中含非极性键 | D.CO2为极性分子 |
您最近一年使用:0次
2020-11-21更新
|
266次组卷
|
2卷引用:辽宁省大连市普兰店区第一中学2021届高三第一阶段考试化学试题
名校
解题方法
6 . 下列分子或离子中,不含有孤对电子的是( )
| A.H2O | B.H3O+ | C.NH3 | D.NH |
您最近一年使用:0次
2020-11-20更新
|
474次组卷
|
12卷引用:2015-2016学年贵州省思南中学高二下第一次月考化学试卷
2015-2016学年贵州省思南中学高二下第一次月考化学试卷(已下线)同步君 选修3 第二章 第二节 第一课时 价电子互斥理论宁夏育才中学勤行校区2016-2017学年高二下学期第一次(3月)月考化学试题高中化学人教版 选修三 第2章 分子结构与性质 价电子对互斥理论人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第1课时)广西蒙山县第一中学2017-2018学年高二下学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——基态原子核外电子排布【选择基础专练】宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题(已下线)作业09 配合物与超分子-2021年高二化学暑假作业(人教版2019)内蒙古赤峰市元宝山区第一中学2021-2022学年高二下学期4月月考化学试题浙江省海盐高级中学2021-2022学年高二下学期开学测试化学试题
解题方法
7 . 2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,回答下列问题。

(1)基态P原子中,电子占据的最高能级符号为___ 。
(2)磷酸氯喹中N-H键是___ σ键,NH3易液化,其原因是___ 。
(3)PO 的空间构型是
的空间构型是___ ,与PO 互为等电子体的分子是
互为等电子体的分子是___ (写一种即可)。
(4)磷化镓是人工合成的III-V族化合物半导体材料。其晶胞结构可看作金刚石晶胞内部的碳原子被Ga原子代替,顶点和面心的碳原子被P原子代替。
①磷化镓晶体中含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.极性键F.非极性键
②设磷化镓的晶体密度为ag·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___ pm(用代数式表示)。

(1)基态P原子中,电子占据的最高能级符号为
(2)磷酸氯喹中N-H键是
(3)PO
 的空间构型是
的空间构型是 互为等电子体的分子是
互为等电子体的分子是(4)磷化镓是人工合成的III-V族化合物半导体材料。其晶胞结构可看作金刚石晶胞内部的碳原子被Ga原子代替,顶点和面心的碳原子被P原子代替。
①磷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键F.非极性键
②设磷化镓的晶体密度为ag·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为
您最近一年使用:0次
名校
解题方法
8 . 一项科学研究成果表明,铜锰氧化物(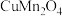 )能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的 和
和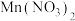 溶液中加入
溶液中加入 溶液,所得沉淀经高温灼烧,可制得
溶液,所得沉淀经高温灼烧,可制得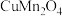 .
.
① 基态的电子排布式可表示为
基态的电子排布式可表示为__________ 。
② 的空间构型是
的空间构型是__________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为 ,HCHO被氧化为
,HCHO被氧化为 和
和 ,
,
① 分子中O原子轨道的杂化类型为
分子中O原子轨道的杂化类型为__________ 。
②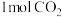 中含有的
中含有的 键数目为
键数目为__________ 。
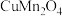 )能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。(1)向一定物质的量浓度的
 和
和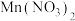 溶液中加入
溶液中加入 溶液,所得沉淀经高温灼烧,可制得
溶液,所得沉淀经高温灼烧,可制得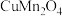 .
.①
 基态的电子排布式可表示为
基态的电子排布式可表示为②
 的空间构型是
的空间构型是(2)在铜锰氧化物的催化下,CO被氧化为
 ,HCHO被氧化为
,HCHO被氧化为 和
和 ,
,①
 分子中O原子轨道的杂化类型为
分子中O原子轨道的杂化类型为②
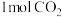 中含有的
中含有的 键数目为
键数目为
您最近一年使用:0次
2020-11-17更新
|
772次组卷
|
3卷引用:新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题
新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题(已下线)易错26 共价键的类型-备战2021年高考化学一轮复习易错题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构
解题方法
9 . A﹣234是2018年关注度最高的8大分子之一,其结构为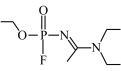 。请根据其结构及其组成元素回答以下问题:
。请根据其结构及其组成元素回答以下问题:
(1)A﹣234分子中N原子的杂化方式为_______ ,该物质所形成的晶体类型为_______ ,基态P原子中核外电子占据的最高能级符号是_______ 。
(2)N、O、F的第一电离能由大到小的顺序为_______ 。
(3)用价层电子对互斥模型预测POF3的立体构型:_______ 。
(4)请比较NH3与NF3的键角大小:NH3_______ (填“>”、“<”或“=”)NF3。
(5)P能够形成PCl3和PCl5,而N只能形成NCl3,其原因是_______ 。
(6)N与Ga所形成的化合物被誉为21世纪引领5G时代的基石材料,其晶胞为六方晶型,如图所示。晶胞参数a=xnm,c=ynm。N原子的配位数为_______ ,该晶胞的密度为_______ g/cm3(用含有x、y的式子表示)。

 。请根据其结构及其组成元素回答以下问题:
。请根据其结构及其组成元素回答以下问题:(1)A﹣234分子中N原子的杂化方式为
(2)N、O、F的第一电离能由大到小的顺序为
(3)用价层电子对互斥模型预测POF3的立体构型:
(4)请比较NH3与NF3的键角大小:NH3
(5)P能够形成PCl3和PCl5,而N只能形成NCl3,其原因是
(6)N与Ga所形成的化合物被誉为21世纪引领5G时代的基石材料,其晶胞为六方晶型,如图所示。晶胞参数a=xnm,c=ynm。N原子的配位数为

您最近一年使用:0次
名校
解题方法
10 . 下列分子或离子之间互为等电子体的是( )
| A.CH4和H3O+ | B.NO 和SO2 和SO2 | C.O3和CO2 | D.N2和C |
您最近一年使用:0次



