名校
解题方法
1 . 锂离子电池已破广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯无水溶液作电解液。回答下列问题:
(1)基态锂原子的电子排布图为________ 。基态磷原子子中,电子占据的最高能层符号为_____________ 。
(2)PO 的空间构型为
的空间构型为_______________ 。
(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为____________ 。
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为_____ ,分子中碳原子的杂化轨道类型为____ ,1 mol碳酸二乙酯中含有σ键的数目为_____ NA(NA为阿伏加德罗常数的值)。

(5)在元素周期表中,铁元素位于____ 区(填“s”“p”“d”或“ds”)。γ—Fe 的堆积方式如图2所示,其空间利用率为________ (用含π的式子表示)。
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为____________ 。
(1)基态锂原子的电子排布图为
(2)PO
 的空间构型为
的空间构型为(3)[Co(NH3)3Cl3]中Co3+的配位数为6,该配合物中的配位原子为
(4)碳酸二乙酯的分子结构如图1所示,分子中所含元素的电负性由小到大的顺序为

(5)在元素周期表中,铁元素位于
(6)氮化锂是一种新型无机贮氢材料,如图3所示,该晶体的化学式为
您最近一年使用:0次
2020-12-31更新
|
231次组卷
|
3卷引用:安徽省皖南八校2021届高三第二次联考(12月)理综合化学试题
名校
解题方法
2 . 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,回答下列问题:
(1)基态Ni2+的电子排布式为_______ 。
(2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为_______ 。
②Ni、N、O三种元素的第一电离能由小到大的顺序是为_____ 。
③液氨中存在电离平衡2NH3⇌NH + NH
+ NH ,根据价层电子对互斥理论,可推知NH2—的空间构型为
,根据价层电子对互斥理论,可推知NH2—的空间构型为_______ ,液氨体系内,氮原子的杂化轨道类型为_____ 。NH3比PH3更容易液化的原因为_____ 。
(3)氧化镍晶胞如图所示,镍离子的配位数为_______ 。
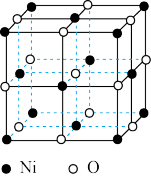
已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为______ g/cm3。
(1)基态Ni2+的电子排布式为
(2)①在1mol[Ni(NH3)6]2+中含有σ键的数目为
②Ni、N、O三种元素的第一电离能由小到大的顺序是为
③液氨中存在电离平衡2NH3⇌NH
 + NH
+ NH ,根据价层电子对互斥理论,可推知NH2—的空间构型为
,根据价层电子对互斥理论,可推知NH2—的空间构型为(3)氧化镍晶胞如图所示,镍离子的配位数为

已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为
您最近一年使用:0次
名校
3 . (1)尿素又称碳酰胺,在160℃分解为氨气和异氰酸,请写出尿素的结构式和氨气的空间构型___________ ;___________ 。
(2) 的沸点
的沸点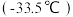 高于
高于 的沸点
的沸点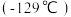 的主要原因是
的主要原因是___________ 。
(3) 可用于漂白和杀菌,请写出一定条件下
可用于漂白和杀菌,请写出一定条件下 与水反应的方程式
与水反应的方程式___________ 。
(2)
 的沸点
的沸点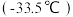 高于
高于 的沸点
的沸点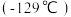 的主要原因是
的主要原因是(3)
 可用于漂白和杀菌,请写出一定条件下
可用于漂白和杀菌,请写出一定条件下 与水反应的方程式
与水反应的方程式
您最近一年使用:0次
名校
解题方法
4 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵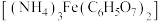 。
。
(1)Fe基态核外电子排布式为_______ ; 中与
中与 配位的原子是
配位的原子是_______ (填元素符号)。
(2) 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是_______ ;C、N、O元素的第一电离能由大到小的顺序为_______ 。
(3)与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填化学式)。
(4)柠檬酸的结构简式如图。1mol柠檬酸分子中碳原子与氧原子形成的 键的数目为
键的数目为_______ mol。

(5)偏铝酸钠中阴离子的空间构型_______ 。
(6)氮化硼晶体的晶胞结构与金刚石晶体的晶胞结构相同,氮化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA值,氮化硼的摩尔质量为mg/mol,则氮化硼晶体的体积_______ cm3。
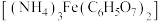 。
。(1)Fe基态核外电子排布式为
 中与
中与 配位的原子是
配位的原子是(2)
 分子中氮原子的轨道杂化类型是
分子中氮原子的轨道杂化类型是(3)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式如图。1mol柠檬酸分子中碳原子与氧原子形成的
 键的数目为
键的数目为
(5)偏铝酸钠中阴离子的空间构型
(6)氮化硼晶体的晶胞结构与金刚石晶体的晶胞结构相同,氮化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA值,氮化硼的摩尔质量为mg/mol,则氮化硼晶体的体积
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
5 . (1)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_______ 、_______ 。
(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________ 、中心原子的杂化形式为_________ 。
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___________ ,气态三氧化硫以单分子形式存在,其分子的立体构型为___________ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。
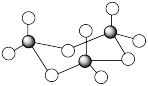
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为___________ ,C原子的杂化形式为___________ 。
(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是

(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为
您最近一年使用:0次
解题方法
6 . 下列判断正确的是( )
| A.BF3是三角锥形分子 |
| B.铵根离子呈平面形结构 |
| C.甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-pσ键 |
| D.甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的4个sp3杂化轨道重叠形成的σ键 |
您最近一年使用:0次
2020-12-10更新
|
366次组卷
|
5卷引用:江苏省盐城市东台市创新学校2019-2020学年高二下学期5月份月检测化学试题
江苏省盐城市东台市创新学校2019-2020学年高二下学期5月份月检测化学试题(已下线)第2章 微粒间相互作用与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)辽宁省南台、岫二、牛庄、海城三中、腾鳌、析木等高级中学2020-2021学年高二上学期期末考试化学试题专题4 综合检测(提升卷)福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题
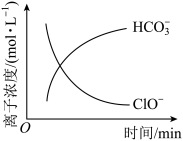
7 . 工业废水进行无害化处理过程中主要存在ClO﹣、N2、 、CNO﹣ 、Cl﹣等微粒,对溶液中部分离子浓度进行了跟踪监测,监测结果如图。下列说法正确的是
、CNO﹣ 、Cl﹣等微粒,对溶液中部分离子浓度进行了跟踪监测,监测结果如图。下列说法正确的是
 、CNO﹣ 、Cl﹣等微粒,对溶液中部分离子浓度进行了跟踪监测,监测结果如图。下列说法正确的是
、CNO﹣ 、Cl﹣等微粒,对溶液中部分离子浓度进行了跟踪监测,监测结果如图。下列说法正确的是
A. 中碳原子的杂化方式为sp3 中碳原子的杂化方式为sp3 |
B.处理过程中发生反应:2CNO﹣+3ClO﹣+H2O=2 +N2+3Cl﹣ +N2+3Cl﹣ |
| C.处理过程中每产生22.4L N2转移6 mol e﹣ |
| D.处理过程中加入硫酸使溶液呈强酸性,可达到更好的处理效果 |
您最近一年使用:0次
2020-12-06更新
|
151次组卷
|
2卷引用:山东省青岛市黄岛区2021届高三上学期期中考试化学试题
名校
解题方法
8 . 储氯合金能有效解决氢气的贮在和输运问题,对大规模使用氢能具有重要的意义。
(1)镍氢电池放电时的总反应为NiOOH+MH = Ni (OH)₂+ M,M表示储氢合金。Ni3+的价层电子排布式为___________ 。
(2)用KF/HF溶液对储氢合金表面进行氟化处理,能改善合金的表面活性。
①HF与水能按任何比例互溶,原因是__________ 。
②已知 ,KHF2晶体中的作用力类型有
,KHF2晶体中的作用力类型有__________ 。
(3)用KBH4和NaH2PO4处理储氢合金电极。KBH4中阴离子的空间构型是_________ 。NaH2PO4中阴离子中心原子的杂化类型是_________ 。
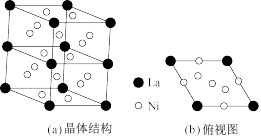
(4)某储氢合金的结构属六方晶系,晶体结构(底面夹角为60度)及俯视图分别如下图(a). (b)所示,该储氢合金的化学式是_____ ( 填最简式)。已知该储氢合金晶胞底边长为a=0.5017nm,高为c=0.3977nm,设阿伏加德罗常数的值为NA,该晶体的密度为____ g·cmˉ³(列出计算式)。
(1)镍氢电池放电时的总反应为NiOOH+MH = Ni (OH)₂+ M,M表示储氢合金。Ni3+的价层电子排布式为
(2)用KF/HF溶液对储氢合金表面进行氟化处理,能改善合金的表面活性。
①HF与水能按任何比例互溶,原因是
②已知
 ,KHF2晶体中的作用力类型有
,KHF2晶体中的作用力类型有(3)用KBH4和NaH2PO4处理储氢合金电极。KBH4中阴离子的空间构型是
(4)某储氢合金的结构属六方晶系,晶体结构(底面夹角为60度)及俯视图分别如下图(a). (b)所示,该储氢合金的化学式是

您最近一年使用:0次
解题方法
9 . 钛被称为“国防金属”。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C 2TiCl4+2FeCl3+6CO;TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO;TiO2+2Cl2+2C TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg Ti+2MgCl2。
Ti+2MgCl2。
(1)基态钛原子的电子排布式为____ 。
(2)与CO互为等电子体的阴离子为___ (填化学式)。
(3)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于____ (填“原子”“分子”或“离子”)晶体。
(4)TiO2+与H2O2在稀HNO3中反应生成橘红色的[TiO(H2O2)]2+离子,可用于钛的定性检验。
① 空间构型为
空间构型为_____________ 。
②H2O2中O原子轨道杂化类型为______________ 。
(5)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则其中Ti4+的配位数为____ 。

 2TiCl4+2FeCl3+6CO;TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO;TiO2+2Cl2+2C TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg Ti+2MgCl2。
Ti+2MgCl2。(1)基态钛原子的电子排布式为
(2)与CO互为等电子体的阴离子为
(3)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于
(4)TiO2+与H2O2在稀HNO3中反应生成橘红色的[TiO(H2O2)]2+离子,可用于钛的定性检验。
①
 空间构型为
空间构型为②H2O2中O原子轨道杂化类型为
(5)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则其中Ti4+的配位数为

您最近一年使用:0次
解题方法
10 . 中国在激光武器研发领域走在了世界的前列,而氟代硼酸钾(KBe2BO3F2)就是制备激光器的核心材料。回答下列问题:
(1)基态氟原子核外电子占据最高能级的电子云形状为___ 形。
(2)氟代硼酸钾中非金属原子的电负性由大到小顺序是___ 。
(3)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是___ ,中心原子的杂化形式为___ ;NaBH4中存在___ (填标号)。
a.离子键 b.氢键 C.σ键 d.π键
(4)[H2F][SbF6](氟锑酸)是一种超强酸,写出与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是___ 、___ (各举一例)。
(5)萤石[CaF2]是一种常用的助溶剂,其晶胞结构如图所示:
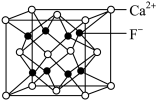
①在晶胞中Ca2+的配位数为___ 。
②若晶胞参数为anm,则CaF2晶胞的密度为___ g•cm-3(设NA为阿伏加德罗常数的值)。
(1)基态氟原子核外电子占据最高能级的电子云形状为
(2)氟代硼酸钾中非金属原子的电负性由大到小顺序是
(3)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是
a.离子键 b.氢键 C.σ键 d.π键
(4)[H2F][SbF6](氟锑酸)是一种超强酸,写出与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是
(5)萤石[CaF2]是一种常用的助溶剂,其晶胞结构如图所示:

①在晶胞中Ca2+的配位数为
②若晶胞参数为anm,则CaF2晶胞的密度为
您最近一年使用:0次



