名校
解题方法
1 . 镁及其化合物在制药、材料及航空等行业中用途广泛,请回答下列问题:
(1)下列 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是________ (填字母,下同),能量最低的是________ 。
a.
b.
c.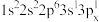
d.
(2)氧化镁是一种传统的耐火材料,熔点为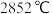 ,其熔融物中有自由移动的
,其熔融物中有自由移动的 和
和 ,上述两种离子半径的大小关系为
,上述两种离子半径的大小关系为___________ 。
(3)叶绿素是自然界中常见的含镁有机化合物,其结构示意图如下所示:

由叶绿素分子的结构可知,其中有 、
、 两种杂化方式的原子有
两种杂化方式的原子有_______ ,分子中存在________ (填字母)。
a.配位键 b. 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键
(4)已知 与部分卤化钠的晶格能及离子间距如下表所示:
与部分卤化钠的晶格能及离子间距如下表所示:
通过玻恩—哈伯循环计算 晶格能的过程如下图所示(能量数据单位均为kJ/mol)。
晶格能的过程如下图所示(能量数据单位均为kJ/mol)。

晶格能的大小与_______ 有关, 的第一电离能为
的第一电离能为_______ kJ/mol。
(5)尖晶石是由镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作为宝石。尖晶石的某种立方晶胞结构如图甲所示,晶胞中含有A型和B型两种结构单元。

则该尖晶石的化学式为________ ,若晶胞边长为 ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则该尖晶石的密度为
,则该尖晶石的密度为_______  (用含有a、
(用含有a、 的代数式表示)
的代数式表示)
(1)下列
 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是a.

b.

c.
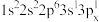
d.

(2)氧化镁是一种传统的耐火材料,熔点为
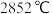 ,其熔融物中有自由移动的
,其熔融物中有自由移动的 和
和 ,上述两种离子半径的大小关系为
,上述两种离子半径的大小关系为(3)叶绿素是自然界中常见的含镁有机化合物,其结构示意图如下所示:

由叶绿素分子的结构可知,其中有
 、
、 两种杂化方式的原子有
两种杂化方式的原子有a.配位键 b.
 键 c.非极性键 d.氢键 e.极性键
键 c.非极性键 d.氢键 e.极性键(4)已知
 与部分卤化钠的晶格能及离子间距如下表所示:
与部分卤化钠的晶格能及离子间距如下表所示:| 化合物 |  |  |  |  |
晶格能 | 3890 | 686 | 736 | 787 |
离子间距 | 205 | 311 | 290 | 276 |
通过玻恩—哈伯循环计算
 晶格能的过程如下图所示(能量数据单位均为kJ/mol)。
晶格能的过程如下图所示(能量数据单位均为kJ/mol)。
晶格能的大小与
 的第一电离能为
的第一电离能为(5)尖晶石是由镁铝氧化物组成的矿物,有些尖晶石透明且颜色漂亮,可作为宝石。尖晶石的某种立方晶胞结构如图甲所示,晶胞中含有A型和B型两种结构单元。

则该尖晶石的化学式为
 ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则该尖晶石的密度为
,则该尖晶石的密度为 (用含有a、
(用含有a、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
2 . 离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物。GaCl3和氯化1﹣乙基3﹣甲基咪唑(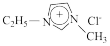 ,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
(1)请写出基态Ga原子的核外电子排布式_____ 。同周期主族元素中基态原子未成对电子数与Ga相同的有_____ 。(填元素符号)。
(2)EMIC阳离子中的几种元素电负性由大到小顺序为_____ 。
(3)已知分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为_____ 。
(4)GaCl3熔点为77.8℃,GaF3熔点高于1000℃,其原因是_____ 。
(5)GaCl3和EMIC混合形成离子液体的过程中会存在以下转变:GaCl3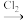 GaCl4
GaCl4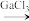 Ga2Cl7请写出Ga2Cl
Ga2Cl7请写出Ga2Cl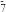 的结构式
的结构式_____ 。
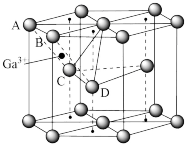
(6)某种Ga的氧化物晶胞结构如图所示。O2﹣以六方密堆积形成晶胞,Ga3+位于由A、C、D四个O2﹣围成的四边形的中心,但晶胞中只有的四边形中心位置占据了Ga3+,另外 的位置空置。
的位置空置。
①Ga3+位于O2﹣围成的_____ 面体空隙中。
②该晶胞中O2﹣的配位数为_____ 。
③若该晶胞的体积为Vcm3,该氧化物晶体密度为_____ 。
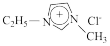 ,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:(1)请写出基态Ga原子的核外电子排布式
(2)EMIC阳离子中的几种元素电负性由大到小顺序为
(3)已知分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为(4)GaCl3熔点为77.8℃,GaF3熔点高于1000℃,其原因是
(5)GaCl3和EMIC混合形成离子液体的过程中会存在以下转变:GaCl3
 GaCl4
GaCl4 Ga2Cl7请写出Ga2Cl
Ga2Cl7请写出Ga2Cl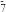 的结构式
的结构式(6)某种Ga的氧化物晶胞结构如图所示。O2﹣以六方密堆积形成晶胞,Ga3+位于由A、C、D四个O2﹣围成的四边形的中心,但晶胞中只有的四边形中心位置占据了Ga3+,另外
 的位置空置。
的位置空置。①Ga3+位于O2﹣围成的
②该晶胞中O2﹣的配位数为
③若该晶胞的体积为Vcm3,该氧化物晶体密度为

您最近一年使用:0次
2020-08-21更新
|
335次组卷
|
3卷引用:湖北省武汉市华中师大第一附中高考化学押题试卷
名校
解题方法
3 . ZnNO3是一种媒染剂,可用于测定血液中硫的浑浊度。锌工工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为____________ ,在基态15N原子的p能级上存在____________ 个自旋方向相同的电子。
(2)N2分子中σ键与π键的数目之比N(σ):N(π)=____________ 。
(3)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为____________ ;
②NH3中,中心原子的轨道杂化类型为____________ ;
③在[Zn(NH3)4]SO4所含元素中,位于p区的元素有____________ 种,p区的这几种元素的第一电离能从大到小的顺序为____________ 。
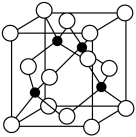
(4)某晶胞结构如图所示(小球为氮原子,大球为硼原子),则该晶胞所表示的晶体的化学式为____________ 晶胞中硼原子的配位数为____________ 。若晶胞边长为acm,则立方氮化硼的密度是____________ g·cm-3(只要求列算式,用NA表示阿伏加 德罗常数的值)。
(1)Zn原子核外电子排布式为
(2)N2分子中σ键与π键的数目之比N(σ):N(π)=
(3)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为
②NH3中,中心原子的轨道杂化类型为
③在[Zn(NH3)4]SO4所含元素中,位于p区的元素有
(4)某晶胞结构如图所示(小球为氮原子,大球为硼原子),则该晶胞所表示的晶体的化学式为

您最近一年使用:0次
2020-08-02更新
|
132次组卷
|
3卷引用:湖北省恩施州2019-2020学年高二下学期期末调研考试化学试题
名校
解题方法
4 . 日前新合成的砷化镉(Cd3As2)三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______________ 。Cd原子中第一电离能相对较大的是_________ 原子(填“基态”或“激发态”)。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3_________ PH3(填“>”或“<”),原因是______________ 。
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为_________ (用元素符号表示)。
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_____________ ,1 mol对氨基苯胂酸含σ键数目为____________ ,其中还含有的化学键类型有___________ (填序号)。

a.氢键 b.离子键 c.π键
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。

建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_____ 。晶胞参数为a pm,阿伏加 德罗常数的值为NA,砷化镉的摩尔质量为M g·mol−1,则该晶胞的密度为_____________ g·cm−3(列计算式即可)。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

a.氢键 b.离子键 c.π键
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。

建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
您最近一年使用:0次
2020-07-26更新
|
418次组卷
|
5卷引用:湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题
湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题(已下线)第十一单元 物质的结构与性质测试题-2021年高考化学一轮复习名师精讲练(已下线)学科网2020年5月高三大联考(新课标Ⅰ卷)化学试题湖南省岳阳市2021届高三二模考试化学试题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)
解题方法
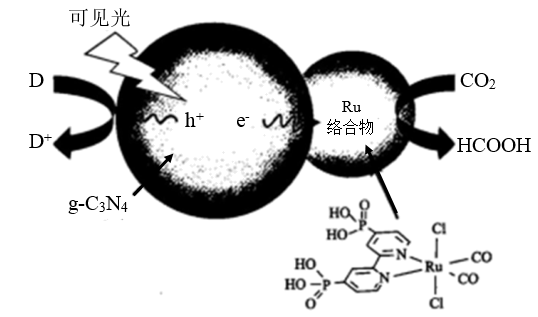
5 . 一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图。
(1)基态碳原子的价电子排布图为___________ 。
(2)1molHCOOH中含有的σ键数目为___________ ,HCOOH的沸点比CO2高的原因为___________ 。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___________ 。
(4)Ru络合物中与Ru配位的原子有N、___________ 。
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
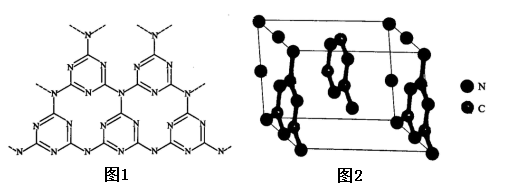
①g-C3N4中氮原子的杂化类型是______________ 。
②根据图2,在图1中用平行四边形画出一个最小重复单元。______________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为______________ g.cm-3。

(1)基态碳原子的价电子排布图为
(2)1molHCOOH中含有的σ键数目为
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为
(4)Ru络合物中与Ru配位的原子有N、
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是
②根据图2,在图1中用平行四边形画出一个最小重复单元。
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为
您最近一年使用:0次
解题方法
6 . 钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为___________ 。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为_________ 。
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是___________ 。
③NH4Cl中存在的作用力有________ ,NH4Cl熔沸点高于CH3CH2OH的原因是________ ,Ti(OCH2CH3)4分子中C原子的杂化形式均为__________ 。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于__________ 位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为__________ m(列出表达式)。

(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Ti原子的价电子排布图为
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl。
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是
③NH4Cl中存在的作用力有
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于

您最近一年使用:0次
解题方法
7 . 已知A、B、C、D、E、F、G都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族,G的最外层只有1个电子。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出E的电子排布式____________ ,E位于周期表____ 区。
(2)B、C、D的第一电离能由小到大的顺序为___________ 。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_________ (填结构简式)
(4) 的空间构型为
的空间构型为___________ ,键角为_______ 。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4往其溶液中加BaCl2溶液时,现象是_______ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则第二种配合物的化学式为_______
(6)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞中平均含有___ 个B原子。若晶胞的棱长为acm,则它的密度为____ g/cm3(NA表示阿伏加 德罗常数)
(7)G的一种氧化物M的晶胞结构如图所示(小圆圈代表氧原子),则M的化学式为________ ,该晶体中氧原子的配位数为_______ 。

(1)写出E的电子排布式
(2)B、C、D的第一电离能由小到大的顺序为
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是
(4)
 的空间构型为
的空间构型为(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4往其溶液中加BaCl2溶液时,现象是
(6)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞中平均含有
(7)G的一种氧化物M的晶胞结构如图所示(小圆圈代表氧原子),则M的化学式为

您最近一年使用:0次
2020-06-16更新
|
245次组卷
|
2卷引用:湖北省恩高芳华中学2022-2023学年高二上学期期末考试化学试卷
名校
解题方法
8 . 光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟硼铍酸钾(KBeBF,含K、B、Be、O、F元素)。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出___ 种波长不同的光。
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是__ 。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是___ 。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF 使酸性大大增强。HF
使酸性大大增强。HF 的结构式为
的结构式为___ ;H3BO3和BF 中,B原子的杂化类型分别为
中,B原子的杂化类型分别为___ 、__ 。
(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为____ 。

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是___ 。

②BeO晶胞中,O的堆积方式为____ ;设O与Be的最近距离为acm,NA表示阿伏加 德罗常数的值,则BeO晶体的密度为____ g·cm-3。
回答下列问题:
(1)一群均处于激发态1s22s13s1的铍原子,若都回到基态,最多可发出
A.1 B.2 C.3 D.4
(2)Be和B都容易与配体形成配位键,如[BeF4]-、[B(OH)4]-等,从原子结构分析其原因是
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F-与HF结合形成HF
 使酸性大大增强。HF
使酸性大大增强。HF 的结构式为
的结构式为 中,B原子的杂化类型分别为
中,B原子的杂化类型分别为(5)KBeBF晶体为层片状结构,图1为其中一层的局部示意图。平面六元环以B—O键和Be—O键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上方或下方,K+分布在层间。KBeBF晶体的化学式为

(6)BeO晶体也是制备KBeBF的原料,图2为其晶胞结构示意图。
①沿着晶胞体对角线方向的投影,下列图中能正确描述投影结果的是

②BeO晶胞中,O的堆积方式为
您最近一年使用:0次
2020-06-14更新
|
552次组卷
|
5卷引用:湖北省武汉市2020届高三毕业生六月供题(一)理综化学试题
湖北省武汉市2020届高三毕业生六月供题(一)理综化学试题山东省济南市章丘区第四中学2019-2020学年高二下学期第七次教学质量检测化学试题河南省驻马店市2019-2020学年高二下学期期末考试化学试题(已下线)第十一单元 物质的结构与性质测试题-2021年高考化学一轮复习名师精讲练河南省驻马店市2019-2020学年高二下学期期末考试化学试题
解题方法
9 . B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工业中有重要用途。请回答下列问题:
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为___ 。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为___ 中心___ (原子)电子键(填阿拉伯数字)。

(2)CF4和PF3的沸点比较CF4___ PF3(选填“>”或“<”)。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是___ 。
(3)基态Mn原子核外特征电子排布式为___ ;已知CO的结构为C≡O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___ 。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=___ 。
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式___ ;A块、B块均为边长为apm的立方体,设阿伏加 德罗常数的值为NA,最近两个Al3+之间的距离为___ pm,尖晶石的密度为___ g/cm3(列出计算式)。
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为

(2)CF4和PF3的沸点比较CF4
(3)基态Mn原子核外特征电子排布式为
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式
您最近一年使用:0次
解题方法
10 . C、N、P、S、Fe、Cu是与人类生产、生活息息相关的化学元素,利用所学知识回答下列问题:
(1)基态Cu原子核外电子排布式为___ ,则高温下的稳定性CuO___ Cu2O(填“>”或“<”);
(2)经研究Cu的某种化合物能催化氧化CO(NH2)2,其中C、N的杂化方式分别为___ ,___ ;
(3)Si、P、S元素的第一电离能由大到小的顺序是___ ;
(4)OF2的空间构型是___ ,分子极性:H2O___ OF2(填“>”或“<”),理由是___ ;
(5)[Fe(CN)6]3-中配位键和π键的个数之比为___ ;
(6)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,原因是___ 。
(1)基态Cu原子核外电子排布式为
(2)经研究Cu的某种化合物能催化氧化CO(NH2)2,其中C、N的杂化方式分别为
(3)Si、P、S元素的第一电离能由大到小的顺序是
(4)OF2的空间构型是
(5)[Fe(CN)6]3-中配位键和π键的个数之比为
(6)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,原因是
您最近一年使用:0次



