名校
解题方法
1 . 硫、钒化合物在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的价层电子排布图为_______ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______ ,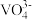 的空间构型为
的空间构型为_______ 。
(2)2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物:
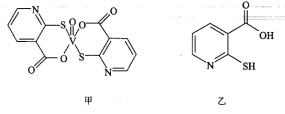
该药物中N原子的杂化方式是_______ ;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物(图甲)的原因是_______ 。
(3)某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为_______ 。图丁为该晶胞的俯视图,该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。

(1)基态钒原子的价层电子排布图为
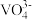 的空间构型为
的空间构型为(2)2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物:

该药物中N原子的杂化方式是
(3)某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2021-03-22更新
|
329次组卷
|
3卷引用:湖北省罗田县第一中学2020-2021学年高二下学期第一次月考化学试题
解题方法
2 . 均由两种短周期元素组成的A、B、C、D四种化合物分子都含有18个电子,四种化合物分子中所含原子的数目依次为2、3、4、6。A和C分子中各元素原子的个数比均为1:1,B和D分子中各元素原子的个数比均为1:2。D可作为火箭推进剂的燃料。请回答下列问题。
(1)A与HF相比,其沸点较低,原因是____ 。
(2)B分子的立体构型为____ 形,该分子属于____ (填“极性”或“非极性”)分子。
(3)A、B两种化合物分子的非氢元素原子的最高价氧化物对应的水化物的酸性强弱顺序为____ (用化学式表示),设A分子的非氢元素原子为X,B分子的中心原子为Y,比较下列物质的酸性强弱:HXO_____ HXO3____ HXO4(填“>”“<”或“=”,下同);H2YO3____ H2YO4。
(4)D分子中心原子的杂化方式是____ ,由该原子组成的单质分子中包含____ 个π键,与该单质分子互为等电子体的常见分子的分子式为___ 。
(1)A与HF相比,其沸点较低,原因是
(2)B分子的立体构型为
(3)A、B两种化合物分子的非氢元素原子的最高价氧化物对应的水化物的酸性强弱顺序为
(4)D分子中心原子的杂化方式是
您最近一年使用:0次
名校
解题方法
3 . 下表为长式周期表的一部分其中的编号代表对应的元素。
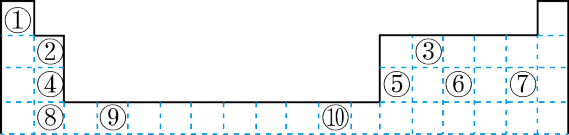
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
名校
解题方法
4 . 过渡元素铜的配合物在物质制备、尖端技术、医药科学、催化反应、材料化学等领域有着广泛的应用。请回答下列问题:
(1)科学家推测胆矾(CuSO4·5H2O)的结构示意图可简单表示如下图:

用配合物的形式表示胆矾的化学式为______ ; 的空间构型为
的空间构型为______ ,其中硫原子的轨道杂化方式为______ 。
(2)Cu能与(SCN)2反应生成Cu(SCN)2。1 mol(SCN)2中含有的π键数目为______ ;(SCN)2对应的酸有两种,分别为硫氰酸 和异硫氰酸
和异硫氰酸 ,其中异硫氰酸的沸点较高,原因是
,其中异硫氰酸的沸点较高,原因是______ 。
(3)向硫酸铜溶液中,加入NaCl固体,溶液由蓝色变为黄绿色,则溶液中铜元素的主要存在形式是______ (写微粒符号);向上述溶液中继续滴加浓氨水,先有蓝色沉淀生成,继续滴加浓氨水后,沉淀溶解,溶液变为深蓝色。沉淀溶解的原因是______ (用离子方程式表示)。
(4)Cu单独与氨水、过氧化氢都不反应,但能与氨水和过氧化氢的混合溶液反应,发生的化学方程式为______ 。
(1)科学家推测胆矾(CuSO4·5H2O)的结构示意图可简单表示如下图:

用配合物的形式表示胆矾的化学式为
 的空间构型为
的空间构型为(2)Cu能与(SCN)2反应生成Cu(SCN)2。1 mol(SCN)2中含有的π键数目为
 和异硫氰酸
和异硫氰酸 ,其中异硫氰酸的沸点较高,原因是
,其中异硫氰酸的沸点较高,原因是(3)向硫酸铜溶液中,加入NaCl固体,溶液由蓝色变为黄绿色,则溶液中铜元素的主要存在形式是
(4)Cu单独与氨水、过氧化氢都不反应,但能与氨水和过氧化氢的混合溶液反应,发生的化学方程式为
您最近一年使用:0次
2021-01-29更新
|
269次组卷
|
3卷引用:湖北省黄冈市黄梅县育才高级中学2023-2024学年高二下学期3月月考化学试题
5 . 磷及其化合物在工农业生产中具有重要用途。如图所示为提纯白磷样品(含惰性杂质)的工艺流程。回答下列问题:

(1)基态Cu原子的价层电子排布式为_______ ,在第四周期过渡金属中,基态原子未成对电子数最多的元素是_______ (填元素符号)。基态Ca原子核外占据最高能层电子的电子云轮廓图形状为_______ 。
(2) 的空间结构为
的空间结构为_______ ,P原子杂化轨道类型_______ 。
(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,氮元素的E1呈现异常的原因是_______ 。

(4)bte的分子式为 ,其结构简式如图所示。
,其结构简式如图所示。

①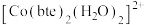 中,与
中,与 形成配位键的原子是
形成配位键的原子是_______ 和_______ (填元素符号)。
②C、H、N的电负性从大到小顺序为_______ 。
③1mol bte分子中含有σ键的数目为_______ mol。

(1)基态Cu原子的价层电子排布式为
(2)
 的空间结构为
的空间结构为(3)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,氮元素的E1呈现异常的原因是

(4)bte的分子式为
 ,其结构简式如图所示。
,其结构简式如图所示。
①
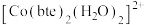 中,与
中,与 形成配位键的原子是
形成配位键的原子是②C、H、N的电负性从大到小顺序为
③1mol bte分子中含有σ键的数目为
您最近一年使用:0次
解题方法
6 . 碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)基态碳原子的轨道表示式为_______ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_______ 、_______ 。
(3)金刚石的熔点高于C60的原因是_______ 。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因之一是金刚石中只存在C-C间的_______ 共价键,而石墨层内的C-C间不仅存在_______ 共价键,还有_______ 键。
(5)金刚石晶胞含有_______ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r =_______ a,列式表示碳原子在晶胞中的空间占有率_______ (不要求计算结果)。

回答下列问题:
(1)基态碳原子的轨道表示式为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)金刚石的熔点高于C60的原因是
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因之一是金刚石中只存在C-C间的
(5)金刚石晶胞含有
您最近一年使用:0次
名校
解题方法
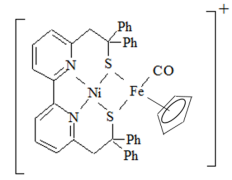
7 . (1)Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子( ),该配体以π电子参与配位,其中Ni2+的价电子排布式为
),该配体以π电子参与配位,其中Ni2+的价电子排布式为______ ,配合物离子中铁周围的价电子数共有______ 个,S元素的杂化方式为______ ,该配合物离子中的 (Ⅰ)和气态
(Ⅰ)和气态 分子(Ⅱ)的三键相比,键长较长的为
分子(Ⅱ)的三键相比,键长较长的为______ (用Ⅰ或Ⅱ表示)。
(2)CsAuCl3的结构不能表示为CsCl·AuCl2,实际上可看作一种阳离子和两种阴离子按照个数比为2∶1∶1形成的,这两种阴离子形状分别是直线型和平面正方形,在平面正方形离子中Au的化合价为______ 。基态Cs原子中电子占据的能量最高的轨道是______ ,能量最低的空轨道是______ 。
(3)如果m个原子有相互平行的p轨道,这些p轨道中共有n个电子(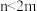 ),则可以形成大π键,表示为
),则可以形成大π键,表示为 ,则SO2分子中的大π键可以表示为
,则SO2分子中的大π键可以表示为______ 。
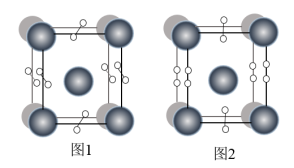
(4)如图表示的是某物质的两种结构的晶胞(大球表示的是K原子,小球表示O原子)图1中的O2单元空间取向有______ 种。若K之间底面上的最近距离为a pm,竖直方向上为c pm,图2表示的晶体密度为______  ,(NA表示阿伏加德罗常数)
,(NA表示阿伏加德罗常数)
 ),该配体以π电子参与配位,其中Ni2+的价电子排布式为
),该配体以π电子参与配位,其中Ni2+的价电子排布式为 (Ⅰ)和气态
(Ⅰ)和气态 分子(Ⅱ)的三键相比,键长较长的为
分子(Ⅱ)的三键相比,键长较长的为
(2)CsAuCl3的结构不能表示为CsCl·AuCl2,实际上可看作一种阳离子和两种阴离子按照个数比为2∶1∶1形成的,这两种阴离子形状分别是直线型和平面正方形,在平面正方形离子中Au的化合价为
(3)如果m个原子有相互平行的p轨道,这些p轨道中共有n个电子(
 ),则可以形成大π键,表示为
),则可以形成大π键,表示为 ,则SO2分子中的大π键可以表示为
,则SO2分子中的大π键可以表示为(4)如图表示的是某物质的两种结构的晶胞(大球表示的是K原子,小球表示O原子)图1中的O2单元空间取向有
 ,(NA表示阿伏加德罗常数)
,(NA表示阿伏加德罗常数)
您最近一年使用:0次
2021-01-03更新
|
580次组卷
|
4卷引用:八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)
八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题08 物质结构与性质(一)(选修)-【考前抓大题】备战2021年高考化学(全国通用)湖南省常德市汉寿县第一中学2022届高三下学期第三次模考化学试题山东省菏泽市单县第二中学2023届高三第一次模拟考试化学试题
解题方法
8 . 碳、铜、锡及其化合物有许多用途。回答下列问题。
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为______ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的热稳定性比NH3__________ (填“强”或“弱”);P、S的第二电离能(I2)的大小关系为I2(P) __________ I2(S)(填“>”“<”或“=”),原因是_______________ 。
(3)CH3CH2COOH中C的杂化方式有_________ ;1mol苯中含σ键的数目为________ 。
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为a nm,则晶体密度为__________ g·cm−3(用含NA的代数式表示);该晶体中P原子位于由铜原子形成的正八面体的空隙中,则该正八面体的边长为________ nm。
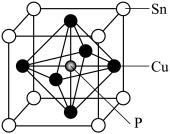
(1)在元素周期表里,锡和碳同族,锡位于第五周期。基态锡原子的最外层电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的热稳定性比NH3
(3)CH3CH2COOH中C的杂化方式有
(4)磷青铜晶体的晶胞结构如图所示,该晶体中P原子与最近的Cu原子的核间距为a nm,则晶体密度为

您最近一年使用:0次
名校
解题方法
9 . 由P、S、Cl、Mg、Ni、Sn等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____________ ,P、S、Cl的第一电离能由大到小顺序为___________ 。
(2)SCl2分子中的中心原子杂化轨道类型是_________ ,该分子构型为_______ 。
(3)Ni与CO能形成配合物Ni(CO)4,1mol该分子中配位键个数为_______ 。
(4)已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO________ NiO(填“>”、“<”或“=”),理由是________ 。
(5)一个金刚石晶胞含有_______ 个碳原子。已知灰锡的晶体结构和金刚石相似,灰锡的相对原子质量为M,晶胞边长为apm,则其晶体的密度ρ=________ g·cm-3
(1)基态Cl原子核外电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Ni与CO能形成配合物Ni(CO)4,1mol该分子中配位键个数为
(4)已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO
(5)一个金刚石晶胞含有
您最近一年使用:0次
名校
解题方法
10 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
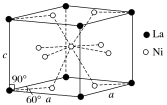
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:2016届湖北省襄阳五中高三5月模拟三理综化学试卷
2016届湖北省襄阳五中高三5月模拟三理综化学试卷湖北省孝感市八校2018届高三上学期期末考试理综化学试题2016届河北省晋州一中高三上学期期末理综化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷四川省内江市2017届高三第五次模拟考试理综化学试题陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题苏教版2017届高三单元精练检测十一化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)



