解题方法
1 . (1)根据杂化轨道理论判断下列分子的空间构型是V形的是_____ (填序号)。
a . BeCl2b . H2O c . HCHO d . CS2
(2)已知AlCl3的沸点:1 90 ℃ (2.5个大气压),但是它在178 ℃就开始升华,则AlCl3的晶体类型为_______ ;为什么工业上一般不采用电解熔融氯化铝的方法制备金属铝________ 。 (3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为__________ , Q2+的未成对电子数是______ 。
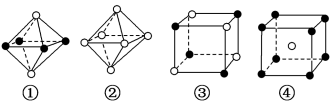
(4)下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是下图中的_______ (填序号)。
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有_______ (填序号)。
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键
已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
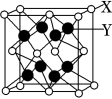
(6)X与Y可形成离子化合物,其晶胞结构如图所示,其中X和Y的相对原子质量分别为a和b,晶体密度为pg · cm-3,则晶胞中距离最近的X、Y之间的核间距离是_____ cm 。( NA表示阿伏伽德罗常数,用含p、a、b、N的代数式表达)
a . BeCl2b . H2O c . HCHO d . CS2
(2)已知AlCl3的沸点:1 90 ℃ (2.5个大气压),但是它在178 ℃就开始升华,则AlCl3的晶体类型为
(4)下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是下图中的
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键
已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(6)X与Y可形成离子化合物,其晶胞结构如图所示,其中X和Y的相对原子质量分别为a和b,晶体密度为pg · cm-3,则晶胞中距离最近的X、Y之间的核间距离是
您最近一年使用:0次
解题方法
2 . [化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________ ,D原子的杂化类型为_______________ 。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________ (填“大于”、“小于”、或“等于”)N的沸点,原因是_______________ 。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________ 。写出相应的化学反应方程式:____________________ 。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________ ,加入乙醇的作用是________________ 。
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________ 。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______ g.cm-3
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为

您最近一年使用:0次
解题方法
3 . 黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:
回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________ ;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________ ;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________ ;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________ 。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________ 。
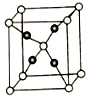
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
①每个Fe2+周围最近的等距离的S22-离子有____________ 个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________ g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
 ,
,
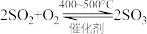 ,
,
 。
。
回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是
(2)常温下Fe3+比Fe2+要更加稳定的原因是
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。

①每个Fe2+周围最近的等距离的S22-离子有
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为
您最近一年使用:0次
解题方法
4 . PHB树脂可被微生物降解,对环境友好,有机物F是医药合成中间体。它们的合成路线如下:
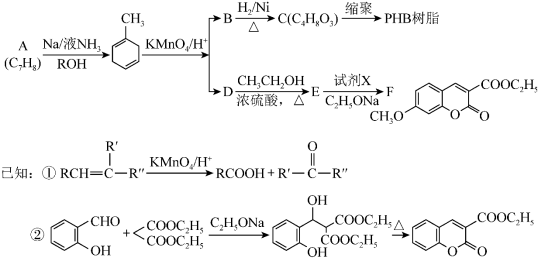
请回答下列问题:
(1)A分子中碳原子的杂化轨道类型是___________ ,化合物B的官能团名称是___________ 。
(2)D→E的化学方程式为______________________________ 。
(3)B→C的反应类型是____________ ,试剂X的结构简式是_____________ 。
(4)由化合物C合成PHB树脂的化学方程式是___________________________ 。
(5)写出满足下列条件的E的所有同分异构体的结构简式:________________ 。
a.核磁共振氢谱有2组峰;
b.不与Na2CO3溶液反应,能发生水解反应生成二元羧酸。

请回答下列问题:
(1)A分子中碳原子的杂化轨道类型是
(2)D→E的化学方程式为
(3)B→C的反应类型是
(4)由化合物C合成PHB树脂的化学方程式是
(5)写出满足下列条件的E的所有同分异构体的结构简式:
a.核磁共振氢谱有2组峰;
b.不与Na2CO3溶液反应,能发生水解反应生成二元羧酸。
您最近一年使用:0次
5 . Ⅰ.黑火药是中国古代四大发明之一,已知它在爆炸时发生反应的化学方程式为:
S+2KNO3+3C==A+N2↑+3CO2↑(已配平,A特指某一晶体);请回答下列问题:
(1)S外,上述元素的电负性从大到小依次为________________ (填写元素符号)。
(2)在生成物中,A的晶体类型为__________ ,含极性共价键的分子内的中心原子轨道杂化类型为__________ 。
(3)已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为___________ 。
Ⅱ.原子序数小于36的元素E和G,在周期表中既处于同一周期又位于同一族,且原子序数G比E多2。
(4)则G元素的基态原子外围电子(价电子)排布式为___________ ;E3+离子的核外未成对电子数是___________ 。
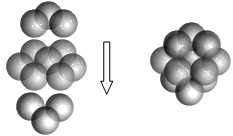
Ⅲ.若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
(5)则晶胞中该原子的配位数为___________ ;该晶胞的空间利用率为________________ 。该单质晶体中原子的堆积方式为四种基本堆积方式中的____________ 。

Ⅳ.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR—HRx [CrCln(H2O)6﹣n]+xH+;交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
[CrCln(H2O)6﹣n]+xH+;交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
(6)现将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00mL,可知该配离子的化学式为___________ ,中心离子的配位数为_________ 。
S+2KNO3+3C==A+N2↑+3CO2↑(已配平,A特指某一晶体);请回答下列问题:
(1)S外,上述元素的电负性从大到小依次为
(2)在生成物中,A的晶体类型为
(3)已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为
Ⅱ.原子序数小于36的元素E和G,在周期表中既处于同一周期又位于同一族,且原子序数G比E多2。
(4)则G元素的基态原子外围电子(价电子)排布式为
Ⅲ.若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
(5)则晶胞中该原子的配位数为

Ⅳ.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR—HRx
 [CrCln(H2O)6﹣n]+xH+;交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
[CrCln(H2O)6﹣n]+xH+;交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。(6)现将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00mL,可知该配离子的化学式为
您最近一年使用:0次
解题方法
6 . 氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.在基态Ti2+中,电子占据的最高能层符号为______ ,该能层具有的原子轨道数为_________ .
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2⇌2NH3实现储氢和输氢.下列说法正确的是_____ (填序号).
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4﹣、C1O4﹣互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+中N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是_____________ .
(4)氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.
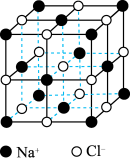
①设氯化钠晶体中Na+与跟它最近邻的Cl﹣之间的距离为r,则与该Na+次近邻的Cl﹣的个数为__________ ,该Na+与跟它次近邻的Cl﹣之间的距离为__________ .
②已知在氯化钠晶体中Na+的半径为a pm,Cl﹣的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为______________ .
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.在基态Ti2+中,电子占据的最高能层符号为
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2⇌2NH3实现储氢和输氢.下列说法正确的是
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4﹣、C1O4﹣互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+中N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是
(4)氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示.

①设氯化钠晶体中Na+与跟它最近邻的Cl﹣之间的距离为r,则与该Na+次近邻的Cl﹣的个数为
②已知在氯化钠晶体中Na+的半径为a pm,Cl﹣的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为
您最近一年使用:0次
解题方法
7 . [化学——选修3:物质结构与性质
周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为___________ ;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是___________________ 。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都能与D形成中心原子杂化方式为_______ 的两元共价化合物。其中,属于不等性杂化的是______ (写化学式)。以上不等性杂化的化合物价层电子对立体构型为__________ ,分子立体构型为_______________ 。
(3)以上不等性杂化化合物成键轨道的夹角____________ (填“大于”、“等于”或“小于”)等性杂化的化合物成键轨道间的夹角。由于C核外比 B多一层电子,C还可以和D形成另一种两元共价化合物。此时C的杂化轨道中没有孤对电子,比起之前C和D的化合物,它的杂化轨道多了一条。其杂化方式为_____________ 。
(4)A和B能形成多种结构的晶体。其中一种类似金刚石的结构,硬度比金刚石还大,是一种新型的超硬材料。其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为____________ 。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24 nm。其晶体密度为___________ (已知: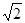 =1.414,
=1.414,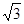 =1.732, 结果精确到小数点后第2位。)
=1.732, 结果精确到小数点后第2位。)
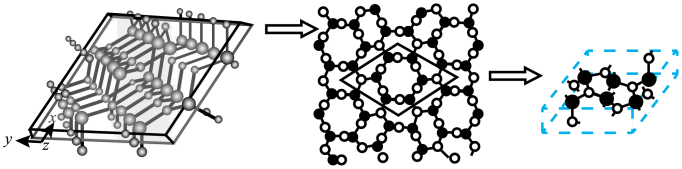
图1 A和B形成的一种晶体结构图 图2 切片层状结构 图3 晶胞结构
(图2和图3中 ○为N原子 ●为C原子)
周期表前三周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都能与D形成中心原子杂化方式为
(3)以上不等性杂化化合物成键轨道的夹角
(4)A和B能形成多种结构的晶体。其中一种类似金刚石的结构,硬度比金刚石还大,是一种新型的超硬材料。其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为
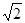 =1.414,
=1.414,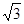 =1.732, 结果精确到小数点后第2位。)
=1.732, 结果精确到小数点后第2位。)
图1 A和B形成的一种晶体结构图 图2 切片层状结构 图3 晶胞结构
(图2和图3中 ○为N原子 ●为C原子)
您最近一年使用:0次
解题方法
8 . 【化学-选修3:物质结构与性质】
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为________________ 。
(2)AB2分子中,A的杂化类型为________________ ;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)__________________ 。
(3)B的氢化物与D的氢化物的沸点较高的是____________ (用化学式表示),原因是______________ 。
(4)AB2形成的晶体的熔点____________ (填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是___________________ 。
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为____________ (用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:_________________________ 。
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为____________ g/cm3.(已知阿伏加德罗常数为NA)
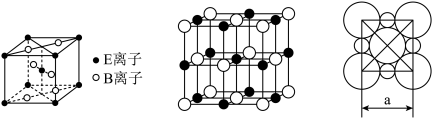
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为
(2)AB2分子中,A的杂化类型为
(3)B的氢化物与D的氢化物的沸点较高的是
(4)AB2形成的晶体的熔点
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为

您最近一年使用:0次
9 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式:______________________________ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有__________ 个方向,原子轨道呈_______ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为 该同学所画的电子排布图违背
该同学所画的电子排布图违背___________________ 。
(4)G位于________ 族________ 区,该元素的核外电子排布式为_________________ 。
(5)DE3中心原子的杂化方式为____________ ,用价层电子对互斥理论推测其空间构型为__________ 。
(6)检验F元素的方法是____________ ,请用原子结构的知识解释产生此现象的原因:_____________ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738 kJ·mol-1 I2=1451 kJ·mol-1 I3=7733 kJ·mol-1 I4=10540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 该同学所画的电子排布图违背
该同学所画的电子排布图违背(4)G位于
(5)DE3中心原子的杂化方式为
(6)检验F元素的方法是
您最近一年使用:0次
2016-12-09更新
|
500次组卷
|
2卷引用:2015-2016学年河北邢台一中高二上学期期中测试化学试卷
名校
10 . 太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是_______ 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为_______ (用元素符号表示)。
(3)气态SeO3分子的立体构型为_______ 。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_______ 。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的 原子杂化类型为_______ ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为_______ ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_______ ,若该晶胞的边长为a pm,则合金的密度为_______ g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(1)镓的基态原子的电子排布式是
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
(3)气态SeO3分子的立体构型为
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的 原子杂化类型为
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为
您最近一年使用:0次
2016-12-09更新
|
697次组卷
|
6卷引用:2015届宁夏银川市九中高三上学期第四次月考理综化学试卷



