名校
解题方法
1 . 碳的化合物在工业上应用广泛。
I. 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。
298K时,相关物质的相对能量如图,

(1) 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为_______ 。
II. 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:
i.催化剂活化: (无活性)
(无活性) (有活性)
(有活性)
ii. 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
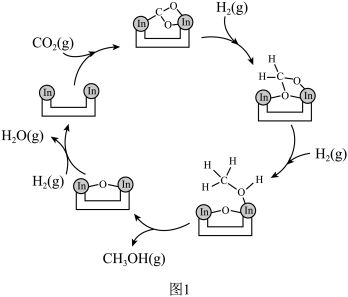
同时伴随反应②:
(2) 与
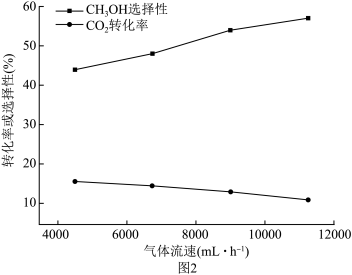
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知: 选择性
选择性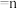 (生成
(生成 所消耗的
所消耗的 的量)
的量)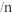 (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是_______ 。同时,流速加快可减少产物中 的积累,减少反应
的积累,减少反应_______ (用化学方程式表示)的发生,减少催化剂的失活,提高甲醇选择性。
(3)对于以上 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。
III.甲烷重整制合成气,主要反应如下:
i.

ii.

各反应平衡常数与温度的关系如图。
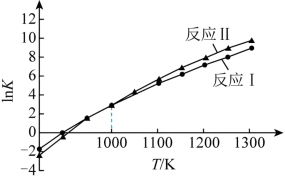
(4)①假设 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则
_______ 0(填“>”或“<”);
_______  (填“>”或“<”)。
(填“>”或“<”)。
②通过调整投料比可调控平衡时合成气 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则
_______ ,应控制投料比
_______ 。
I.
 和乙烷反应制备乙烯。
和乙烷反应制备乙烯。298K时,相关物质的相对能量如图,

(1)
 与乙烷反应生成乙烯、CO和气态水的热化学方程式为
与乙烷反应生成乙烯、CO和气态水的热化学方程式为II.
 制甲醇。以
制甲醇。以 作催化剂,可使
作催化剂,可使 在温和的条件下转化为甲醇,经历如下过程:
在温和的条件下转化为甲醇,经历如下过程:i.催化剂活化:
 (无活性)
(无活性) (有活性)
(有活性)ii.
 与在活化后的催化剂表面可逆的发生反应①:
与在活化后的催化剂表面可逆的发生反应①:
 ,其反应历程如图1。
,其反应历程如图1。
同时伴随反应②:

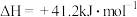
(2)
 与
与 混合气体以不同的流速通过反应器,气体流速与
混合气体以不同的流速通过反应器,气体流速与 转化率、
转化率、 选择性的关系如图2。
选择性的关系如图2。
已知:
 选择性
选择性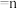 (生成
(生成 所消耗的
所消耗的 的量)
的量)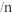 (发生转化的
(发生转化的 的量)。
的量)。 选择性随流速增大而升高的原因是
选择性随流速增大而升高的原因是 的积累,减少反应
的积累,减少反应(3)对于以上
 制甲醇的过程,以下描述正确的是_______。
制甲醇的过程,以下描述正确的是_______。| A.碳的杂化方式没有发生改变 |
B.反应中经历了 、 、 键的形成和断裂 键的形成和断裂 |
C.加压可以提高 的平衡转化率 的平衡转化率 |
| D.升高温度可以提高甲醇在平衡时的选择性 |
III.甲烷重整制合成气,主要反应如下:
i.


ii.


各反应平衡常数与温度的关系如图。

(4)①假设
 、
、 不随温度变化,平衡常数与温度间存在的关系为:
不随温度变化,平衡常数与温度间存在的关系为: ,R为正常数。则
,R为正常数。则

 (填“>”或“<”)。
(填“>”或“<”)。②通过调整投料比可调控平衡时合成气
 的值。1000K,平衡时
的值。1000K,平衡时 ,则
,则

您最近一年使用:0次
名校
解题方法
2 . 铁在工业中有重要作用,也是人体必需的微量元素。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式_______ 。
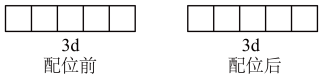
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为_______ ,配离子中Fe3+为d2sp3杂化,写出配位前后Fe3+3d轨道表示式_______ 。
(2)邻二氮菲的结构简式为 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
①中心离子的配位数为_______ ,配位原子的杂化方式为_______ 。
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因_______
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。
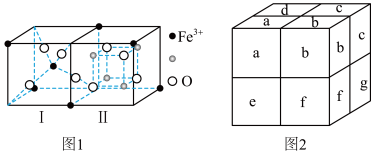
①Fe3O4晶胞中有_______ 个Fe离子, 代表
代表_______ 。
②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为_______ g/cm3。
(1)Fe3+可以和Cl-、F-、CN-、SCN-等配体形成配合物。
①写出基态Fe3+的电子排布式
②向含Fe3+的溶液中加入NaCN将Fe3+转化成配位数为6的稳定配离子,该配离子的化学式为

(2)邻二氮菲的结构简式为
 ,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。
,N原子与Fe2+通过配位键能形成稳定的橙红色的邻二氮菲亚铁离子,这种离子可表示为[Fe(phen)3]2+。该配合物的特征颜色常用于Fe2+检验和浓度的测定。①中心离子的配位数为
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,分析pH太小或太大不适合用邻二氮菲检验Fe2+的原因
(3)Fe3O4晶体是由图1所示的结构平移构成。图1包含I型和II型两种小立方体。图2是Fe3O4的晶胞。

①Fe3O4晶胞中有
 代表
代表②Fe3O4晶胞的晶胞边长为a nm,Fe3O4的密度为
您最近一年使用:0次
解题方法
3 . 现代科技的发展离不开材料的开发与应用,而物质结构理论是材料研究的基础,请回答Ⅰ-Ⅳ的问题。
Ⅰ.使用 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
(1) 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是_______________ 和_______________ 。
(2)1个 分子中存在
分子中存在_______________ 个 键。
键。
(3) 易溶于水的原因是
易溶于水的原因是_____________________ 。
Ⅱ.硒( )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
(4)在基态K原子中,能量最低的空轨道的符号是_____ , 原子的价电子排布式为
原子的价电子排布式为______ 。
(5) 的空间构型为
的空间构型为___________ ,写出一个与 互为等电子体的分子
互为等电子体的分子_____ (填分子式)。
(6)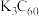 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在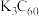 晶胞中,
晶胞中,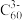 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为_______________ 。

Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是_______________ (填化学名称)。
(8)已知咪唑中存在大 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是_______________ (填“①”或“②”)号氮原子。
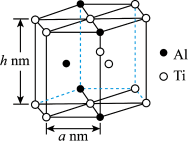
Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示( 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。
(9)列出
_____ cm的计算式,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
Ⅰ.使用
 作原科的电合成技术,为减少
作原科的电合成技术,为减少 排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。
排放提供了一条有吸引力的途径,并为实现碳中和奠定了坚实的基础。(1)
 和
和 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(2)1个
 分子中存在
分子中存在 键。
键。(3)
 易溶于水的原因是
易溶于水的原因是Ⅱ.硒(
 )与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。
)与钾同周期、面与硫同主族,金()在周期表第六周期第ⅠB族。(4)在基态K原子中,能量最低的空轨道的符号是
 原子的价电子排布式为
原子的价电子排布式为(5)
 的空间构型为
的空间构型为 互为等电子体的分子
互为等电子体的分子(6)
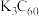 是一种超导材料,是由足球烯(
是一种超导材料,是由足球烯( )与金属钾反应生成的盐。在
)与金属钾反应生成的盐。在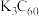 晶胞中,
晶胞中,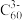 堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,
堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙, 填充在空隙中。晶胞中被
填充在空隙中。晶胞中被 占据的空隙百分比为
占据的空隙百分比为
Ⅲ.咪唑、噻唑、吡啶是含N和S的有机杂环类化合物,结构如图所示:

(7)上述三种物质中,沸点最高的是
(8)已知咪唑中存在大
 键,则在咪唑分子的两个氮原子中,更容易与
键,则在咪唑分子的两个氮原子中,更容易与 形成配位键的是
形成配位键的是Ⅳ.“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(
 、
、 原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为
原子各有一个原子在结构单元内部)。该结构单元底面(正六边形)边长为 ,该合金的密度为
,该合金的密度为 。
。(9)列出
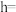
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
您最近一年使用:0次
名校
解题方法
4 . 钛被称为“21世纪的金属”,其单质及化合物具有优异的性能。回答下列问题:
(1)基态钛原子的价电子轨道表示式为_______ 。
(2)钛元素的检验方法如下: 可与
可与 形成稳定的
形成稳定的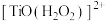 ,其原因是
,其原因是_______ 。
(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的 转化为
转化为 ;将甲基橙、亚甲基蓝、HCHO转化为
;将甲基橙、亚甲基蓝、HCHO转化为 等。
等。_______ 、_______ 。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:_______ ,一个完整晶胞中含有_______ 个Co原子。
②真实的晶体中存在5%的O原子缺陷,从而能让 在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为
在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为_______ ;设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)基态钛原子的价电子轨道表示式为
(2)钛元素的检验方法如下:

 可与
可与 形成稳定的
形成稳定的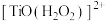 ,其原因是
,其原因是(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的
 转化为
转化为 ;将甲基橙、亚甲基蓝、HCHO转化为
;将甲基橙、亚甲基蓝、HCHO转化为 等。
等。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

②真实的晶体中存在5%的O原子缺陷,从而能让
 在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为
在其中传导,已知La为+3价,则+3价钴与+4价钴的原子个数比为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2022-12-14更新
|
503次组卷
|
3卷引用:山东省实验中学2022-2023学年高三第三次诊断考试化学试题
解题方法
5 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子的电子所占据的最高能层符号为
原子的电子所占据的最高能层符号为_______ ,基态 较基态
较基态 心稳定的原因是
心稳定的原因是_______ ;
(2) 稀溶液中存在
稀溶液中存在 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中
,其中 代表
代表 。该化合物分子中,
。该化合物分子中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有___ 个;C、N、F的电负性由大到小的顺序为____ ;
(4)一种由 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中 原子填充在
原子填充在 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为_____ ;该晶体的化学式为_____ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为 、
、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_____ 晶胞中C、D间距离
_____  。
。

(1)基态
 原子的电子所占据的最高能层符号为
原子的电子所占据的最高能层符号为 较基态
较基态 心稳定的原因是
心稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C. | D. |
 可形成
可形成 ,其中
,其中 代表
代表 。该化合物分子中,
。该化合物分子中, 模型为四面体的非金属原子共有
模型为四面体的非金属原子共有(4)一种由
 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中 原子填充在
原子填充在 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为 、
、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为
 。
。
您最近一年使用:0次
名校
解题方法
6 . 砷是生命的第七元素,可形成多种重要的化合物。回答下列问题:
(1)基态砷原子N电子层中的成对电子与单电子的数量比为_______ 。As的第一电离能(I1)比Se大的原因是_______ 。
(2)雄黄(As4S4)和雌黄(As2S3)在自然界中共生,是提取砷的主要矿物原料,其结构如下图所示,1mol雄黄与O2反应生成As2O3,转移28mol电子,则另一种产物为_______ 。雌黄中As的杂化方式为_______ 。

(3)亚砷酸(H3AsO3)可以用来治疗白血病,为三元弱酸,试推测 的空间构型为
的空间构型为____ 。其酸性弱于砷酸(H3AsO4)的原因是_______ 。
(4)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。晶胞结构如下图所示

已知:砷化镓晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
①连接面心上6个砷原子构成正八面体,该正八面体的边长为_______ pm(用含 和
和 的代数式表示)。
的代数式表示)。
②Ga和 之间的最近距离为
之间的最近距离为_______ nm(用含 和
和 的代数式表示)。
的代数式表示)。
(1)基态砷原子N电子层中的成对电子与单电子的数量比为
(2)雄黄(As4S4)和雌黄(As2S3)在自然界中共生,是提取砷的主要矿物原料,其结构如下图所示,1mol雄黄与O2反应生成As2O3,转移28mol电子,则另一种产物为

(3)亚砷酸(H3AsO3)可以用来治疗白血病,为三元弱酸,试推测
 的空间构型为
的空间构型为(4)砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。晶胞结构如下图所示

已知:砷化镓晶体密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。①连接面心上6个砷原子构成正八面体,该正八面体的边长为
 和
和 的代数式表示)。
的代数式表示)。②Ga和
 之间的最近距离为
之间的最近距离为 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
7 . 压电材料广泛应用于电声换能器、传感器、机器人等方面。最近我国科学家在Science杂上报道了一种有机-无机杂化的压电材料TMCM-MnCl3,该材料具有单斜的晶体结构,晶体结构图如下所示(氢原子未画出),晶胞参数为a=9.478 Å,b= 15. 741 Å,c=6.577 Å,β=94.838° ,晶胞内总共含有84个原子。

(1)写出基态Mn原子的核外电子排布_______ 。
(2)TMCM-MnCl3晶胞内含有_______ 个Mn原子、 _______ 个Cl原子,有机基团的结构简式为_______ 。
(3)TMCM-MnCl3晶体中有机结构单元中C原子杂化类型是_______ ,N原子的杂化类型是_______ ,该晶体中存在_______ (填如下选项标号)。
A.范德华力 B.离子键 C.π键 D.σ键
(4)TMCM-MnCl3晶体中,Cl-C间的化学键为_______ 键,Cl-Mn间的化学键为_______ 键;其中Mn的化合价为_______ 。

(1)写出基态Mn原子的核外电子排布
(2)TMCM-MnCl3晶胞内含有
(3)TMCM-MnCl3晶体中有机结构单元中C原子杂化类型是
A.范德华力 B.离子键 C.π键 D.σ键
(4)TMCM-MnCl3晶体中,Cl-C间的化学键为
您最近一年使用:0次
解题方法
8 . “超导铜”是一种含1%的纳米碳管和99%的铜的合成材料,该材料的导电率约超出纯铜线缆一倍。回答下列问题:
(1)基态Cu原子的电子排布式为____ ,其在周期表是位置为____ 。
(2)硫酸铜溶于水后形成水合铜离子的结构式为____ ,向硫酸铜溶液中逐滴加入氨水直至过量,观察到的现象为____ 。
(3)氨酸络合剂指含有—N(CH2COOH)2基团的有机化合物,它是一类具有广泛络合性能和强的常合能力的络合剂,I、II、III都可以与Cu2+形成络合物。

①预测____ (填编号“I”、“II”、“III”)与Cu2+形成的络合物最稳定。
②下列说法正确的有____ 。
A.I、II、III中N原子的杂化类型都是sp3
B.III中碳氧键的键能均相等
C.III中C—N—C键角小于107.3°
(4)+1价Cu的化合物CsxCuyXz(X=Cl,Br,I)晶体中阴离子存在如图所示链状结构,该结构是[CuX4]-四面体通过共用____ (填“顶点”或“棱”或“面”)而形成的,该晶体的化学式为____ 。

(1)基态Cu原子的电子排布式为
(2)硫酸铜溶于水后形成水合铜离子的结构式为
(3)氨酸络合剂指含有—N(CH2COOH)2基团的有机化合物,它是一类具有广泛络合性能和强的常合能力的络合剂,I、II、III都可以与Cu2+形成络合物。

①预测
②下列说法正确的有
A.I、II、III中N原子的杂化类型都是sp3
B.III中碳氧键的键能均相等
C.III中C—N—C键角小于107.3°
(4)+1价Cu的化合物CsxCuyXz(X=Cl,Br,I)晶体中阴离子存在如图所示链状结构,该结构是[CuX4]-四面体通过共用

您最近一年使用:0次
解题方法
9 . 汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。很多含巯基(-SH)的有机化合物是重金属元素求的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

(1)汞的原子序数为80,与Zn属于同族元素,Hg价电子排布式为_______ ,位于元素周期表_______ 区。
(2)C、O、S分别形成的简单氢化物的沸点由高到低顺序为_______ ,理由_______ 。
(3)预测化合物I溶解性为_______ (填“难溶于水”或“易溶于水”);1mol化合物I中采取sp3杂化的原子数目是_______ 。
(4)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分锗原子被Hg和Sb取代后形成。

①图b为Ce晶胞中部分锗原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_______ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;X晶体的化学式为:_______ ;设X的相对分子质量为 ,则X晶体的密度为
,则X晶体的密度为_______ g·cm-3(列出计算式)。

(1)汞的原子序数为80,与Zn属于同族元素,Hg价电子排布式为
(2)C、O、S分别形成的简单氢化物的沸点由高到低顺序为
(3)预测化合物I溶解性为
(4)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分锗原子被Hg和Sb取代后形成。

①图b为Ce晶胞中部分锗原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
 ,则X晶体的密度为
,则X晶体的密度为
您最近一年使用:0次
解题方法
10 .  是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1) 的价层电子排布式为
的价层电子排布式为___________ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用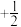 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为___________ 。S可以形成两种常见含氧酸,其通式为 ,判断该两种含氧酸酸性强弱并分析原因
,判断该两种含氧酸酸性强弱并分析原因___________ 。
(3)硫酸铜稀溶液中不存在的作用力有___ (填标号),其中硫酸根的空间构型为___ 。
A.配位键 B.金属键 C.共价键 D.氢键 E.范德华力
(4)硫酸铜溶液中滴入氨基乙酸钠 可得到配合物A,结构如图所示。
可得到配合物A,结构如图所示。

①氨基乙酸钠中碳原子的杂化方式为___ , 氨基乙酸钠含有
氨基乙酸钠含有 键的数目为
键的数目为___________ ;
②配合物A中非金属元素电负性由大到小的顺序为___________ 。
(5) (式量为
(式量为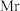 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为___________  (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向
原子沿z轴方向向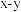 平面投影的位置,在图b中画出S原子在该方向的投影位置
平面投影的位置,在图b中画出S原子在该方向的投影位置___________ (用“●”表示S原子)。

 是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:(1)
 的价层电子排布式为
的价层电子排布式为(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
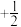 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为 ,判断该两种含氧酸酸性强弱并分析原因
,判断该两种含氧酸酸性强弱并分析原因(3)硫酸铜稀溶液中不存在的作用力有
A.配位键 B.金属键 C.共价键 D.氢键 E.范德华力
(4)硫酸铜溶液中滴入氨基乙酸钠
 可得到配合物A,结构如图所示。
可得到配合物A,结构如图所示。
①氨基乙酸钠中碳原子的杂化方式为
 氨基乙酸钠含有
氨基乙酸钠含有 键的数目为
键的数目为②配合物A中非金属元素电负性由大到小的顺序为
(5)
 (式量为
(式量为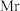 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为 (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向
原子沿z轴方向向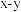 平面投影的位置,在图b中画出S原子在该方向的投影位置
平面投影的位置,在图b中画出S原子在该方向的投影位置
您最近一年使用:0次
2022-04-14更新
|
1740次组卷
|
5卷引用:广东省佛山市普通高中2022届高三教学质量检测(二)化学试题
广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷02(福建卷)(已下线)化学-2022年高考押题预测卷03(全国甲卷)



