名校
解题方法
1 . 据报道,新疆南部发现稀有金属、铅、锌、铁、锰和金矿带约600 m。回答下列问题:
(1)基态锰的价层电子排布式为___________ ;预测:锰的第三电离能( )
)________ (填“大于”“小于”或“等于”)铁的第三电离能( )。
)。
(2)氧化锰能催化氧化HCHO生成 和
和 。
。
①等物质的量的HCHO、 分子中
分子中 键数目之比为
键数目之比为____________________ 。
②在HCHO、 、
、 中,空间构型呈V形的分子是
中,空间构型呈V形的分子是____________________ 。
③HCHO中C原子的杂化类型是____________________ 。
(3) [Zn(NH3)4]SO4中不存在的作用力类型是____________________ (填字母)。
A.非极性键 B.配位键 C.离子键 D.金属键
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:
_______ (填“>”“<”或“=”) ,理由是
,理由是_________________ 。
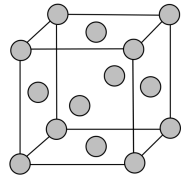
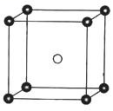
(5)铅晶胞如图所示。
已知:铅晶胞密度为 ,
, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。
晶胞中两个面心上铅原子的最短距离为__________________ pm。
(1)基态锰的价层电子排布式为
 )
) )。
)。(2)氧化锰能催化氧化HCHO生成
 和
和 。
。①等物质的量的HCHO、
 分子中
分子中 键数目之比为
键数目之比为②在HCHO、
 、
、 中,空间构型呈V形的分子是
中,空间构型呈V形的分子是③HCHO中C原子的杂化类型是
(3) [Zn(NH3)4]SO4中不存在的作用力类型是
A.非极性键 B.配位键 C.离子键 D.金属键
(4)配合物在水中的颜色与d轨道的分裂能有关。d轨道的分裂能是1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量。预测分裂能:

 ,理由是
,理由是(5)铅晶胞如图所示。
已知:铅晶胞密度为
 ,
, 代表阿伏加德罗常数的值。
代表阿伏加德罗常数的值。晶胞中两个面心上铅原子的最短距离为

您最近一年使用:0次
解题方法
2 . 氨及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2)是人类最早合成的有机物,工业上生产尿素的反应为N2+3H2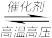 2NH3,2NH3+CO2
2NH3,2NH3+CO2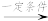 H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:
(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表示式为_______ ,Zn位于元素周期表的______ 区。
(2)C、N、O三种元素第一电离能从大到小的顺序是___________ >
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是________ ,原因是___________ 。
(4)尿素分子中,C原子杂化轨道类型是______ , N原子杂化轨道类型是______ ,σ键与π键数目之比为_______ 。
(5)氮化硼(BN)是-种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼如图(a)和六方氮化硼(b),前者类似于金刚石,后者与石墨相似。

①X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体N与B的原子半径之和为______ pm。(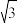 =1.732)
=1.732)
②已知六方氮化硼同层中B、N原子距离为a cm,密度为d g/cm3,则层与层之间距离的计算表达式为__________ 。
 2NH3,2NH3+CO2
2NH3,2NH3+CO2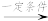 H2NCONH2+H2O。回答下列问题:
H2NCONH2+H2O。回答下列问题:(1)纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表示式为
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)上述化学方程式中的无机化合物,沸点由高到低的顺序是
(4)尿素分子中,C原子杂化轨道类型是
(5)氮化硼(BN)是-种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼如图(a)和六方氮化硼(b),前者类似于金刚石,后者与石墨相似。

①X-射线衍射实验测得立方氮化硼晶胞参数为361.5 pm,则立方氮化硼晶体N与B的原子半径之和为
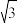 =1.732)
=1.732)②已知六方氮化硼同层中B、N原子距离为a cm,密度为d g/cm3,则层与层之间距离的计算表达式为
您最近一年使用:0次
解题方法
3 . (1)第四周期元素中价层成对电子数与基态Mg价层成对电子数相等的元素有_________ 种。
(2)吡咯(平面形结构,结构式为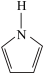 ),N原子杂化方式为
),N原子杂化方式为______ 。多原子分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______ 。
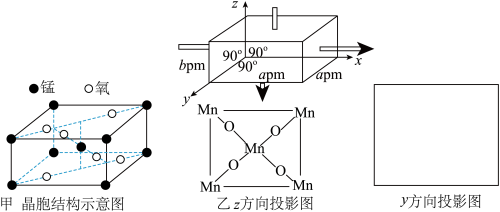
(3)一种锰的氧化物的晶胞如图甲,请写出该氧化物的化学式______ 。若沿z轴方向观察该晶胞,可得投影图如图乙,请画出沿y轴方向的投影图______ 。
(4)某含Mg储氢晶体储氢后转化为MgH2,MgH2晶体的结构如图丙,晶胞参数a=b=450pm,c=301pm,原子分数坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。
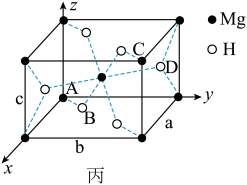
①该晶体中Mg的配位数是__________ 。
②Mg2+的半径为72pm,则H-的半径为____________ pm(列出计算表达式)
③用NA表示阿伏加 德罗常数,则MgH2晶体中氢的密度是标准状况下氢气密度的_______ 倍(列出计算表达式,氢气密度为0.089g·L-1)
(2)吡咯(平面形结构,结构式为
 ),N原子杂化方式为
),N原子杂化方式为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为(3)一种锰的氧化物的晶胞如图甲,请写出该氧化物的化学式

(4)某含Mg储氢晶体储氢后转化为MgH2,MgH2晶体的结构如图丙,晶胞参数a=b=450pm,c=301pm,原子分数坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。

①该晶体中Mg的配位数是
②Mg2+的半径为72pm,则H-的半径为
③用NA表示阿伏加 德罗常数,则MgH2晶体中氢的密度是标准状况下氢气密度的
您最近一年使用:0次
4 . 碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_________ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________ 、________ 。
(3)C60属于_________ 晶体,石墨属于________ 晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的________ 共价键,而石墨层内的C—C间不仅存在_________ 共价键,还有_________ 键。
(5)金刚石晶胞含有________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________ a,列式表示碳原子在晶胞中的空间占有率________ (用含π分数形式表示,不要求写成百分数)。

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C60属于
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的
(5)金刚石晶胞含有
您最近一年使用:0次
5 . 钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________ 周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______ 。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:

①分子中A1原子采取____ 杂化。Al2Cl6属于____ 分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________ (填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________ ;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________ 。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____ 。

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加 德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________ ;Fe2+与O2—的最短核间距为_____________ pm。
(1)钕(Nd)为60号元素,在周期表中位于第
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:

①分子中A1原子采取
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加 德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为
您最近一年使用:0次
解题方法
6 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。___________ ;核外未成对电子数是___________ 个。
(2)该超分子中存在的化学键类型有___________ 。
A σ键Bπ键C离子键D氢键
(3)该超分子中配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因___________ 。
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是___________ 。
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。___________ 。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是M g·mol-1,阿伏伽德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为___________ pm。

(2)该超分子中存在的化学键类型有
A σ键Bπ键C离子键D氢键
(3)该超分子中配体CO提供孤电子对的原子是
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。

您最近一年使用:0次
2019-04-23更新
|
5690次组卷
|
3卷引用:【省级联考】云南省2019届高三下学期第二次复习统一检测理科综合化学试题
名校
解题方法
7 . 含 卤 族 元 素 的 化 合 物 在 科 研 和 生 产 中 有 许 多 重 要 用 途 。 如 : 2 m o l S b ( C H 3 ) 3 、 2 m o lSb(CH3)2Br 和 2molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物:[Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知 Sb 与 N 同主族。请回答:
(1)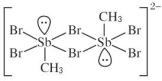 中,H、C、Br 的电负性由小到大的顺序为
中,H、C、Br 的电负性由小到大的顺序为_____ ,溴原子的价电子排布式 为_____ 。
(2)[Sb2(CH3)5] +的结构式为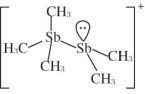 ,Sb 原子的杂化轨道类型为
,Sb 原子的杂化轨道类型为_____ 。写出一种与CH3-互为等电子体的分子_____ 。
(3)X 射线衍射测定等发现,I3AsF6中存在 I3+离子。I3+离子的几何构型为_____ 。
(4)一定条件下 SbCl3与 GaCl3以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为_____ (填“a”或“b”),理由是_____ 。
(5)固态 PCl5结构中存在 PCl4+和 PCl6 -两种离子,其晶胞如图所示。
已知晶胞的边长为 a pm ,阿伏伽德罗常数值用 NA表示。则 PCl4+和 PCl6-之间的最短距离为_____ pm,固态 PCl5的密度为_____ g•cm-3。
(1)
 中,H、C、Br 的电负性由小到大的顺序为
中,H、C、Br 的电负性由小到大的顺序为(2)[Sb2(CH3)5] +的结构式为
 ,Sb 原子的杂化轨道类型为
,Sb 原子的杂化轨道类型为(3)X 射线衍射测定等发现,I3AsF6中存在 I3+离子。I3+离子的几何构型为
(4)一定条件下 SbCl3与 GaCl3以物质的量之比为 l:l 混合得到一种固态离子化合物,其结构组成可能 为:(a) [GaCl2+ ][SbCl4- ]或(b) [SbCl2+ ][GaCl4- ],该离子化合物最可能的结构组成为
(5)固态 PCl5结构中存在 PCl4+和 PCl6 -两种离子,其晶胞如图所示。

已知晶胞的边长为 a pm ,阿伏伽德罗常数值用 NA表示。则 PCl4+和 PCl6-之间的最短距离为
您最近一年使用:0次
解题方法
8 . 【化学——选修3:物质结构与性质】
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中D原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是______ (填分子式),原因是________ ;B和D的氢化物所属的晶体类型分别为_______ 和_______ 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为_______ ,中心原子的杂化轨道类型为_______ ,中心原子的价层电子对数为_____________ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, 列式计算晶体F的密度(g.cm-3)______________________________ 。
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, 列式计算晶体F的密度(g.cm-3)

您最近一年使用:0次
名校
解题方法
9 . 铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg 或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2 的元素共有___ 种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______ 。
(2)已知:2UO2+5NH4HF2 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______ 种。
(3)已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______ 、_______ 。
②物质 中与CO
中与CO 的碳原子杂化类型相同和不同的碳原子的个数比为
的碳原子杂化类型相同和不同的碳原子的个数比为______ 。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4 个碳原子位于立方体的面心,4 个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C 原子的配位数为______ 。该晶体硬度超过金刚石的原因是_________ 。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为_______ (用含d、r1、r2、NA的代数式表示,不必化简)。
回答下列问题:
(1)UF4用Mg 或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2 的元素共有
(2)已知:2UO2+5NH4HF2
 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有
(3)已知:3(NH4)4[UO2(CO3)3]
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑①写出与NH4+互为等电子体的一种分子和一种离子的化学式
②物质
 中与CO
中与CO 的碳原子杂化类型相同和不同的碳原子的个数比为
的碳原子杂化类型相同和不同的碳原子的个数比为③分解所得的气态化合物的分子键角由小到大的顺序为
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4 个碳原子位于立方体的面心,4 个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C 原子的配位数为
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为
您最近一年使用:0次
2018-04-16更新
|
1703次组卷
|
3卷引用:河北省衡水中学2018届高三第十五次模拟理科综合化学试题
解题方法
10 . 铜铟镓硒薄膜太阳能电池(GIGS)是第三代太阳能电池的典型代表,已成为全球光伏领域研究的热点之一,回答下列问题:
(1)镓(Ga)价电子排布式为______ ,镓(Ga)与铟(In)同主族第一电离能较小的为______ (用元素符号表示)。
(2)硒属于_______ 区元素。O、S、Se简单氢化物稳定性由强到弱的顺序为______ ,中心原子的杂化方式为___________ ,键角最大的是_____________ 。
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是__________ (填化学式)。
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为__________ 。

图中A原子和B原子坐标(分别为(0,0,0),(0,0, ),则C原子坐标为
),则C原子坐标为_________ 。
(1)镓(Ga)价电子排布式为
(2)硒属于
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为

图中A原子和B原子坐标(分别为(0,0,0),(0,0,
 ),则C原子坐标为
),则C原子坐标为
您最近一年使用:0次
2018-02-23更新
|
688次组卷
|
2卷引用:河南省周口市2018届高三上学期期末抽测调研化学试题



