名校
解题方法
1 . NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 mol [Co(NH3)5Cl]Cl2含有的σ键数目是21NA |
| B.15 g甲基(—CH3)所含有的电子数是10NA |
| C.720 g C60晶体中含有NA个晶胞结构单元 |
| D.60 g SiO2晶体中含有2NA个Si—O键 |
您最近一年使用:0次
解题方法
2 . H、C、N、O是常见的元素,可形成很多种化合物。其中化合物丁二酮(a)与羟胺(b)在一定条件下可合成制备丁二酮肟(c),丁二酮肟可用于灵敏鉴定 ,生成鲜红色沉淀二丁二酮肟合镍(Ⅱ)螯合物(d)。
,生成鲜红色沉淀二丁二酮肟合镍(Ⅱ)螯合物(d)。

请回答:
(1)H、N、O、Ni元素位于p区的是___________ (填元素符号),H,N,O基态原子的第一电离能由大至小的顺序为___________ 。
(2)基态Ni原子的原子结构示意图___________ 。
(3)键角: 的
的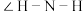
___________ (填“>”、“<”或“=”) 的
的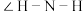 。
。
(4)丁二酮(a)的熔点远远低于丁二酮肟(c)的熔点,其可能原因是___________ 。
(5)二丁二酮肟合镍(Ⅱ)螯合物(d)中N原子的杂化类型是___________ ,该物质中存在的作用力有___________ (填标号)。
A.离子键 B.配位键 C.极性共价键 D.非极性共价键 E.氢键
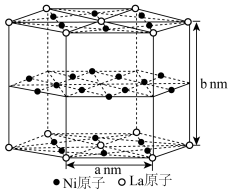
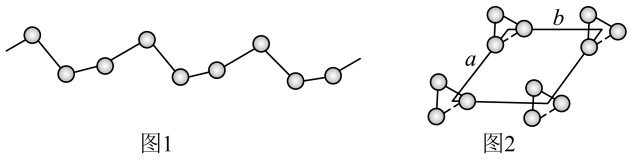
(6)金属镍(Ni)与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构为六方晶胞,晶格结构示意图如图。该合金的化学式为___________ ;若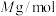 代表合金摩尔质量,
代表合金摩尔质量, 表示阿伏加德罗常数的值,则该合金的密度为
表示阿伏加德罗常数的值,则该合金的密度为___________  。
。
 ,生成鲜红色沉淀二丁二酮肟合镍(Ⅱ)螯合物(d)。
,生成鲜红色沉淀二丁二酮肟合镍(Ⅱ)螯合物(d)。
请回答:
(1)H、N、O、Ni元素位于p区的是
(2)基态Ni原子的原子结构示意图
(3)键角:
 的
的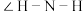
 的
的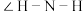 。
。(4)丁二酮(a)的熔点远远低于丁二酮肟(c)的熔点,其可能原因是
(5)二丁二酮肟合镍(Ⅱ)螯合物(d)中N原子的杂化类型是
A.离子键 B.配位键 C.极性共价键 D.非极性共价键 E.氢键
(6)金属镍(Ni)与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构为六方晶胞,晶格结构示意图如图。该合金的化学式为
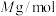 代表合金摩尔质量,
代表合金摩尔质量, 表示阿伏加德罗常数的值,则该合金的密度为
表示阿伏加德罗常数的值,则该合金的密度为 。
。
您最近一年使用:0次
2024-04-01更新
|
254次组卷
|
2卷引用:2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学
3 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: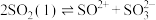 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中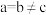 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则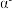 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
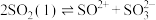 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是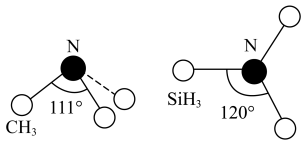
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中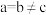 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
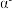 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
4 . 铁是日常生活中最常见的金属,铁制品的使用在人类历史发展中起到了重要作用。回答下列问题:
(1)磺基水杨酸离子与 可以生成系列配合物
可以生成系列配合物 。加入
。加入 调节溶液的
调节溶液的 ,生成
,生成 的红褐色配合物
的红褐色配合物 。
。

①硫元素位于元素周期表中___________ 区,基态硫原子电子排布式为___________ ,磺基水杨酸分子中所含元素电负性由大到小的顺序为___________ 。
②依据原子轨道重叠的方式,判断 中的
中的 键属于
键属于___________ 键,该键是氢原子的 轨道和氧原子的
轨道和氧原子的___________ 轨道重叠形成的, 的VSEPR构型为
的VSEPR构型为___________ 。
③羧酸根( )中羧基
)中羧基 和两个
和两个 之间形成大
之间形成大 键,负电荷是平均分布在这个离域体系上。配合物
键,负电荷是平均分布在这个离域体系上。配合物 中含有两个六元环,在形成配合物
中含有两个六元环,在形成配合物 时,能提供电子对形成配位键的原子是
时,能提供电子对形成配位键的原子是___________ (填标号)。
(2)下表是 逐级失去电子的电离能,
逐级失去电子的电离能, 明显大于
明显大于 ,从原子结构角度解释其原因为
,从原子结构角度解释其原因为___________ 。
(3)已知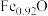 晶体的晶胞结构为
晶体的晶胞结构为 型(如图所示),晶胞边长为
型(如图所示),晶胞边长为 ,
, 表示阿伏加德罗常数的值。该晶体中铁离子占据空隙的几何形状(即与铁离子距离最近且等距离的
表示阿伏加德罗常数的值。该晶体中铁离子占据空隙的几何形状(即与铁离子距离最近且等距离的 围成的空间形状)是
围成的空间形状)是___________ ,晶体密度为___________  。
。

(1)磺基水杨酸离子与
 可以生成系列配合物
可以生成系列配合物 。加入
。加入 调节溶液的
调节溶液的 ,生成
,生成 的红褐色配合物
的红褐色配合物 。
。
①硫元素位于元素周期表中
②依据原子轨道重叠的方式,判断
 中的
中的 键属于
键属于 轨道和氧原子的
轨道和氧原子的 的VSEPR构型为
的VSEPR构型为③羧酸根(
 )中羧基
)中羧基 和两个
和两个 之间形成大
之间形成大 键,负电荷是平均分布在这个离域体系上。配合物
键,负电荷是平均分布在这个离域体系上。配合物 中含有两个六元环,在形成配合物
中含有两个六元环,在形成配合物 时,能提供电子对形成配位键的原子是
时,能提供电子对形成配位键的原子是(2)下表是
 逐级失去电子的电离能,
逐级失去电子的电离能, 明显大于
明显大于 ,从原子结构角度解释其原因为
,从原子结构角度解释其原因为电离能( ) ) |  |  |  |  |
 | 762.5 | 1561.9 | 2957 | 5290 |
(3)已知
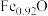 晶体的晶胞结构为
晶体的晶胞结构为 型(如图所示),晶胞边长为
型(如图所示),晶胞边长为 ,
, 表示阿伏加德罗常数的值。该晶体中铁离子占据空隙的几何形状(即与铁离子距离最近且等距离的
表示阿伏加德罗常数的值。该晶体中铁离子占据空隙的几何形状(即与铁离子距离最近且等距离的 围成的空间形状)是
围成的空间形状)是 。
。
您最近一年使用:0次
解题方法
5 . 有机阳离子是一类带正电荷的粒子,如 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。
(1)C原子价电子的轨道表示式为________ 。第一电离能N____ O(填“>”或“<”),原因是__________ 。
(2) 中N的杂化方式为
中N的杂化方式为____________________ 。从化学键的角度描述由 (甲胺)形成
(甲胺)形成 的过程
的过程____________________ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为__________ 。
(4)某材料中含有机阳离子,其晶胞结构如图所示。
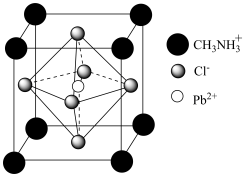
①化学式为____________________ ;其中 周围最临近的
周围最临近的 个数为
个数为__________ 。
②已知晶体密度为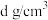 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为______  。
。
 (甲铵离子)、
(甲铵离子)、 (二甲基氧正离子)、
(二甲基氧正离子)、 (胍离子)等。
(胍离子)等。(1)C原子价电子的轨道表示式为
(2)
 中N的杂化方式为
中N的杂化方式为 (甲胺)形成
(甲胺)形成 的过程
的过程(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 )。
)。 为平面结构,则
为平面结构,则 中的大
中的大 键应表示为
键应表示为(4)某材料中含有机阳离子,其晶胞结构如图所示。

①化学式为
 周围最临近的
周围最临近的 个数为
个数为②已知晶体密度为
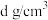 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,列式计算两个
,列式计算两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
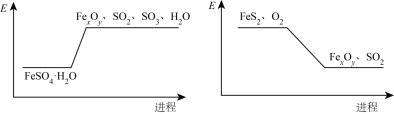
6 . FeSO4·7H2O失水后可转为FeSO4·H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。
I.FeSO4·H2O结构如图所示。
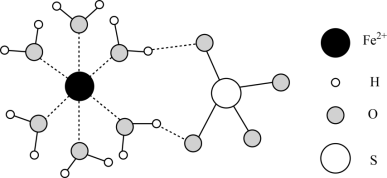
(1)Fe2+价层电子排布式为_______ 。
(2)比较键角大小:SO
_______ H2O分子(填“>”“<”或“=”),理由:_______ 。
(3)H2O与Fe2+、SO 和H2O的作用分别为
和H2O的作用分别为_______ 、_______ 。
(4)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______ 。
II.FeS2晶胞为立方体,边长为a nm,如图所示。

(5)①与Fe2+紧邻的阴离子个数为_______ 。
②晶胞的密度为_______ g/cm3。
(6)以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精(FexOy)和H2SO4.结合图示解释可充分实现能源和资源有效利用的原因为______ 。
I.FeSO4·H2O结构如图所示。

(1)Fe2+价层电子排布式为
(2)比较键角大小:SO

(3)H2O与Fe2+、SO
 和H2O的作用分别为
和H2O的作用分别为(4)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构
II.FeS2晶胞为立方体,边长为a nm,如图所示。

(5)①与Fe2+紧邻的阴离子个数为
②晶胞的密度为
(6)以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精(FexOy)和H2SO4.结合图示解释可充分实现能源和资源有效利用的原因为

您最近一年使用:0次
名校
7 . X、Y、Z、W为原子序数依次增大的短周期元素,基态Y原子的s能级电子数是p能级的2倍,基态W原子的电子总数是其最高能级电子数的2倍,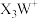 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体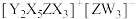 。下列说法正确的是
。下列说法正确的是
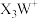 是10电子微粒,可形成离子液体
是10电子微粒,可形成离子液体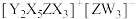 。下列说法正确的是
。下列说法正确的是| A.第一电离能:Y<W<Z | B. 与 与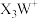 的空间结构相同 的空间结构相同 |
C.键能: | D. 中存在 中存在 键、氢键和配位键 键、氢键和配位键 |
您最近一年使用:0次
2024-03-21更新
|
959次组卷
|
3卷引用:四川省射洪中学校2023-2024学年高二下学期4月月考化学试题
四川省射洪中学校2023-2024学年高二下学期4月月考化学试题山东省淄博市2024届高三一模化学试题(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
解题方法
8 . 以砷化铝(AlAs)作催化剂,实现了在常压、100~300℃的条件下合成氨。
(1)基态As原子的核外价电子的轨道表示式为___________ ;第一电离能I1(As)___________ (填“大于”或“小于”) I1(Se),其原因是___________ 。
(2)As3S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键的数目为___________ ;该分子中S原子的杂化轨道类型为___________ 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是___________ 。
(4)近年来,人们发现NH3AlH3可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性的相互作用,其结构可表示为X—H…H—Y(“—”表示共价键,“…”表示形成的双氢键)。根据上述信息,NH3AlH3与HF形成的双氢键可表示为___________ 。
(5)Be和Al的性质相似,在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在,1 mol Be2Cl4中含有的共价键数目为___________ 。BeO晶体晶胞结构与ZnS类似,如图所示。该晶胞中原子的位置可以用原子分数坐标表示,若原子A、B的坐标分别为(0,0,0)、( ,
, ,
, );则C原子的坐标为
);则C原子的坐标为___________ 。设O与Be的最近距离为a pm,用NA表示阿伏加德罗常数的值,则BeO晶体的密度为___________ g/cm3(用含a和NA的计算式表示)。

(1)基态As原子的核外价电子的轨道表示式为
(2)As3S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键的数目为
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(4)近年来,人们发现NH3AlH3可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性的相互作用,其结构可表示为X—H…H—Y(“—”表示共价键,“…”表示形成的双氢键)。根据上述信息,NH3AlH3与HF形成的双氢键可表示为
(5)Be和Al的性质相似,在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在,1 mol Be2Cl4中含有的共价键数目为
 ,
, ,
, );则C原子的坐标为
);则C原子的坐标为
您最近一年使用:0次
名校
解题方法
9 . 2021年10月18日《自然·化学》发表我国科学家研究成果,发现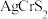 (
( 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)基态硫原子核外最多有___________ 个电子顺时针旋转,基态铬原子有___________ 种电子运动状态。
(2)氧族元素有氧、硫、硒、碲等元素,这四种元素中,第一电离能最小的是___________ (填元素符号);科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。 中硒的杂化轨道类型是
中硒的杂化轨道类型是___________ ,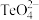 的空间结构模型为
的空间结构模型为___________ ;四种简单氢化物 、
、 、
、 、
、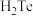 中,键角最大的为
中,键角最大的为___________ ,沸点最高的是___________ 。
(3)配合物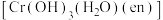 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为___________ (Cr与O、N均形成了配位键),1mol该配合物中含___________ 个 键。
键。
(4)复合材料氧铬酸钙的立方晶胞如图所示。已知A、B的原子坐标分别为 、
、 ,则C的原子坐标为
,则C的原子坐标为___________ ,已知钙和氧的最近距离为a pm,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。

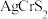 (
( 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:(1)基态硫原子核外最多有
(2)氧族元素有氧、硫、硒、碲等元素,这四种元素中,第一电离能最小的是
 中硒的杂化轨道类型是
中硒的杂化轨道类型是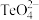 的空间结构模型为
的空间结构模型为 、
、 、
、 、
、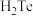 中,键角最大的为
中,键角最大的为(3)配合物
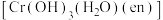 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为 键。
键。(4)复合材料氧铬酸钙的立方晶胞如图所示。已知A、B的原子坐标分别为
 、
、 ,则C的原子坐标为
,则C的原子坐标为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
10 . 全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子核外电子的空间运动状态有______ 种,若其电子排布式表示为 违背了
违背了______ 。
(2)高纯硅制备过程中会有 等中间产物生成。沸点:
等中间产物生成。沸点:
______  (填“>”或“<”)。
(填“>”或“<”)。
(3)复兴号高铁车体材质用到 等元素。
等元素。
① 的一种配合物化学式为
的一种配合物化学式为 ,下列说法正确的是
,下列说法正确的是______ (填字母标号)。
A. 与
与 原子配位时,提供孤电子对的是
原子配位时,提供孤电子对的是 原子
原子
B.Mn原子的配位数为6
C. 中
中 键与
键与 键数目之比为
键数目之比为
D. 中C原子的杂化类型为
中C原子的杂化类型为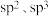
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测 比
比 的分解温度
的分解温度______ (填“高”或“低”),解释原因____________
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有 型结构(如图),晶胞参数(晶胞边长)为
型结构(如图),晶胞参数(晶胞边长)为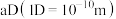 ,其中阴离子
,其中阴离子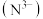 采用面心立方最密堆积方式,则
采用面心立方最密堆积方式,则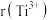 为
为______ D,该氮化钛的密度______  (列出计算式即可)。
(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子核外电子的空间运动状态有
 违背了
违背了(2)高纯硅制备过程中会有
 等中间产物生成。沸点:
等中间产物生成。沸点:
 (填“>”或“<”)。
(填“>”或“<”)。(3)复兴号高铁车体材质用到
 等元素。
等元素。①
 的一种配合物化学式为
的一种配合物化学式为 ,下列说法正确的是
,下列说法正确的是A.
 与
与 原子配位时,提供孤电子对的是
原子配位时,提供孤电子对的是 原子
原子B.Mn原子的配位数为6
C.
 中
中 键与
键与 键数目之比为
键数目之比为
D.
 中C原子的杂化类型为
中C原子的杂化类型为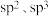
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测
 比
比 的分解温度
的分解温度(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有
 型结构(如图),晶胞参数(晶胞边长)为
型结构(如图),晶胞参数(晶胞边长)为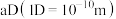 ,其中阴离子
,其中阴离子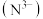 采用面心立方最密堆积方式,则
采用面心立方最密堆积方式,则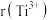 为
为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



