名校
解题方法
1 . 某化学小组为探究SO2的性质,按如图所示装置进行实验。请回答下列问题:
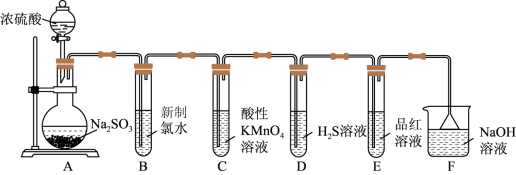
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_______ 、_______ 。
(2)反应后,装置B中产生的现象是_______ ,发生反应的离子方程式为_______ 。
(3)装置C中的现象是_______ ,表现了SO2的_______ ;装置D中的现象是_______ ,发生反应的化学方程式为_______ 。
(4)装置F的作用是_______ ,倒扣漏斗的作用是_______ 。
II.他们拟用下列方法测定空气中SO2含量(假设空气中无其他还原性气体)。
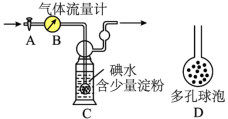
(5)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,原因是_______ 。
(6)实验过程中,若C中溶液蓝色消失后没有及时关闭活塞A,则测得的SO2含量会_______ (填“偏高”、“偏低”或“无影响”)。

(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是
(2)反应后,装置B中产生的现象是
(3)装置C中的现象是
(4)装置F的作用是
II.他们拟用下列方法测定空气中SO2含量(假设空气中无其他还原性气体)。

(5)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,原因是
(6)实验过程中,若C中溶液蓝色消失后没有及时关闭活塞A,则测得的SO2含量会
您最近一年使用:0次
2 . 化学小组同学为研究氯气制备和氯水的成分及性质进行了如下实验。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。
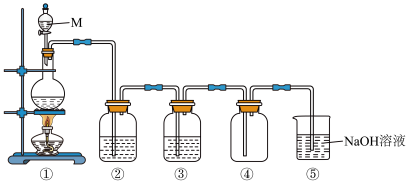
(1)M仪器的名称是___________ ,①中反应的反应的化学方程式是___________ 。
(2)③中存放的试剂是___________ 。
(3)⑤中反应的离子方程式是___________ 。
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇 变蓝色
变蓝色
(4)实验2-1可证明氧化性
___________  (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是___________ 。
(5)证明氯水中含有氯离子的方案是___________ 。
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
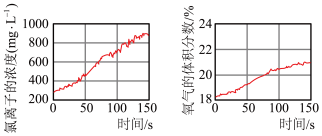
上两图中曲线变化的原因是___________ 。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。

(1)M仪器的名称是
(2)③中存放的试剂是
(3)⑤中反应的离子方程式是
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇
 变蓝色
变蓝色| 实验2-1 | 实验2-2 | |
| 实验操作(氯水均为新制) | 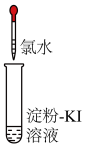 | 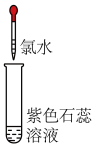 |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |

 (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是(5)证明氯水中含有氯离子的方案是
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。

上两图中曲线变化的原因是
您最近一年使用:0次
名校
解题方法
3 . 下图是一种检验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是
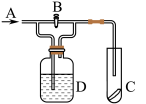

| A.浓H2SO4 | B.饱和Na2SO4 | C.浓NaOH溶液 | D.KI溶液 |
您最近一年使用:0次
2023-03-28更新
|
154次组卷
|
4卷引用:四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题
四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题四川省达州市万源中学2023-2024学年高一上学期12月月考化学试题(已下线)【2022】【高一上】【期中考】【杭十一中】【高中化学】【李雪收集】广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题
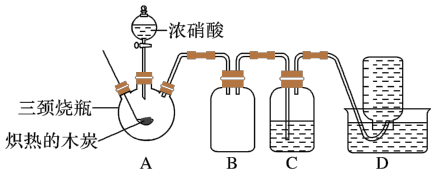
4 . 某化学学习小组借助如图装置对浓硝酸的性质进行探究。______ 后开始如下实验:将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈瓶中,并塞紧瓶塞滴加浓硝酸,可观察到瓶中产生红棕色的气体。
(2)装置C中盛有足量的Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为______ (写化学式)。
(3)装置D中收集到了无色气体,同学甲认为是NO,乙认为是O2,丙认为是NO和O2。
①甲、乙、丙三人的判断中肯定不合理的是_____ 。
②下列对该气体的检验方法合适的是_____ (填字母)。
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
③如果集气瓶中收集到的无色气体是氧气,则氧气的来源是(用化学方程式表示)____ 。
(4)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO 离子物质的量变化如图所示,请回答下列问题:
离子物质的量变化如图所示,请回答下列问题:____ mol/L。
②应再往此反应体系中滴加_____ mL2mol/L的硫酸才能使剩余的铜恰好完全溶解。(已知此过程中NO 的还原产物为NO)
的还原产物为NO)
(2)装置C中盛有足量的Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为
(3)装置D中收集到了无色气体,同学甲认为是NO,乙认为是O2,丙认为是NO和O2。
①甲、乙、丙三人的判断中肯定不合理的是
②下列对该气体的检验方法合适的是
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
③如果集气瓶中收集到的无色气体是氧气,则氧气的来源是(用化学方程式表示)
(4)将28.8g铜投入100mL浓硝酸中,最后铜有剩余,其NO
 离子物质的量变化如图所示,请回答下列问题:
离子物质的量变化如图所示,请回答下列问题: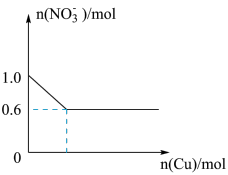
②应再往此反应体系中滴加
 的还原产物为NO)
的还原产物为NO)
您最近一年使用:0次
2023-03-27更新
|
263次组卷
|
2卷引用:四川省成都外国语学校2022-2023学年高一下学期3月月考化学试题
名校
解题方法
5 . 某化学兴趣小组在实验室中利用如图装置制备SO2并进行相关性质的探究。回答下列问题:
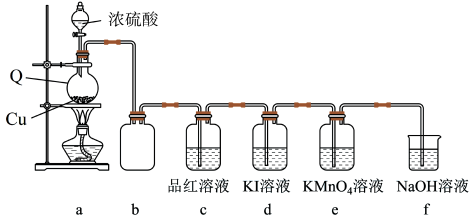
(1)仪器Q的名称为_____ ;装置c中品红溶液褪色,可证明SO2具有_____ 性。
(2)装置b的作用是_____ 。
(3)装置c中KMnO4溶液褪色,可证明SO2具有_____ 性。
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
①取适量装置d中浊液,向其中滴加几滴_____ 溶液(填试剂名称),振荡,无明显变化,浊液中无I2。
②将装置d中浊液进行分离,得淡黄色固体和澄清溶液:取适量分离后的澄清溶液于试管中,_____ ,出现白色沉淀,产物溶液中存在SO 。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为_____ 。

(1)仪器Q的名称为
(2)装置b的作用是
(3)装置c中KMnO4溶液褪色,可证明SO2具有
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO
 +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。①取适量装置d中浊液,向其中滴加几滴
②将装置d中浊液进行分离,得淡黄色固体和澄清溶液:取适量分离后的澄清溶液于试管中,
 。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
您最近一年使用:0次
2023-03-27更新
|
359次组卷
|
3卷引用:四川省成都外国语学校2022-2023学年高一下学期3月月考化学试题
6 . “绿色化学”走进课堂,某学习小组在老师的指导下,设计了“氯气与金属钠反应”的实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大小的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔化成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
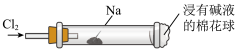

| A.浸有NaOH溶液的棉球主要用于防止空气中二氧化碳进来与钠反应 |
| B.反应生成的大量白烟是氯化钠晶体 |
| C.从实验现象上判断钠的熔点较低 |
| D.钠性质非常活泼,本质原因是钠原子的最外层只有1个电子,该电子很容易失去 |
您最近一年使用:0次
2023-03-22更新
|
191次组卷
|
2卷引用:四川省遂宁中学校2023-2024学年高一上学期期中(半期)考试化学试题
解题方法
7 . 碳酸氢钠是一种应用广泛的盐,化学小组对其进行了探究。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和___________ (填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的离子方程式为___________ 。
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。
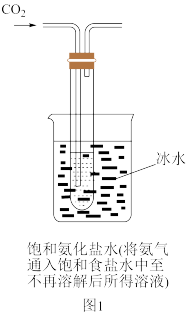
反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是___________ 。
(3)能进一步确认该白色固体是NaHCO3的实验方案是___________ (须用到的仪器和药品:试管、温度计、水)。
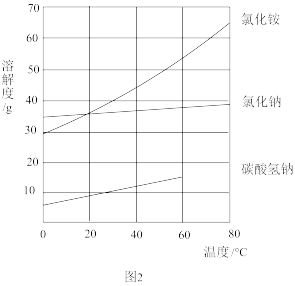
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是___________ 。
【性质探究】
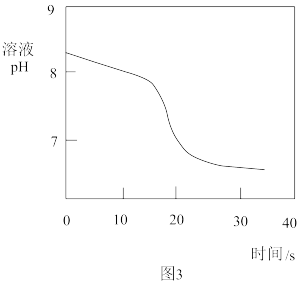
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO3溶于水后,少量的 能同时发生如下变化:
能同时发生如下变化:
变化①: +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;
变化②:

 +H+。
+H+。
材料四:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显___________ (填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因:___________ 。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3
 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。

反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是
(3)能进一步确认该白色固体是NaHCO3的实验方案是
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是

【性质探究】
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。

【查阅资料】
材料三NaHCO3溶于水后,少量的
 能同时发生如下变化:
能同时发生如下变化:变化①:
 +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;变化②:


 +H+。
+H+。材料四:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显
您最近一年使用:0次
8 . 某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:
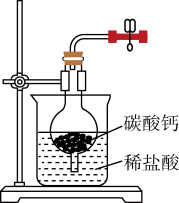
(1)选用如图所示装置及药品制取CO2.打开弹簧夹,制取CO2.为了得到干燥、纯净的CO2,产生的气流应依次通过盛有___________ 、___________ 的洗气瓶(填试剂名称)。不能用稀硫酸代替稀盐酸,其原因是___________ 。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红;向第二支试管中滴加澄清石灰水,溶液变浑浊。据此推断,白色物质的主要成分是___________ (填标号)。
A.Na2OB.Na2O2C.NaOHD.Na2CO3
②经检验黑色固体是单质碳,则本实验中金属钠与二氧化碳反应的化学方程式为___________ 。
(1)选用如图所示装置及药品制取CO2.打开弹簧夹,制取CO2.为了得到干燥、纯净的CO2,产生的气流应依次通过盛有

(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
| 步骤 | 现象 |
| 将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
| 在集气瓶中加入适量蒸馏水,振荡、过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
A.Na2OB.Na2O2C.NaOHD.Na2CO3
②经检验黑色固体是单质碳,则本实验中金属钠与二氧化碳反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 某兴趣小组为了探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是
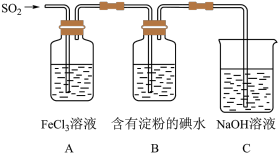
| A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 |
| B.装置C的作用是吸收SO2尾气,防止污染空气 |
| C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫色褪去 |
| D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
您最近一年使用:0次
2023-02-21更新
|
923次组卷
|
55卷引用:四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题
四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题(已下线)2014年高考化学鲁科版3.3硫的转化练习卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2015-2016学年吉林省松原市油田高中高二下期末化学试卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届黑龙江省牡丹江高级中学高三10月月考化学卷2017届河北省衡水中学高三上期中化学卷2017届山东省莱芜一中高三上学期10月月考化学试卷2017届河南省南阳一中高三上第三次周考化学卷福建省泰宁第一中学2018届高三上学期第一阶段考试化学试题宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【押题专练】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期中考试化学试题山东省东营市第二中学2019届高三上学期模块考试(期中)化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题云南省西畴县二中2019-2020学年高二上学期开学考试化学试题安徽省滁州市定远县重点中学2018-2019学年高一上学期期末考试化学试题苏教版高中化学必修1专题4《硫 氮可持续发展》测试卷云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高一上学期期末考试化学试题河南省商丘市第一高级中学2020届高三上学期期中考试化学试题河南省开封市第二十五中2019-2020高一下学期初分科考试化学试卷(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题(已下线)4.2.1 含硫物质之间的转化(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)河南省林州市第一中学2021-2022学年高一下学期开学检测化学试题课后-5.1.3 不同价态含硫物质的转化-人教2019必修第二册广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期期中考试化学试题上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题湖北省公安县第三中学2021-2022学年高三上学期8月质量检测化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省阜阳市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省安庆市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题广东省广州市培英中学2022-2023学年高一下学期期中考试化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一下学期开学考试化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题
解题方法
10 . 利用“价—类”二维图研究物质的性质是一种有效的学习方法。铁及其部分化合物的“价—类”二维图如图所示。

(1)X、Y的化学式分别为_______ 、_______ 。
(2)图中只具有还原性的物质是_______ (填化学式)。
(3)某实验小组从亚铁盐的物质类别角度,预测其可能与某些金属、酸、碱、盐发生反应;从亚铁盐中铁元素的化合价,预测亚铁盐既具有氧化性,又具有还原性。请根据实验室提供的试剂完成下列实验。
实验室提供的试剂:锌片、铜片、 溶液、KSCN溶液、新制氯水、酸性高锰酸钾溶液、NaOH溶液。
溶液、KSCN溶液、新制氯水、酸性高锰酸钾溶液、NaOH溶液。
①探究亚铁盐与碱的反应;
向 溶液中滴加NaOH溶液,发现先生成白色沉淀,一段时间后沉淀基本变为红褐色,写出白色沉淀转化为红褐色沉淀的化学方程式:
溶液中滴加NaOH溶液,发现先生成白色沉淀,一段时间后沉淀基本变为红褐色,写出白色沉淀转化为红褐色沉淀的化学方程式:_______ 。
②探究 的氧化性:
的氧化性:
分别将铜片、锌片投入 溶液中,结果铜片没变化,锌片逐渐溶解。由此说明三种金属的还原性由强到弱的顺序为:
溶液中,结果铜片没变化,锌片逐渐溶解。由此说明三种金属的还原性由强到弱的顺序为:_______ 。
③探究 的还原性:
的还原性:
向 溶液滴加酸性高锰酸钾溶液,发生反应的离子方程式为:
溶液滴加酸性高锰酸钾溶液,发生反应的离子方程式为:_______ 。
(4)若要验证溶液中不含 而只含有
而只含有 ,正确的实验操作方法及现象是:
,正确的实验操作方法及现象是:_______ 。

(1)X、Y的化学式分别为
(2)图中只具有还原性的物质是
(3)某实验小组从亚铁盐的物质类别角度,预测其可能与某些金属、酸、碱、盐发生反应;从亚铁盐中铁元素的化合价,预测亚铁盐既具有氧化性,又具有还原性。请根据实验室提供的试剂完成下列实验。
实验室提供的试剂:锌片、铜片、
 溶液、KSCN溶液、新制氯水、酸性高锰酸钾溶液、NaOH溶液。
溶液、KSCN溶液、新制氯水、酸性高锰酸钾溶液、NaOH溶液。①探究亚铁盐与碱的反应;
向
 溶液中滴加NaOH溶液,发现先生成白色沉淀,一段时间后沉淀基本变为红褐色,写出白色沉淀转化为红褐色沉淀的化学方程式:
溶液中滴加NaOH溶液,发现先生成白色沉淀,一段时间后沉淀基本变为红褐色,写出白色沉淀转化为红褐色沉淀的化学方程式:②探究
 的氧化性:
的氧化性:分别将铜片、锌片投入
 溶液中,结果铜片没变化,锌片逐渐溶解。由此说明三种金属的还原性由强到弱的顺序为:
溶液中,结果铜片没变化,锌片逐渐溶解。由此说明三种金属的还原性由强到弱的顺序为:③探究
 的还原性:
的还原性:向
 溶液滴加酸性高锰酸钾溶液,发生反应的离子方程式为:
溶液滴加酸性高锰酸钾溶液,发生反应的离子方程式为:(4)若要验证溶液中不含
 而只含有
而只含有 ,正确的实验操作方法及现象是:
,正确的实验操作方法及现象是:
您最近一年使用:0次



