辽宁省协作校2019-2020学年高一下学期期中考试化学试题
辽宁
高一
期中
2020-07-15
519次
整体难度:
容易
考查范围:
常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础
辽宁省协作校2019-2020学年高一下学期期中考试化学试题
辽宁
高一
期中
2020-07-15
519次
整体难度:
容易
考查范围:
常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 下列有关物质用途的叙述错误的是
| A.SO2可用于杀菌消毒,是一种食品添加剂 |
| B.液氨常用作制冷剂,是因为氨气液化时要吸收大量的热 |
| C.硅单质具有良好的半导体性能,可制成计算机的芯片 |
| D.硫酸铵、碳酸氢铵等铵盐是农业上常用的化肥 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 下列关于物质工业制法的叙述错误的是
| A.陶瓷、玻璃、水泥的生产中均用到了石灰石 |
| B.工业制备高纯硅涉及的主要反应中,所有的反应均为氧化还原反应 |
| C.工业制硫酸过程中,常用98.3%的浓硫酸吸收SO3 |
| D.氨催化氧化是工业制硝酸的基础 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
3. 下列叙述中正确的个数为
①通过豆科植物的根瘤菌将氮气转化为含氮化合物,是自然固氮的途径之一
②硝酸见光分解,所以硝酸一般盛放在棕色试剂瓶中
③CO、NO、NO2都是大气污染气体,在空气中能稳定存在
④常温下,可以用铁制容器盛装浓硝酸,这是因为铁在常温下与浓硝酸不反应
⑤浓硫酸与蔗糖反应时,蔗糖变黑,同时膨胀,体现浓硫酸的吸水性和强氧化性
⑥可以用CS2清洗残留硫粉的试管
①通过豆科植物的根瘤菌将氮气转化为含氮化合物,是自然固氮的途径之一
②硝酸见光分解,所以硝酸一般盛放在棕色试剂瓶中
③CO、NO、NO2都是大气污染气体,在空气中能稳定存在
④常温下,可以用铁制容器盛装浓硝酸,这是因为铁在常温下与浓硝酸不反应
⑤浓硫酸与蔗糖反应时,蔗糖变黑,同时膨胀,体现浓硫酸的吸水性和强氧化性
⑥可以用CS2清洗残留硫粉的试管
| A.4个 | B.3个 | C.2个 | D.1个 |
您最近一年使用:0次
2020-07-13更新
|
237次组卷
|
3卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
4. 下列各物质中,物质之间通过一步反应就能实现如图转化关系的是选项abc转化关系
| 选项 | a | b | c | 转化关系 |
| A | Fe | Fe2S3 | FeCl3 | 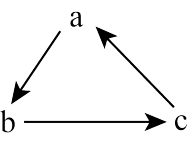 |
| B | N2 | NO2 | HNO3 | |
| C | Si | SiO2 | H2SiO3 | |
| D | S | SO2 | H2SO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 设NA为阿伏加 德罗常数的值,下列叙述中正确的是
| A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA |
| B.2 mol Na2S分子中含有S原子的数目为2NA |
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和 数目之和为0.3NA 数目之和为0.3NA |
| D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
6. 下列离子方程式正确的是
| A.NaOH溶液需要用胶塞试剂瓶盛装:SiO2+2Na++2OH-=Na2SiO3+H2O |
| B.铝与浓硫酸反应:2Al+6H+=2Al3++3H2↑ |
C.检验 涉及的反应: 涉及的反应: +OH- +OH- NH3·H2O NH3·H2O |
D.硫代硫酸钠与稀硫酸反应: +2H+=S↓+SO2↑+H2O +2H+=S↓+SO2↑+H2O |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
您最近一年使用:0次
单选题
|
适中(0.65)
7. 下列叙述正确的是
| A.浓硫酸稀释、酸碱中和反应,均为放热反应 |
| B.SiO2既能与NaOH溶液反应,又能与HF溶液反应,所以SiO2是两性氧化物 |
C.向某溶液中先加足量稀盐酸无明显现象,再加BaCl2溶液,若产生白色沉淀,则该溶液中一定含有 |
| D.某红棕色气体能使湿润的淀粉碘化钾试纸变蓝,说明该气体一定是NO2 |
您最近一年使用:0次
2020-07-13更新
|
247次组卷
|
3卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
单选题
|
较易(0.85)
8. 根据所给的实验装置,下列有关实验的相关叙述正确的是
| 选项 | 实验装置 | 相关叙述 |
| A |  | 实验室可以用该装置和药品制取氨气 |
| B | 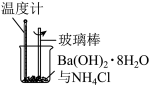 | 反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应 |
| C | 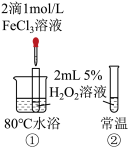 | ①中反应比②中快,说明温度升高可以加快反应速率 |
| D | 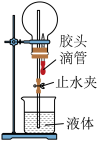 | 只有氨气等极易溶于水的气体才能利用该装置形成喷泉 |
| A.A | B.B | C.C | D.D |
【知识点】 氨气的实验室制法解读 吸热反应和放热反应解读 影响化学反应速率的因素
您最近一年使用:0次
单选题
|
适中(0.65)
9. 下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
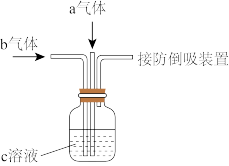

| 选项 | a气体 | b气体 | c溶液 | 实验现象 |
| A | Cl2(1mol) | SO2(1mol) | 品红溶液 | 溶液颜色变浅或褪色 |
| B | H2S | SO2 | 水 | 产生淡黄色沉淀 |
| C | SO2 | NO2 | BaCl2溶液 | 产生白色沉淀 |
| D | NO | O2 | 滴加少量酚酞的NaOH溶液 | 溶液颜色变浅或褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
10. 某温度下,在2L容器中发生反应,A、B、C物质的量随时间变化的曲线如图所示。下列叙述中正确的是


A.该反应的化学方程式为2A B+3C B+3C |
| B.反应开始至2s时,A的平均反应速率为0.4 mol(/L·s) |
| C.t1时刻,该反应达到化学平衡状态 |
| D.反应开始至1s时,生成C的物质的量大于0.2 mol |
您最近一年使用:0次
2020-07-13更新
|
218次组卷
|
2卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
单选题
|
较易(0.85)
解题方法
11. 对于反应C(s)+H2O(g) CO(g)+H2(g),当其他条件不变时,下列措施中,可以增大化学反应速率的是
CO(g)+H2(g),当其他条件不变时,下列措施中,可以增大化学反应速率的是
 CO(g)+H2(g),当其他条件不变时,下列措施中,可以增大化学反应速率的是
CO(g)+H2(g),当其他条件不变时,下列措施中,可以增大化学反应速率的是| A.增加C的质量 | B.恒压条件下充入氦气 | C.降低温度 | D.压缩容器体积 |
您最近一年使用:0次
单选题
|
较易(0.85)
12. 一定条件下,体积固定的密闭容器中,发生反应H2(g)+I2(g) 2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
 2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
2HI(g)。下列情况可以说明该反应一定达到化学平衡的是| A.断裂1 mol H-H键,同时生成2 mol H-I键 | B.容器内压强保持不变 |
| C.容器内气体颜色保持不变 | D.容器内H2、I2和HI的物质的量之比为1:1:2 |
【知识点】 化学平衡状态本质及特征解读 化学平衡状态的判断方法解读
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
13. 下图为H2(g)和O2(g)生成H2O(g)过程中的能量变化。下列叙述中正确的是
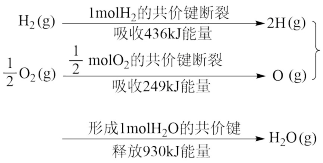

| A.该反应中反应物所具有的总能量低于生成物所具有的总能量 |
| B.2 mol O(g)原子结合成O2(g)时,吸收498kJ能量 |
| C.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(g)时,放热245kJ |
| D.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)时,释放的热量小于245kJ |
您最近一年使用:0次
单选题
|
较易(0.85)
14. 下列说法中正确的是
| A.化学反应中能量变化的大小与反应物的质量多少无关 |
| B.锌锰干电池中,锌筒作正极 |
| C.蓄电池充电时发生氧化还原反应 |
| D.合成氨的生产在温度较低时,氨的产率较高,所以合成氨工业中应尽可能选择低温进行反应 |
您最近一年使用:0次
单选题
|
较易(0.85)
15. 下列有关图像的结论正确的是
| 图像 | 结论 | |
| A | 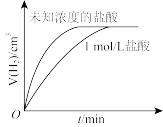 | 相同质量锌粉分别与1 mol/L盐酸及相同体积未知浓度的盐酸反应,未知浓度盐酸的浓度低于1 mol/L |
| B | 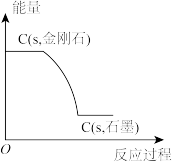 | 一定条件下,金刚石转化为石墨要释放能量,金刚石要比石墨稳定 |
| C | 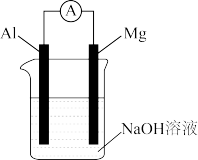 | 该装置为化学能转化为电能的装置,且Mg作负极 |
| D |  | 一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化曲线如图,反应开始时刻生成物的浓度不为0 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-13更新
|
217次组卷
|
2卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
16. 电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,交换膜分别是只允许阴阳离子通过的阴阳离子交换膜)。下列叙述中错误的是
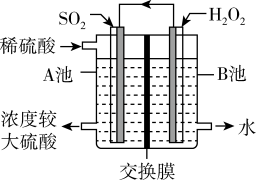

| A.该交换膜为阳离子交换膜 |
| B.若11.2 L(标准状况)SO2参与反应,则A池中增加2 mol H+ |
| C.B池中的反应为H2O2+2e-+2H+=2H2O |
| D.导线上箭头方向表示电流方向 |
【知识点】 原电池原理 原电池原理的综合应用解读 原电池有关计算解读
您最近一年使用:0次
单选题
|
较难(0.4)
解题方法
17. 一个容积固定的5 L反应器中,有一可左右滑动的密封隔板,左侧进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
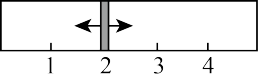
 2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
| A.若左侧开始反应时v正>v逆,则5>x>1.75 |
| B.若左侧开始反应时x=1.75,则起始时v正=v逆 |
| C.若左侧开始反应时x=2,则达到平衡时混合气体中SO2所占的体积分数为25% |
| D.若左侧开始反应时x=1.65,则达到平衡时SO3的转化率为10% |
【知识点】 化学平衡的有关计算
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
18. 15.3 g Mg-Al合金(无其他成分),加入到500 mL稀硝酸中,恰好完全反应后,共收集到标准状况下的NO气体11.2 L,向所得溶液中加入4 mol/L NaOH溶液400 mL,得到白色沉淀。下列叙述中正确的是
| A.合金中,m(Mg):m(Al)=1:1 |
| B.原稀硝酸的物质的量浓度与NaOH溶液相同 |
| C.白色沉淀的成分为Mg(OH)2 |
| D.过滤后,向白色沉淀中加入原稀硝酸250 mL,可将沉淀全部溶解 |
您最近一年使用:0次
2020-07-13更新
|
209次组卷
|
2卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
19. 为落实“五水共治”,某工厂拟综合处理含 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
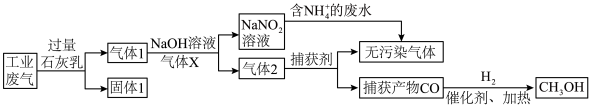
已知:1 mol CO和1 mol CH3OH分别完全燃烧生成CO2(g)和H2O(l),放出的热量为283.0kJ和726.5kJ。下列说法错误的是
 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
已知:1 mol CO和1 mol CH3OH分别完全燃烧生成CO2(g)和H2O(l),放出的热量为283.0kJ和726.5kJ。下列说法错误的是
| A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3 |
| B.气体X在流程中体现还原性 |
| C.相同质量的CO和CH3OH完全燃烧,后者放出的热量多 |
D.处理含 废水时,发生反应的离子方程式为: 废水时,发生反应的离子方程式为: + + =N2↑+2H2O =N2↑+2H2O |
您最近一年使用:0次
2020-07-13更新
|
1333次组卷
|
4卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
辽宁省协作校2019-2020学年高一下学期期中考试化学试题(已下线)第八单元 化学反应与能量测试题-2021年高考化学一轮复习名师精讲练河北正定中学2020-2021学年高三第二次半月考化学试题新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高二上学期开学考试化学试题
单选题
|
适中(0.65)
解题方法
20. 某无色溶液中可能含有H+、 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、 、
、 、
、 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
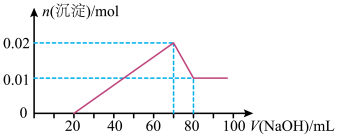
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、 、
、 、
、 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。

③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、 、 、 |
| B.该溶液中c(K+)一定为2 mol/L |
| C.试管2中滴加的NaOH溶液浓度一定为1 mol/L |
| D.试管3中溶解的铜粉质量一定为0.72 g |
您最近一年使用:0次
二、填空题 添加题型下试题
填空题
|
较易(0.85)
21. 在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2 +5
+5 +2H+=I2+5
+2H+=I2+5 +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
(1)V1=______ mL,V2=______ mL。
(2)如果研究浓度对反应速率的影响,使用实验__________ 和实验__________ 。
(3)对比实验1和实验2,可以研究__________ 对化学反应速率的影响。
(4)溶液出现蓝色所需的时间从多到少的顺序是__________ (用a、b、c表示)。
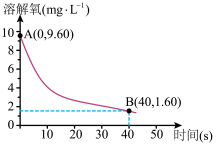
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO3的平均反应速率为____________ 。
 +5
+5 +2H+=I2+5
+2H+=I2+5 +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):| 0.01mol/LKIO3溶液的体积 | 某浓度的Na2SO3溶液的体积 | H2O的体积 | 实验温度/℃ | 溶液出现蓝色所需时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 20 | 25 | b |
| 实验3 | 5 | V2 | 15 | 25 | c |
(1)V1=
(2)如果研究浓度对反应速率的影响,使用实验
(3)对比实验1和实验2,可以研究
(4)溶液出现蓝色所需的时间从多到少的顺序是
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO3的平均反应速率为

您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
解题方法
22. 某化学小组为研究SO2的化学性质并探究与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持,加热装置已略,气密性已检验)
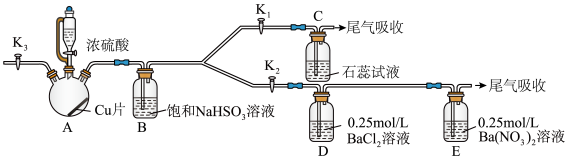
实验操作和现象如下:
(1)关闭活塞K2,K3,打开活塞K1,向A中滴加一定量的浓硫酸并加热,A中有白雾生成,铜片表面产生气泡。
(2)当C出现明显现象后,关闭K1,并停止加热。
①写出A中发生反应的化学反应方程式______ ;
②B装置的作用是_____ ;
③C中的现象为__ ;
(3)打开活塞K2,再向A中滴加一定量的浓硫酸并加热,D中有气泡冒出,产生少量白色沉淀,E中产生白色沉淀,液面上方略显浅棕色并逐渐消失;
(4)从D、E中分别取少量白色沉淀,加稀盐酸,白色沉淀不溶解。
①分析D中产生不溶于稀盐酸的沉淀的原因____ ;
②为了证实上述分析是否正确,在原实验基础上,在打开活塞K2之后增加一步操作,该操作是___ ;
(5)增加以上操作后,重复实验步骤(3),D中无沉淀生成,而E中仍产生白色沉淀,用离子方程式解释E中仍有白色沉淀的原因__ 。

实验操作和现象如下:
(1)关闭活塞K2,K3,打开活塞K1,向A中滴加一定量的浓硫酸并加热,A中有白雾生成,铜片表面产生气泡。
(2)当C出现明显现象后,关闭K1,并停止加热。
①写出A中发生反应的化学反应方程式
②B装置的作用是
③C中的现象为
(3)打开活塞K2,再向A中滴加一定量的浓硫酸并加热,D中有气泡冒出,产生少量白色沉淀,E中产生白色沉淀,液面上方略显浅棕色并逐渐消失;
(4)从D、E中分别取少量白色沉淀,加稀盐酸,白色沉淀不溶解。
①分析D中产生不溶于稀盐酸的沉淀的原因
②为了证实上述分析是否正确,在原实验基础上,在打开活塞K2之后增加一步操作,该操作是
(5)增加以上操作后,重复实验步骤(3),D中无沉淀生成,而E中仍产生白色沉淀,用离子方程式解释E中仍有白色沉淀的原因
您最近一年使用:0次
2020-07-13更新
|
485次组卷
|
2卷引用:辽宁省协作校2019-2020学年高一下学期期中考试化学试题
四、填空题 添加题型下试题
填空题
|
较难(0.4)
解题方法
23. 如图所示是工业生产硝酸铵的流程。
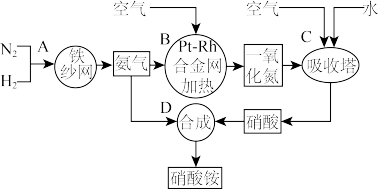
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:_____ 。
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为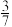 ,此时H2的转化率为
,此时H2的转化率为_____ 。
(3)设备B中反应的化学方程式为____ 。
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取_____ 吨硝酸铵。
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:
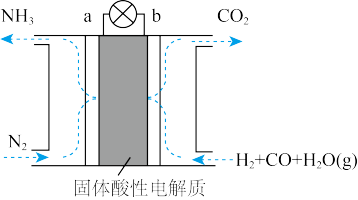
该装置的负极为_____ (填a或b),试写出a极的电极反应式_______ 。

(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式:
(2)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为
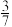 ,此时H2的转化率为
,此时H2的转化率为(3)设备B中反应的化学方程式为
(4)利用以上流程,若N2与H2合成氨时,H2的转化率如上题所求,氨气催化氧化制硝酸时损失20%,其他环节损失忽略不计,则9吨H2最多可制取
(5)某课外小组运用原电池原理合成氨,其装置结构如图所示:

该装置的负极为
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
24. 为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______ ;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池 装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。

步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________ (答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______ ;
(4)加入FeCl2和碘固体后,正极的电极反应式为______ ;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________ ;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______ ,修正实验方案后得到结论:该反应有一定的限度。
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图

步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因
(4)加入FeCl2和碘固体后,正极的电极反应式为
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、认识化学科学、化学反应原理、化学实验基础
试卷题型(共 24题)
题型
数量
单选题
20
填空题
2
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 铵盐 氨的物理性质 二氧化硫 硅的物理性质与用途 | |
| 2 | 0.65 | 氨的还原性 硅的制备 硅酸盐工业 | |
| 3 | 0.85 | 一氧化氮的化学性质 硝酸的不稳定性 硝酸的强氧化性 浓硫酸的强氧化性 | |
| 4 | 0.65 | 氮气组成、结构与性质 硫与氧气反应 二氧化硅的化学性质 铁与非金属单质反应 | |
| 5 | 0.65 | 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 6 | 0.85 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 7 | 0.65 | 二氧化氮 硫酸根离子的检验 二氧化硅的化学性质 吸热反应和放热反应 | |
| 8 | 0.85 | 氨气的实验室制法 吸热反应和放热反应 影响化学反应速率的因素 | |
| 9 | 0.65 | 氯水的性质 一氧化氮的化学性质 二氧化硫与其他强氧化剂的反应 | |
| 10 | 0.85 | 化学反应速率计算 化学平衡建立的过程 化学平衡题中基于图表数据的相关计算 化学反应速率与化学平衡的综合应用 | |
| 11 | 0.85 | 压强对化学反应速率的影响 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 | |
| 12 | 0.85 | 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 13 | 0.85 | 化学反应热的计算 能量的相互转化 化学键与化学反应中的能量关系 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 14 | 0.85 | 化学反应中能量变化的原因 温度对化学反应速率的影响 温度对化学平衡移动的影响 二次电池 | |
| 15 | 0.85 | 化学能与物质稳定性之间的关系 化学反应速率的图像 化学平衡建立的过程 电极材料的特殊性质对原电池正负极判断的影响 | |
| 16 | 0.65 | 原电池原理 原电池原理的综合应用 原电池有关计算 | |
| 17 | 0.4 | 化学平衡的有关计算 | |
| 18 | 0.65 | 化学方程式计算中物质的量的运用 硝酸的强氧化性 含镁化合物 氢氧化铝 | |
| 19 | 0.65 | 一氧化氮的化学性质 二氧化氮与碱液的反应 二氧化硫的化学性质 化学反应原理综合考查 | |
| 20 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 氢氧化铝与强碱反应 离子的检验 | |
| 二、填空题 | |||
| 21 | 0.85 | 影响化学反应速率的因素 浓度对化学反应速率的影响 温度对化学反应速率的影响 | |
| 23 | 0.4 | 化学方程式计算中物质的量的运用 氨的还原性 转化率的相关计算及判断 原电池电极反应式书写 | |
| 三、解答题 | |||
| 22 | 0.4 | 硝酸的强氧化性 二氧化硫的化学性质 二氧化硫的制备 | 实验探究题 |
| 24 | 0.65 | 化学反应条件控制的相关实验 根据相关反应设计原电池 物质性质的探究 | 实验探究题 |



