四川省仁寿第二中学2019-2020学年高二7月月考理综化学试题
四川
高二
阶段练习
2020-07-16
198次
整体难度:
容易
考查范围:
化学反应原理、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、物质结构与性质
四川省仁寿第二中学2019-2020学年高二7月月考理综化学试题
四川
高二
阶段练习
2020-07-16
198次
整体难度:
容易
考查范围:
化学反应原理、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 化学在生活中有着广泛的应用,下列说法错误的是( )
| A.Al2(SO4)3 和小苏打溶液反应可用于泡沫灭火器灭火 |
| B.利用HF与SiO2反应,用氢氟酸在玻璃器皿上刻蚀标记 |
| C.化石燃料完全燃烧不会造成大气污染 |
| D.用浸泡过高锰酸钾溶液的硅藻土保存水果以达到保鲜的效果 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
2. 下列关于有机物的说法正确的是( )
| A.苯和聚乙烯均能发生加成反应 |
| B.分子式为C5H10O2的有机物不一定能与NaHCO3溶液反应放出气体 |
| C.两种不同的烷烃一定互为同系物 |
| D.乙烷光照条件下能与溴水发生取代反应 |
【知识点】 有机官能团的性质及结构 烷烃结构与性质的关系解读 苯的加成反应解读
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
3. 下列实验操作能达到实验目的是( )
实验目的 | 实验操作 | |
A. | 除去CO2中混有的HCl | 将气体通过装有饱和碳酸钠溶液的洗气瓶 |
B. | 由MgCl2溶液制备无水Mg Cl2 | 将MgCl2溶液加热蒸干 |
C. | 证明Cu(OH)2的溶度积 比 Mg(OH)2的小 | 将0.lmol•L﹣1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.lmol•L﹣1CuSO4溶液 |
D. | 苯萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
4. 甲基环己烷的结构如图所示: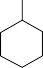 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A.甲基环己烷的分子式为C7H16 | B.甲基环己烷的一氯代物有4种 |
| C.甲基环己烷中碳原子可能都处于同一平面 | D.甲基环己烷与2﹣乙基一1一戊烯互为同分异构体 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
5. 铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO
 2PbSO4+2H2O,下列说法错误的是( )
2PbSO4+2H2O,下列说法错误的是( )

 2PbSO4+2H2O,下列说法错误的是( )
2PbSO4+2H2O,下列说法错误的是( )A.充电时,阴极反应式为:SO +4H++PbO2+2e﹣═PbSO4+2H2O +4H++PbO2+2e﹣═PbSO4+2H2O |
| B.充电时,两个电极的质量均减轻 |
| C.电池放电时,电解质溶液的pH增大 |
| D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑ |
【知识点】 原电池电极反应式书写解读 二次电池 铅蓄电池解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
6. 短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层有6个电子,B是迄今发现的非金属性最强的元素,在周期表中C位于IA族,D的氧化物为两性氧化物,E与A属于同一主族.下列说法正确的是( )
| A.元素C、E的原子半径和简单离子半径均为:C>E |
| B.由C、E两种元素组成的化合物C2E2既含有离子键也含有共价键 |
| C.最高价氧化物对应的水化物的碱性:D>C |
| D.常温下,由D单质制成的容器可盛装E的最高价氧化物的水化物的稀溶液 |
您最近一年使用:0次
2020-07-15更新
|
117次组卷
|
2卷引用:四川省仁寿第二中学2019-2020学年高二7月月考理综化学试题
单选题
|
适中(0.65)
解题方法
7. 某酸H2A为二元弱酸.20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100mol•L﹣1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
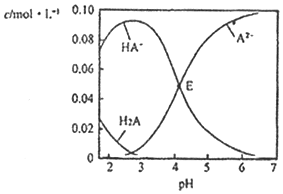

| A.pH=2.5的溶液中:c(H2A)+c(A2﹣)>c(HA﹣) |
| B.c(Na+)=0.100moL•L﹣1的溶液中:c(H+)+c(H2A)=c(OH﹣)+c(A2﹣) |
| C.c(HA﹣)=c(A2﹣)的溶液中:c(Na+)>0.100mol•L﹣1+c(HA﹣) |
| D.pH=7.0的溶液中:c(Na+)<2c(A2﹣) |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
解题方法
8. 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,回答下列问题:
(1)通入O2的Pt电极为电池的_____ (填“正极”或“负极”),电极反应式为_____ 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_____ (填“镀件”或“银”)。
(3)若B电池的电解质溶液为500mL1.0mol•L﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因_____ 。当电池工作一段时间后断开K,Y极共收集到560mL气体(标准状况),此时B池中溶液的pH=_____ (假设溶液体积不变),转移电子的数目为_____ 。

(1)通入O2的Pt电极为电池的
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为
(3)若B电池的电解质溶液为500mL1.0mol•L﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因

您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
容易(0.94)
解题方法
9. 用零价铁(Fe)去除酸性水体中的硝酸盐(NO )已成为环境修复研究的热点之一.Fe还原水体中NO
)已成为环境修复研究的热点之一.Fe还原水体中NO 的反应原理如图所示.
的反应原理如图所示.
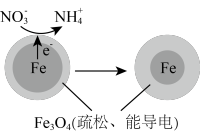
(1)作负极的物质是_____ 。 (2)正极的电极反应式是________________ 。
 )已成为环境修复研究的热点之一.Fe还原水体中NO
)已成为环境修复研究的热点之一.Fe还原水体中NO 的反应原理如图所示.
的反应原理如图所示.
(1)作负极的物质是
【知识点】 原电池正负极判断解读 原电池电极反应式书写解读
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-实验探究题
|
容易(0.94)
解题方法
10. 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a制备,b会发生较多的副反应.回答下列问题:
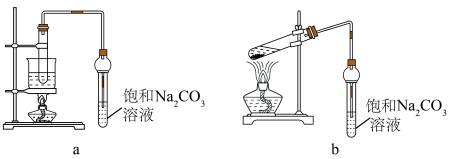
(1)实验时,通常加入过量的乙醇,原因是_____ 。
(2)饱和Na2CO3溶液的作用是_____ 。
(3)反应结束后,将盛有饱和Na2CO3溶液的试管中收集到的产品倒入分液漏斗中,_____ 、_____ ,然后分液。

(1)实验时,通常加入过量的乙醇,原因是
(2)饱和Na2CO3溶液的作用是
(3)反应结束后,将盛有饱和Na2CO3溶液的试管中收集到的产品倒入分液漏斗中,
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
11. 磷酸铁(FePO4•2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是_____ .
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是_____ (填字母编号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO4•2H2O.若反应得到的FePO4•2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为_____ .
(4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、_____ 和_____ .
②若滴定x mL含Fe2+的滤液消耗a mol•L﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=_____ mol•L﹣1.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO4•2H2O.若反应得到的FePO4•2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为
(4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO
 +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、
②若滴定x mL含Fe2+的滤液消耗a mol•L﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
较易(0.85)
解题方法
12. 无水氯化铝在生产、生活中应用广泛。已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为__________ 。
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1kJ ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2kJ ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
您最近一年使用:0次
填空题
|
适中(0.65)
解题方法
13. (1)碳酸:H2CO3,K1=4.3×10﹣7,K2=5.6×10﹣11
草酸:H2C2O4,K1=5.9×10﹣2,K2=6.4×10﹣5
0.1mol/L Na2CO3溶液的pH_____ 0.1mol/L Na2C2O4溶液的pH;(选填“大于”“小于”或“等于”)
(2)等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是_____ ;若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____ (选填编号);
a.c(H+)>c(HC2O )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)
b.c(HCO )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
c.c(H+)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
d.c(H2CO3)>c(HCO )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)
草酸:H2C2O4,K1=5.9×10﹣2,K2=6.4×10﹣5
0.1mol/L Na2CO3溶液的pH
(2)等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是
a.c(H+)>c(HC2O
 )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)b.c(HCO
 )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)c.c(H+)>c(HC2O
 )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
) d.c(H2CO3)>c(HCO
 )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)
【知识点】 弱电解质的电离平衡 盐溶液中离子浓度大小的比较解读
您最近一年使用:0次
六、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
解题方法
14. 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g).
CH3OH(g).

图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO(g)和CH3OH(g)的浓度随时间变化图。
回答下列问题:
(1)在“图2”中,曲线_____ (填“a”成“b”)表示使用了催化剂,该反应属于________________ (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是_____ .
A.起始充入的CO为l mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入l mol CO和2mol H2,再次达到平衡时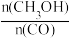 会增大
会增大
(3)从反应开始到建立平衡,V(H2)=_____ ,该温度下CO(g)+2H2(g) CH3OH(g) 的化学平衡常数为
CH3OH(g) 的化学平衡常数为_____ .若保持其他条件不变,向平衡体系中再充入0.5mol CO、l mol H2、1.5mol CH3OH,平衡_____ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)
 CH3OH(g).
CH3OH(g).
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO(g)和CH3OH(g)的浓度随时间变化图。
回答下列问题:
(1)在“图2”中,曲线
(2)根据“图2”判断,下列说法不正确的是
A.起始充入的CO为l mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入l mol CO和2mol H2,再次达到平衡时
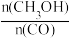 会增大
会增大(3)从反应开始到建立平衡,V(H2)=
 CH3OH(g) 的化学平衡常数为
CH3OH(g) 的化学平衡常数为
您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
解题方法
15. 已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是原子半径最小的主族元素,B是空气中含量最多的元素:C元素2p能级有两个未成对电子且没有空轨道;D是29号元素;E元素的价电子排布式为ns2np2.回答下列问题:
(1)基态D原子的外围电子排布式为_____ ,B、C两种元素的第一电离能最大的是___________ (用元素符号表示)。
(2)BC 微粒的空间构型为
微粒的空间构型为_____ ,1个[D(A2C)4]2+中含有的σ键数目为_____ 个。
(3)A、D两种元素分别与C元素形成的简单化合物,熔点较高的是_____ ,原因是_____ 。
(4)BA3在一定条件下容易得到一个A+,形成BA .下列对上述过程的描述不合理的是
.下列对上述过程的描述不合理的是_____ 。
A.B原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角减小
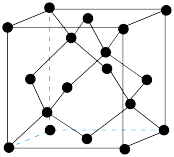
(5)E单质的晶体具有金刚石结构,其中微粒之间存在的作用力是,如图为E单质晶体的晶胞,已知晶胞的密度为dg/cm3,则晶胞的边长为_____ pm(列出计算式即可)。
(1)基态D原子的外围电子排布式为
(2)BC
 微粒的空间构型为
微粒的空间构型为(3)A、D两种元素分别与C元素形成的简单化合物,熔点较高的是
(4)BA3在一定条件下容易得到一个A+,形成BA
 .下列对上述过程的描述不合理的是
.下列对上述过程的描述不合理的是A.B原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角减小
(5)E单质的晶体具有金刚石结构,其中微粒之间存在的作用力是,如图为E单质晶体的晶胞,已知晶胞的密度为dg/cm3,则晶胞的边长为

您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
16. 用石油化工产品1,3-丁二烯合成化工中间产品D (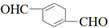 )的合成路线如下:
)的合成路线如下:
已知:
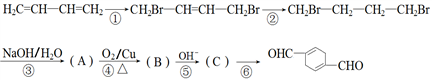
(1)物质D中所含官能团名称为_________ ,一定条件下,1 molD最多与_________ molH2发生加成反应。
(2)写出②⑥的反应类型分别是_________ 、_________ 。
(3)④反应的化学方程式_________ 。⑤反应的化学方程式_________ 。
(4)A 的系统命名是_________ 。
(5)写出与物质D互为同分异构体且满足以下条件的有机物结构简式_________ 。
① 能与FeCl3溶液发生显色反应
② 能发生银镜反应
③ 核磁共振氢谱显示有5组峰
(6)请设计合理方案用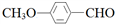 合成
合成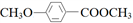 。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
 )的合成路线如下:
)的合成路线如下:已知:
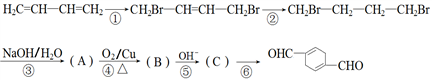
(1)物质D中所含官能团名称为
(2)写出②⑥的反应类型分别是
(3)④反应的化学方程式
(4)A 的系统命名是
(5)写出与物质D互为同分异构体且满足以下条件的有机物结构简式
① 能与FeCl3溶液发生显色反应
② 能发生银镜反应
③ 核磁共振氢谱显示有5组峰
(6)请设计合理方案用
 合成
合成 。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
您最近一年使用:0次
2017-05-01更新
|
223次组卷
|
2卷引用:四川省遂宁市2017届高三三诊考试理综化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、化学与STSE、常见无机物及其应用、化学实验基础、物质结构与性质
试卷题型(共 16题)
题型
数量
单选题
7
解答题
6
填空题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 盐类水解在生活、生产中的应用 乙烯 大气污染来源及危害 玻璃 | |
| 2 | 0.85 | 有机官能团的性质及结构 烷烃结构与性质的关系 苯的加成反应 | |
| 3 | 0.85 | 制备与水解有关的物质 沉淀转化 物质的分离、提纯 化学实验方案的设计与评价 | |
| 4 | 0.85 | 简单有机物同分异构体书写及辨识 同分异构体的数目的确定 有机分子中原子共面的判断 | |
| 5 | 0.85 | 原电池电极反应式书写 二次电池 铅蓄电池 | |
| 6 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 7 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 氢氧燃料电池 氯碱工业 电镀 电解池有关计算 | 原理综合题 |
| 10 | 0.94 | 乙酸乙酯制备实验 乙酸乙酯制备实验的装置及操作 乙酸乙酯制备实验的综合考查 | 实验探究题 |
| 11 | 0.65 | 常见无机物的制备 物质制备的探究 | 实验探究题 |
| 14 | 0.65 | 化学反应速率计算 化学平衡的移动及其影响因素 化学平衡图像分析 化学平衡常数的有关计算 | 原理综合题 |
| 15 | 0.4 | 物质结构与性质综合考查 电离能变化规律 杂化轨道理论 晶胞的有关计算 | 结构与性质 |
| 16 | 0.4 | 根据要求书写同分异构体 羧酸酯化反应 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |
| 三、填空题 | |||
| 9 | 0.94 | 原电池正负极判断 原电池电极反应式书写 | |
| 12 | 0.85 | 化学反应热的计算 盖斯定律及其有关计算 盖斯定律与热化学方程式 盖斯定律的应用 | |
| 13 | 0.65 | 弱电解质的电离平衡 盐溶液中离子浓度大小的比较 | |



