J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为_____ ;元素T在周期表中位于第_____ 族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______ 。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____ 。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______ 。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______ (选填序号)。
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________ 。

(1)M的离子结构示意图为
(2)J和氢组成的化合物分子有6个原子,其结构简式为
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
更新时间:2016-12-09 00:34:58
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。其制备方法有:
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式___________________________________________ 。
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式_____________________________________ 。
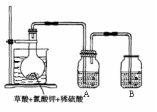
(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:__________________________________ ,
氧化产物与还原产物的物质的量之比为____________ 。
②控制水浴温度在60~80℃之间的目的是_______________________ ,
图示装置中缺少的一种必须的玻璃仪器是____________ 。
③A装置用于吸收产生的二氧化氯,其中最好盛放________ 。(填序号)①60 ℃的温水 ②冰水 ③饱和食盐水
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式_______________________ 。
(1)方法一:用氯酸钠(NaClO3)和硫酸酸化的H2O2反应生成ClO2。请写出该反应的化学方程式
(2)方法二:用氯酸钠氧化浓盐酸,生成二氧化氯的同时会有氯气产生。请写出该反应的化学方程式

(3)方法三、
①如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),
然后再加入足量的稀硫酸,水浴加热。反应后产物中有
ClO2、CO2和一种酸式盐,该反应的化学方程式为:
氧化产物与还原产物的物质的量之比为
②控制水浴温度在60~80℃之间的目的是
图示装置中缺少的一种必须的玻璃仪器是
③A装置用于吸收产生的二氧化氯,其中最好盛放
④将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】检验甲醛含量的方法有很多,其中银-Ferrozine法灵敏度较高。测定原理为甲醛与银氨溶液反应生成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如图装置,测定新装修居室内空气中甲醛的含量(夹持装置略去)。根据国家GB/T18883-2002《室内空气质量标准》,室内甲醛的达标标准为:在密闭门窗时间不少于12小时以后,测得甲醛含量不超过0.1mg/m³。
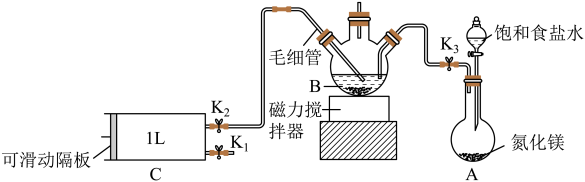
已知:①B装置中间导管所连接的尾气处理装置在图中已省略;
②毛细管内径不超过1mm。
回答下列问题:
(1)下列哪些制备气体的装置与A装置不同
________ 。
a.Cu和浓硫酸制SO2 b.CaCO3和稀盐酸制CO2 c.实验室制乙炔
用饱和食盐水代替水制备NH3的原因是________ 。
(2)银氨溶液的制备。
关闭K1、K2,打开K3。先打开________ ,再打开分液漏斗的下方活塞,使饱和食盐水慢慢滴入圆底烧瓶中,将产生的气体通入已加入适量硝酸银溶液的B中,当观察到B中________ ,关闭K3和分液漏斗旋塞,停止通入NH3。
(3)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气(在密闭门窗时间超过12小时以后),关闭K1;打开K2,向右缓慢推动滑动隔板,将气体全部排出,再关闭K2;重复上述操作4次。上述过程,空气中甲醛与B中银氨溶液反应的化学方程式为________ 。对比普通玻璃导管,使用毛细管的优点是________ 。
②待装置B中溶液充分反应后,向其中加入适量稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成1.12mg Fe2+,则该室内空气中甲醛的含量为_________ mg•L-1。

已知:①B装置中间导管所连接的尾气处理装置在图中已省略;
②毛细管内径不超过1mm。
回答下列问题:
(1)下列哪些制备气体的装置与A装置不同
a.Cu和浓硫酸制SO2 b.CaCO3和稀盐酸制CO2 c.实验室制乙炔
用饱和食盐水代替水制备NH3的原因是
(2)银氨溶液的制备。
关闭K1、K2,打开K3。先打开
(3)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气(在密闭门窗时间超过12小时以后),关闭K1;打开K2,向右缓慢推动滑动隔板,将气体全部排出,再关闭K2;重复上述操作4次。上述过程,空气中甲醛与B中银氨溶液反应的化学方程式为
②待装置B中溶液充分反应后,向其中加入适量稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成1.12mg Fe2+,则该室内空气中甲醛的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示。单位为mg·L-1。我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1.某化学小组同学设计了下列装置(夹持装置略) ,测定某河水的DO。
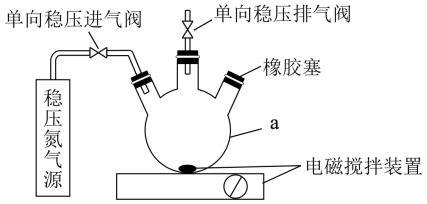
I.测定原理:
①在碱性条件下,O2将Mn2+氧化为MnO(OH)2;
②在酸性条件下,MnO(OH)2将I-氧化为I2,反应为MnO(OH)2+2I-+4H+=Mn2++I2 + 3H2O
③用Na2S2O3标准溶液滴定生成的I2,反应为2 +I2=
+I2= +2I-。
+2I-。
II.测定步骤:
i.安装好装置,检验装置的气密性,充入氮气一段时间后,停止充氮气;
ii.向仪器a中加入200 mL水样;
iii.用注射器向仪器a中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量) ,开启搅拌器,进行①中反应至完全;
iv.搅拌并用注射器向仪器a中加入2 mLH2SO4无氧溶液,至②中反应完全,溶液为中性或弱酸性;
v.用注射器从仪器a中取出40 mL溶液,用淀粉作指示剂,用0.01 mol·L-1 Na2S2O3溶液进行滴定,记录数据;
vi.重复步骤V的操作2~3次;
vii.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)写出①中反应的离子方程式:___________
(3)步骤i中起始充入氮气的目的是___________ 。
(4)步骤v中达到滴定终点的标志为___________ 。
(5)若某次滴定消耗Na2S2O3标准溶液3. 5 mL,则水样的DO=___________ mg·L-1.若为饮用水,则此次测得的DO___________ (填“已”或“未”)达标,判断的理由是___________ (写出具体的计算过程)。

I.测定原理:
①在碱性条件下,O2将Mn2+氧化为MnO(OH)2;
②在酸性条件下,MnO(OH)2将I-氧化为I2,反应为MnO(OH)2+2I-+4H+=Mn2++I2 + 3H2O
③用Na2S2O3标准溶液滴定生成的I2,反应为2
 +I2=
+I2= +2I-。
+2I-。 II.测定步骤:
i.安装好装置,检验装置的气密性,充入氮气一段时间后,停止充氮气;
ii.向仪器a中加入200 mL水样;
iii.用注射器向仪器a中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量) ,开启搅拌器,进行①中反应至完全;
iv.搅拌并用注射器向仪器a中加入2 mLH2SO4无氧溶液,至②中反应完全,溶液为中性或弱酸性;
v.用注射器从仪器a中取出40 mL溶液,用淀粉作指示剂,用0.01 mol·L-1 Na2S2O3溶液进行滴定,记录数据;
vi.重复步骤V的操作2~3次;
vii.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器a的名称为
(2)写出①中反应的离子方程式:
(3)步骤i中起始充入氮气的目的是
(4)步骤v中达到滴定终点的标志为
(5)若某次滴定消耗Na2S2O3标准溶液3. 5 mL,则水样的DO=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ•mol-1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH 2=94kJ•mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH 3=-484kJ•mol-1
计算H2S热分解反应④2H2S(g)=S2(g)+2H2(g)的ΔH 4=______ kJ•mol-1。
(2)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为______ ,用各物质的平衡分压表示总反应的平衡常数,表达式Kp=______ ,平衡常数Kp=______ kPa。已知:气体分压(p分)=气体总压(p总)×物质的量分数
(3)在1373K、100kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示:
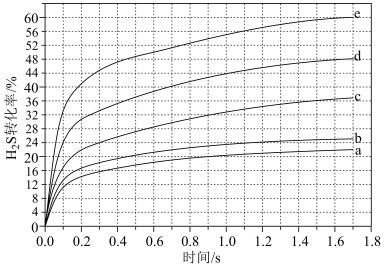
①n(H2S):n(Ar)为4:1和1:1相比,H2S平衡转化率高的是______ ,理由是______ 。
②n(H2S):n(Ar)=1:9对应图中曲线_____ 。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ•mol-1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH 2=94kJ•mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH 3=-484kJ•mol-1
计算H2S热分解反应④2H2S(g)=S2(g)+2H2(g)的ΔH 4=
(2)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为
(3)在1373K、100kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示:

①n(H2S):n(Ar)为4:1和1:1相比,H2S平衡转化率高的是
②n(H2S):n(Ar)=1:9对应图中曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮氧化物是形成酸雨、水体富营养化、光化学烟雾等环境问题的主要原因。
已知:反应Ⅰ.2NO(g)+O2(g) 2NO2(g) ΔH1=-112 kJ/mol;
2NO2(g) ΔH1=-112 kJ/mol;
反应Ⅱ.2NO2(g) N2O4(g) ΔH2=-24.2 kJ/mol;
N2O4(g) ΔH2=-24.2 kJ/mol;
反应Ⅲ.3O2(g) 2O3(g) ΔH3=+144.6 kJ/mol;
2O3(g) ΔH3=+144.6 kJ/mol;
(1)大气层中O3氧化NO的热化学方程式为3NO(g)+O3(g) 3NO2(g) ΔH4=
3NO2(g) ΔH4=________ 。
(2)某温度下,向1L刚性容器中投入1mol O2发生反应Ⅲ,5min时压强变为原来的0.9倍后不再变化。
①5min内O3的生成速率v(O3)=______________________ 。
②平衡时O2的转化率α(O2)________ 30%(填“>”“=”或“<”)。
(3)常温下,向压强为pkPa的恒压容器中充入2molNO和1molO2,发生反应Ⅰ和反应Ⅱ。平衡时NO和NO2的物质的量分别为0.2mol和1mol,则常温下反应Ⅱ的平衡常数Kp=____________ kPa-1(已知气体中某成分的分压p(分)=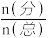 ×p(总),用含p的式子表示)。
×p(总),用含p的式子表示)。
(4)工业上常用氨气去除一氧化氮的污染,反应原理为:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+
5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+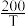 (T为开氏温度)。
(T为开氏温度)。
①该反应ΔH_______________ 0(填“>”“=”或“<”)。
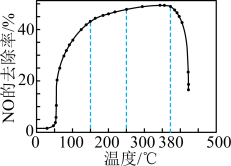
②一定温度下,按进料比n(NH3)∶n(NO)=1∶1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是______________________ ;当反应温度高于380 ℃时,NO的去除率迅速下降的原因可能是____________________ 。
已知:反应Ⅰ.2NO(g)+O2(g)
 2NO2(g) ΔH1=-112 kJ/mol;
2NO2(g) ΔH1=-112 kJ/mol;反应Ⅱ.2NO2(g)
 N2O4(g) ΔH2=-24.2 kJ/mol;
N2O4(g) ΔH2=-24.2 kJ/mol;反应Ⅲ.3O2(g)
 2O3(g) ΔH3=+144.6 kJ/mol;
2O3(g) ΔH3=+144.6 kJ/mol;(1)大气层中O3氧化NO的热化学方程式为3NO(g)+O3(g)
 3NO2(g) ΔH4=
3NO2(g) ΔH4=(2)某温度下,向1L刚性容器中投入1mol O2发生反应Ⅲ,5min时压强变为原来的0.9倍后不再变化。
①5min内O3的生成速率v(O3)=
②平衡时O2的转化率α(O2)
(3)常温下,向压强为pkPa的恒压容器中充入2molNO和1molO2,发生反应Ⅰ和反应Ⅱ。平衡时NO和NO2的物质的量分别为0.2mol和1mol,则常温下反应Ⅱ的平衡常数Kp=
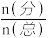 ×p(总),用含p的式子表示)。
×p(总),用含p的式子表示)。(4)工业上常用氨气去除一氧化氮的污染,反应原理为:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+
5N2(g)+6H2O(g)。测得该反应的平衡常数与温度的关系为:lg Kp=5.0+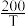 (T为开氏温度)。
(T为开氏温度)。①该反应ΔH

②一定温度下,按进料比n(NH3)∶n(NO)=1∶1,匀速通入装有锰、镁氧化物作催化剂的反应器中反应。反应相同时间,NO的去除率随反应温度的变化曲线如上图。NO的去除率先迅速上升后上升缓慢的主要原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】可逆反应A+B  2C在一定条件下达成平衡。
2C在一定条件下达成平衡。
(1)升高温度,正反应速度_______ ;逆反应速度_______ ;测得体系中C的浓度增大,说明平衡向_______ 方向移动,正反应是_______ (吸热、放热)反应。
(2)在平衡体系中加入催化剂,正反应速度_______ ,逆反应速度_______ ,平衡_______ 移动。
(3)增加压强,气体A的平衡浓度增大,则C为_______ 态(气、固、液),B为_______ 态。
 2C在一定条件下达成平衡。
2C在一定条件下达成平衡。(1)升高温度,正反应速度
(2)在平衡体系中加入催化剂,正反应速度
(3)增加压强,气体A的平衡浓度增大,则C为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】水资源的处理和利用是环境化学的重要课题。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是___________ (用离子方程式说明)。几种均为0.1mol L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 ___________ (填罗马数字),判断的理由是 ___________ 。
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为___________ 。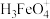 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=___________ 。
(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
Ⅰ.NH4Al(SO4)2常作食品加工中的食品添加剂,也可用作净水剂。请回答下列问题:
(1)NH4Al(SO4)2作净水剂的原理是
 L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol
L-1的电解质溶液的pH随温度变化的曲线如图1所示。其中符合0.1mol L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是
L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是 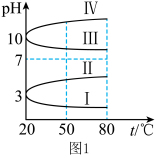
(2)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图2所示:pH=2.4时,溶液中主要含铁形体浓度的大小关系为

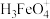 电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中
电离常数分别为:K1=2.51×10﹣2,K2=4.16×10﹣4,K3=5.01×10﹣8,当pH=4时,溶液中 =
=(4)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图3所示是高铁电池的模拟实验装置。
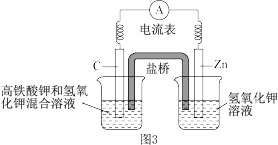

②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图4为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】锑(Sb)常用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如图:
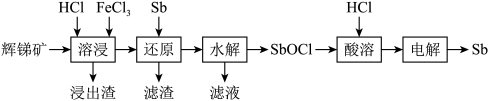
已知:溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为____ 。
(2)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为____ 。
②下列能促进该水解反应的措施有____ (填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于____ mol•L-1。
(3)“滤液”中含有的金属阳离子有____ 。向“滤液”中通入足量____ (填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。
(4)Sb可由SbCl 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为____ 。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时(c=0.01mol•L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
| 完全沉淀时(c=1.0×10-5mol•L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为
(2)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为
②下列能促进该水解反应的措施有
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于
(3)“滤液”中含有的金属阳离子有
(4)Sb可由SbCl
 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】I、
(1)在298K,100kPa时,已知:C(s,石墨)的燃烧热为393.5kJ·mol-1,H2(g)的燃烧热为285.8kJ·mol-1,C2H2(g)的燃烧热为1299.5kJ·mol-1.则2C(s,石墨)+H2(g) C2H2(g)ΔH=
C2H2(g)ΔH=______ kJ·mol-1.
(2)在2L的恒温容器中加入240g石墨和足量氢气发生反应:2C(s,石墨)+H2(g) C2H2(g)。若5min达到平衡时石墨的质量为90g,则v(H2)=
C2H2(g)。若5min达到平衡时石墨的质量为90g,则v(H2)=______ mol·L-1·min-1。
Ⅱ、在密闭容器中加入1molX和3molY发生反应:X(g)+3Y(g) 4Z(g) ΔH<0,回答下列问题:
4Z(g) ΔH<0,回答下列问题:
(3)若该反应在恒温恒容 条件下进行:
①初始时充入惰性气体,化学反应速率会______ (填“增大”“减小”或“不变”)。
②平衡时产生1.2mol物质Z,则X的转化率α(X)=______ 。
(4)若该反应在绝热恒容 条件下进行:
①相同时间内生成Z的量比恒温恒容时多,原因是______ 。
②当气体压强不再变化时,该反应______ (填“是”或“否”)达到平衡状态。
Ⅲ、CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
(5)① 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式______
②已知:25℃时,Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,当Na2CO3溶液的pH为11时,溶液中的c( ):c(
):c( )=
)=______
(1)在298K,100kPa时,已知:C(s,石墨)的燃烧热为393.5kJ·mol-1,H2(g)的燃烧热为285.8kJ·mol-1,C2H2(g)的燃烧热为1299.5kJ·mol-1.则2C(s,石墨)+H2(g)
 C2H2(g)ΔH=
C2H2(g)ΔH=(2)在2L的恒温容器中加入240g石墨和足量氢气发生反应:2C(s,石墨)+H2(g)
 C2H2(g)。若5min达到平衡时石墨的质量为90g,则v(H2)=
C2H2(g)。若5min达到平衡时石墨的质量为90g,则v(H2)=Ⅱ、在密闭容器中加入1molX和3molY发生反应:X(g)+3Y(g)
 4Z(g) ΔH<0,回答下列问题:
4Z(g) ΔH<0,回答下列问题:(3)若该反应在
①初始时充入惰性气体,化学反应速率会
②平衡时产生1.2mol物质Z,则X的转化率α(X)=
(4)若该反应在
①相同时间内生成Z的量比恒温恒容时多,原因是
②当气体压强不再变化时,该反应
Ⅲ、CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
(5)①
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式②已知:25℃时,Ka1(H2CO3)=4.5×10-7,Ka2(H2CO3)=4.7×10-11,当Na2CO3溶液的pH为11时,溶液中的c(
 ):c(
):c( )=
)=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】已知1到18号元素中的X、Y、Z、W、R五种元素,元素X的一种核素不含中子,Y的最外层电子数是次外层电子数的两倍,Z的最外层电子数比Y多2,W的原子失去1个电子后与 具有相同的电子层结构,R的原子序数为17。回答下列问题:
具有相同的电子层结构,R的原子序数为17。回答下列问题:
(1)元素Y的元素符号__________ ;Z的离子结构示意图__________ 。
(2)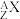 是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为
是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为__________ (任写一种,X用元素符号表示)。
(3)化合物 与
与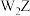 反应的化学方程式
反应的化学方程式____________________ 。
(4)图1为教材中模拟工业制备 的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)
的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)____________________ ,在两电极区分别滴入2滴酚酞溶液,观察到溶液变红现象的是__________ 极区(选填“a”、“b”)。
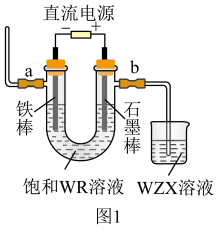
(5)多种含R元素的化合物因为具有强氧化性,常用于杀菌、消毒、漂白。
① 时,将气体
时,将气体 溶于水形成“
溶于水形成“ (气体)—
(气体)— (水溶液)”体系,体系中
(水溶液)”体系,体系中 (溶液)、
(溶液)、 和
和 三者的物质的量分数(
三者的物质的量分数( )随
)随 变化的关系如图2所示。已知
变化的关系如图2所示。已知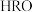 的杀菌能力比
的杀菌能力比 强,用
强,用 处理饮用水时,杀菌效果最强的
处理饮用水时,杀菌效果最强的 范围为
范围为__________ (填字母)。
A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10
②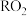 的杀菌效果比
的杀菌效果比 好。常用的制备
好。常用的制备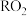 的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目:
的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目: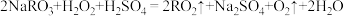
______ ;等物质的量的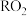 杀菌效果是
杀菌效果是 的
的__________ 倍(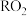 与
与 消毒杀菌后均被还原为
消毒杀菌后均被还原为 ,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
 具有相同的电子层结构,R的原子序数为17。回答下列问题:
具有相同的电子层结构,R的原子序数为17。回答下列问题:(1)元素Y的元素符号
(2)
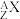 是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为
是一种化学用语,用来表示核素。元素X的某核素与不含中子的核素互称同位素,则这种核素可表示为(3)化合物
 与
与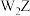 反应的化学方程式
反应的化学方程式(4)图1为教材中模拟工业制备
 的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)
的装置,通电后,U型管内发生的反应的化学方程式为(R用相应元素符号表示)
(5)多种含R元素的化合物因为具有强氧化性,常用于杀菌、消毒、漂白。
①
 时,将气体
时,将气体 溶于水形成“
溶于水形成“ (气体)—
(气体)— (水溶液)”体系,体系中
(水溶液)”体系,体系中 (溶液)、
(溶液)、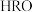 和
和 三者的物质的量分数(
三者的物质的量分数( )随
)随 变化的关系如图2所示。已知
变化的关系如图2所示。已知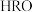 的杀菌能力比
的杀菌能力比 强,用
强,用 处理饮用水时,杀菌效果最强的
处理饮用水时,杀菌效果最强的 范围为
范围为A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10

②
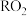 的杀菌效果比
的杀菌效果比 好。常用的制备
好。常用的制备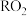 的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目:
的反应原理可用下面的化学方程式表示,在方程式中标出电子转移的方向和数目: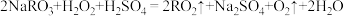
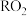 杀菌效果是
杀菌效果是 的
的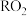 与
与 消毒杀菌后均被还原为
消毒杀菌后均被还原为 ,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
,杀菌效果与单位物质的量的氧化剂得电子的物质的量有关)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数的2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3∶5。请回答:
(1)D的元素名称为___ 。F在元素周期表中的位置是___________ 。
(2)C离子结构示意图为______ ,A、D形成的氢化物中稳定性更好的是:______ ,以上元素最高价氧化物对应水化物中碱性最强的是____ ,E和F元素的单质氧化性较强的是:_________ (填化学式)。
(3)用电子式表示由元素B和F组成的化合物的过程:____________ 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为_____________ 、______________ 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2 mol该物质参加反应时转移0.3 mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为___________________ 。
(1)D的元素名称为
(2)C离子结构示意图为
(3)用电子式表示由元素B和F组成的化合物的过程:
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2 mol该物质参加反应时转移0.3 mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】下表是元素周期表的一部分,回答下列问题:
(1)写出①元素最高价氧化物的电子式和结构式________________ ,________________ 。
(2)这些元素的最高价氧化物的对应水化物中,________ 酸性最强(填化学式);________ 碱性最强(填化学式);能形成两性氢氧化物的元素是________ (填元素符号)。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |  |  |
(2)这些元素的最高价氧化物的对应水化物中,
您最近一年使用:0次



