1 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视⻆。铁元素的“价-类”二维图如图所示:

(1)C的化学式是___________ ,E→F反应的化学方程式是___________ ,反应过程的现象为___________ 。
(2)A在一定条件下可以和水蒸气发生反应,反应方程式是___________ 。
(3)维生素C可将H转化为G,维生素C具有___________ (填“酸性”、“氧化性”或“还原性”)。
(4)在指定条件下,下列铁及其化合物之间的转化不能实现的是___________ 。
A.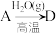 B.
B.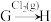 C.
C.
(5)某小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的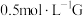 溶液,5%
溶液,5% 溶液
溶液
上述实验中 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是___________ 。

(1)C的化学式是
(2)A在一定条件下可以和水蒸气发生反应,反应方程式是
(3)维生素C可将H转化为G,维生素C具有
(4)在指定条件下,下列铁及其化合物之间的转化不能实现的是
A.
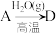 B.
B.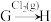 C.
C.
(5)某小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
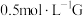 溶液,5%
溶液,5% 溶液
溶液| 操作 | 现象 |
取 酸化的G溶液于试管中,加入 酸化的G溶液于试管中,加入 5% 5% 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与G溶液反应的离子方程式是
溶液与G溶液反应的离子方程式是
您最近一年使用:0次
2 . 铁矿(主要成分为FeS2)在酸性条件和催化剂作用下,可发生如图所示的转化。下列说法错误的是
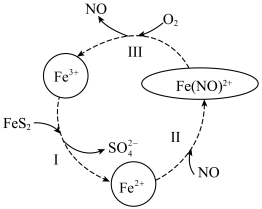

| A.反应Ⅰ、Ⅱ、Ⅲ均属于氧化还原反应 |
B.反应Ⅰ的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2 +16H+ +16H+ |
| C.反应Ⅲ中氧化剂与还原剂的物质的量比为1∶4 |
| D.该过程中Fe3+、NO是催化剂 |
您最近一年使用:0次
解题方法
3 . 下列反应的离子方程式正确的是
A.氯气尾气处理的原理: |
B.少量 通入 通入 溶液中: 溶液中: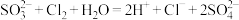 |
C.向红色 溶液中加入过量铁粉至溶液红色褪去: 溶液中加入过量铁粉至溶液红色褪去: |
| D.向含氯化亚铁的氯化铁溶液中通入适量氯气除杂质Fe2+:2Fe2++Cl2=2Fe3++2Clˉ |
您最近一年使用:0次
名校
解题方法
4 . 金属材料广泛应用于生产生活中。
(1)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是_____ 。
(2)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,是将30%的FeCl3溶液敷在绝缘板的铜片上进行腐蚀,写出FeCl3溶液与铜反应的离子方程式:_____ ;某学生对FeCl3腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式_____ 。
(3)为了从含有FeSO4、CuSO4的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。

①固体X的成分_____ ,试剂B是_____
②检验Z溶液中阳离子可用酸性KMnO4溶液,现象是_____ ,该反应的离子方程式_____ 。
(1)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量Fe2O3于试管中,加入过量盐酸充分反应 | 黑色固体溶解,生成绿色溶液 | Fe2O3为碱性氧化物 |
| B | 将铜粉加1.0mol/LFe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 取少量FeCl2溶液于试管中,滴加几滴新制氯水,再滴2滴KSCN溶液 | 溶液变红 | FeCl2溶液没有变质 |
| D | 往红热的铁中通入水蒸气,将生成的气体通入肥皂液中,将燃着的火柴靠近气泡 | 气泡被点燃 | 铁在高温下能与水蒸气反应 |
(3)为了从含有FeSO4、CuSO4的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。

①固体X的成分
②检验Z溶液中阳离子可用酸性KMnO4溶液,现象是
您最近一年使用:0次
5 . 某班同学用如下实验探究Fe2+与Fe3+的转化,回答下列问题,
(1)实验I:Fe3+转化为Fe2+
实验步骤及现象:甲组同学将少量铜粉加入1mL0.lmol/LFeCl3溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL0.lmol/LFeCl3溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入lmL0.05mol/LFe2(SO4)3溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,测入蒸馏水后无白色沉淀。
①分别取三组实验反应后的溶液于三支试管中加入几滴K3[Fe(CN)6]溶液,出现蓝色沉淀,证明生成了Fe2+;分析三组实验结果,实验中均发生的反应离子方程式为_______ 。
②对比三组实验,说明加入蒸馏水后沉淀的产生与_______ 有关。
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为_______ 。
④丙组在检验反应后的溶液中是否存在Fe3+时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.SCN-的化学性质与I-相似,CuSCN为白色固体;ii.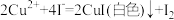 ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为_______ 。
(2)实验II:Fe2+转化为Fe3+
实验步骤及现象:向3mL0.1mol/LFeSO4溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知硝酸具有氧化性, (棕色):
(棕色):
⑤使用的FeSO4溶液中存在少量铁屑,其目的是_______ 。
⑥实验中产生NO的原因为_______ (用离子方程式表示)。
(1)实验I:Fe3+转化为Fe2+
实验步骤及现象:甲组同学将少量铜粉加入1mL0.lmol/LFeCl3溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL0.lmol/LFeCl3溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入lmL0.05mol/LFe2(SO4)3溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,测入蒸馏水后无白色沉淀。
①分别取三组实验反应后的溶液于三支试管中加入几滴K3[Fe(CN)6]溶液,出现蓝色沉淀,证明生成了Fe2+;分析三组实验结果,实验中均发生的反应离子方程式为
②对比三组实验,说明加入蒸馏水后沉淀的产生与
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为
④丙组在检验反应后的溶液中是否存在Fe3+时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.SCN-的化学性质与I-相似,CuSCN为白色固体;ii.
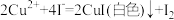 ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为(2)实验II:Fe2+转化为Fe3+
实验步骤及现象:向3mL0.1mol/LFeSO4溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知硝酸具有氧化性,
 (棕色):
(棕色):⑤使用的FeSO4溶液中存在少量铁屑,其目的是
⑥实验中产生NO的原因为
您最近一年使用:0次
6 . 能正确表示下列反应的离子方程式为
A.向 溶液中通入过量 溶液中通入过量 : : |
B.食醋去除水垢中的 : :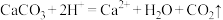 |
C.向碳酸钠溶液中通入少量 : : |
D.次磷酸(一元弱酸)与足量NaOH溶液反应: |
您最近一年使用:0次
2024-04-03更新
|
63次组卷
|
2卷引用:海南省华东师范大学第二附属中学乐东黄流中学2023-2024学年高一上学期11月期中化学试题
名校
7 . 在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞溶液变红的溶液: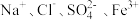 |
B.在pH=1的溶液中: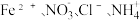 |
C.常温下: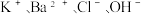 |
D.在pH=1的溶液中: |
您最近一年使用:0次
名校
解题方法
8 . 长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
②若要使部分变质的FeSO4复原,方法是___________ 。(用离子反应方程式表示)
(2)利用部分变质 的FeSO4溶液制备Fe2O3。
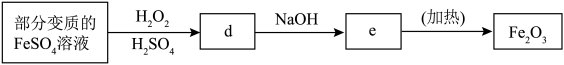
①填写下列各空:
d.___________ ;e.___________ 。
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为___________ 。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由___________ 。
(1)设计实验检验FeSO4溶液的变质程度
①将方案补充完整
| 实验方案 | 实验现象 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | ii | FeSO4溶液部分变质 |
| 步骤2 | i | iii | |
(2)利用

①填写下列各空:
d.
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
您最近一年使用:0次
名校
9 . 下列离子方程式书写正确的是
A.向溴化亚铁溶液中通入少量Cl2: |
B.向氯化钡溶液中通SO2: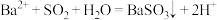 |
C.硫酸铝溶液与过量氨水反应: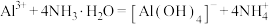 |
D.稀硝酸与过量铁粉反应: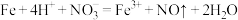 |
您最近一年使用:0次
名校
解题方法
10 . 在含有大量Fe2+、 、
、 的强酸性溶液中加入下列试剂后,溶液中主要存在的一组离子正确的是
的强酸性溶液中加入下列试剂后,溶液中主要存在的一组离子正确的是
 、
、 的强酸性溶液中加入下列试剂后,溶液中主要存在的一组离子正确的是
的强酸性溶液中加入下列试剂后,溶液中主要存在的一组离子正确的是A.通入过量Cl2: 、 、 、 、 、 、 、 、 |
B.加入少量NaClO溶液: 、 、 、 、 、 、 、 、 |
C.加入过量NaClO和NaOH的混合溶液: 、 、 、 、 、 、 、 、 |
D.加入过量NaOH溶液: 、 、 、 、 、 、 、 、 |
您最近一年使用:0次
2024-04-01更新
|
198次组卷
|
2卷引用:湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷



