名校
1 . 下列实验方案不可行的是
| A.用碱石灰干燥氨气 | B.用蓝色石蕊试液检验酸性溶液 |
| C.通入Cl2除去FeCl3溶液中的FeCl2 | D.加入Fe粉除去Al3+溶液中的杂质Cu2+ |
您最近一年使用:0次
2 . 下列离子方程式正确的是
A. 溶于水: 溶于水: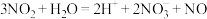 |
B. 溶液中加入过量NaOH溶液并加热: 溶液中加入过量NaOH溶液并加热: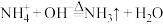 |
C. 气体通入氨水: 气体通入氨水: |
D.过量铁粉与稀硝酸混合,产生气体: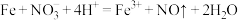 |
您最近一年使用:0次
名校
3 . 下列关于物质的除杂、鉴别、检验的方法中错误的是
A.除去 溶液中 溶液中 的方法是往溶液中缓缓通入氧气 的方法是往溶液中缓缓通入氧气 |
B. 与溴蒸气的鉴别可以用水、 与溴蒸气的鉴别可以用水、 溶液或 溶液或 ,但不能用湿润的碘化钾淀粉试纸 ,但不能用湿润的碘化钾淀粉试纸 |
C.检验 是否变质,可取少量样品溶解并滴加 是否变质,可取少量样品溶解并滴加 溶液,观察溶液是否褪色 溶液,观察溶液是否褪色 |
D.检验 溶液是否变质,可取少量样品于试管中并滴加KSCN,观察溶液是否变红 溶液是否变质,可取少量样品于试管中并滴加KSCN,观察溶液是否变红 |
您最近一年使用:0次
4 . 碘是一种紫黑色固体,微溶于水,碘单质及碘的化合物被广泛用于医疗、染料等方面。一种以海水为原料制备碘单质的方法如图所示。
(1)将海水中的 “富集”得到悬浊液,有关反应的离子方程式是
“富集”得到悬浊液,有关反应的离子方程式是________ 。
(2)“转化”时用铁粉而不用铁片的原因是________ 。 进入“氧化”环节,通入
进入“氧化”环节,通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为________ ;若反应物用量比 时,氧化产物为
时,氧化产物为________ ;
(3)欲判断经一系列处理后的水溶液中是否含有 ,应进行的操作是
,应进行的操作是________ 。
(4)成品中 的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取
的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的
溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的 用
用 溶液除去,反应式为
溶液除去,反应式为 。测定时消耗
。测定时消耗 溶液体积VmL样品中
溶液体积VmL样品中 的含量为
的含量为________ (用质量分数表示)。

(1)将海水中的
 “富集”得到悬浊液,有关反应的离子方程式是
“富集”得到悬浊液,有关反应的离子方程式是(2)“转化”时用铁粉而不用铁片的原因是
 进入“氧化”环节,通入
进入“氧化”环节,通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为(3)欲判断经一系列处理后的水溶液中是否含有
 ,应进行的操作是
,应进行的操作是(4)成品中
 的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取
的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取 的
的 溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的
溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的 用
用 溶液除去,反应式为
溶液除去,反应式为 。测定时消耗
。测定时消耗 溶液体积VmL样品中
溶液体积VmL样品中 的含量为
的含量为
您最近一年使用:0次
5 . 高纯硅制备过程中会产生副产物 ,某同学在实验室以
,某同学在实验室以 和硅镁石(含
和硅镁石(含 、
、 及少量Fe的氧化物)为原料,制备氯化镁晶体(
及少量Fe的氧化物)为原料,制备氯化镁晶体( )并回收
)并回收 的工艺流程如图所示:
的工艺流程如图所示:
回答下列问题:
(1)写出 “水溶”过程中发生反应的化学方程式:
“水溶”过程中发生反应的化学方程式:_______ 。
(2)“氧化”时加 发生反应的离子方程式为
发生反应的离子方程式为_______ ,反应温度不易过高,主要原因是_______ 。
(3)试剂X的作用为“调pH”将杂质转化为沉淀而除去,同时不引入杂质,试剂X可以是下列试剂中的_______ (填字母),“调pH”的范围为_______ 。
A.NaOH B. C.
C. D.MgO
D.MgO
(4)“沉淀1”灼烧后所得固体与“沉淀2”共同用于回收 ,“沉淀1”灼烧时应在
,“沉淀1”灼烧时应在_______ (填仪器名称)中进行。
(5)若以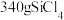 为原料,理论上制得
为原料,理论上制得 的质量为
的质量为_______ g(假设反应过程中Cl元素无损耗)。
 ,某同学在实验室以
,某同学在实验室以 和硅镁石(含
和硅镁石(含 、
、 及少量Fe的氧化物)为原料,制备氯化镁晶体(
及少量Fe的氧化物)为原料,制备氯化镁晶体( )并回收
)并回收 的工艺流程如图所示:
的工艺流程如图所示: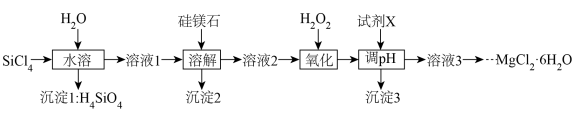
 |  | |
| 开始沉淀的pH | 2.2 | 9.6 |
| 沉淀完全的pH | 3.5 | 11.6 |
(1)写出
 “水溶”过程中发生反应的化学方程式:
“水溶”过程中发生反应的化学方程式:(2)“氧化”时加
 发生反应的离子方程式为
发生反应的离子方程式为(3)试剂X的作用为“调pH”将杂质转化为沉淀而除去,同时不引入杂质,试剂X可以是下列试剂中的
A.NaOH B.
 C.
C. D.MgO
D.MgO(4)“沉淀1”灼烧后所得固体与“沉淀2”共同用于回收
 ,“沉淀1”灼烧时应在
,“沉淀1”灼烧时应在(5)若以
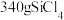 为原料,理论上制得
为原料,理论上制得 的质量为
的质量为
您最近一年使用:0次
名校
6 . 下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究浓硫酸的吸水性 | 向表面皿中加入少量 ,再加入约3mL浓硫酸,搅拌,观察实验现象 ,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 比较浓硝酸和浓盐酸的氧化性强弱 | 室温下,在浓硝酸和浓盐酸中分别投入光亮的铁钉 |
C | 探究浓硫酸与木炭反应的气体产物中是否含有 | 将浓硫酸与木炭混合加热生成的气体通入足量澄清石灰水中,观察是否有白色沉淀产生 |
D | 检验 | 将 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-11更新
|
501次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题
名校
7 . 铁是人体必需的微量元素,主要存在于血红蛋白中。L-乳酸亚铁为第二代补铁剂,可以治疗缺铁性贫血。已知L-乳酸亚铁在水中溶解度较小,且难溶于乙醇。其制备流程图如下:_______ 。
(2)“恒温反应”后加入乙醇的作用是_______ 。
(3)洗涤操作中使用的玻璃仪器有烧杯、_______ 、_______ 。
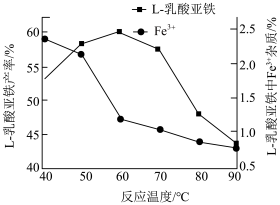
(4)“恒温反应”对提高产品质量十分重要,下图为反应温度与产品产率及产品中Fe3+杂质含量的关系。由图可知应选择的合适温度为__ 。温度过高时,FeC12溶液在空气中会由浅绿色变为黄色,并伴有红褐色物质出现,该反应的化学方程式为_______ 。_______ 。

(2)“恒温反应”后加入乙醇的作用是
(3)洗涤操作中使用的玻璃仪器有烧杯、
(4)“恒温反应”对提高产品质量十分重要,下图为反应温度与产品产率及产品中Fe3+杂质含量的关系。由图可知应选择的合适温度为
您最近一年使用:0次
名校
解题方法
8 . 有关反应的离子方程式书写正确的是(均充分反应)
A.向 明矾溶液中滴入几滴 明矾溶液中滴入几滴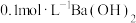 溶液: 溶液: |
B.向KI与稀硫酸的混合溶液中通入氧气: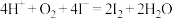 |
C. 溶液中通入 溶液中通入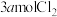 : :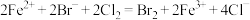 |
D.在澄清石灰水中加入少量碳酸氢镁(易溶)溶液: |
您最近一年使用:0次
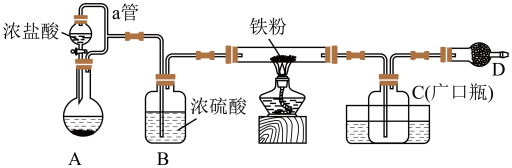
9 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题: 与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目
与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目___________ ,当生成 氯气,做还原剂的
氯气,做还原剂的 的物质的量为
的物质的量为___________ mol。
(2)仪器D的名称是___________ ,D中装的药品可以是___________ (填序号)。
A. B.碱石灰 C.
B.碱石灰 C. D.
D.
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取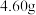 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式___________ 计算该样品中铁元素的质量分数为___________ %(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有 杂质。
杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是___________ 。
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
 与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目
与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目 氯气,做还原剂的
氯气,做还原剂的 的物质的量为
的物质的量为(2)仪器D的名称是
A.
 B.碱石灰 C.
B.碱石灰 C. D.
D.
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)| A.KSCN溶液 | B.酸性 溶液 溶液 |
C. 溶液 溶液 | D.KI-淀粉溶液 |
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取
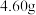 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式(5)由(4)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有
 杂质。
杂质。②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是
您最近一年使用:0次
名校
解题方法
10 . 利用赤铁矿(主要成分为 )、磁铁矿(主要成分为
)、磁铁矿(主要成分为 )、菱铁矿(主要成分为
)、菱铁矿(主要成分为 )都可以制备铁红。如图是
)都可以制备铁红。如图是 可以制备铁红的流程。
可以制备铁红的流程。
(2)检验滤液A中含有 的试剂是
的试剂是_____ 。(写名称)
(3)在空气中煅烧 的方程式为
的方程式为_____ 。
(4)铁红中的铁元素质量往往大于原磁铁矿中铁元素质量的原因是_____ 。
 )、磁铁矿(主要成分为
)、磁铁矿(主要成分为 )、菱铁矿(主要成分为
)、菱铁矿(主要成分为 )都可以制备铁红。如图是
)都可以制备铁红。如图是 可以制备铁红的流程。
可以制备铁红的流程。
| A.Fe | B.FeO | C. | D. |
(2)检验滤液A中含有
 的试剂是
的试剂是(3)在空气中煅烧
 的方程式为
的方程式为(4)铁红中的铁元素质量往往大于原磁铁矿中铁元素质量的原因是
您最近一年使用:0次

 固体是否氧化变质
固体是否氧化变质

