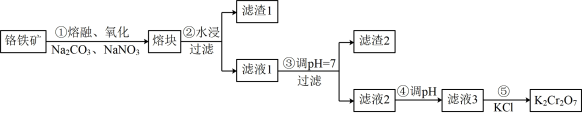
1 . 铬铁矿的主要成分为FeO▪Cr2O3, 制备K2Cr2O7流程如图所示:
(1)基态Cr原子价电子轨道分布图为__________ ,铬位于元素周期表中__________ 区。
(2)配合物[Cr(NH3)4(H2O)2]Cl中提供电子对形成配位键的原子是__________ ,中心离子的配位数为_________ 。
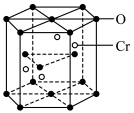
(3)铬的一种氧化物晶胞结构如图所示,若六棱柱的底面边长为lnm,高为hnm,NA代表同伏加德罗常数的值,则该晶体的密度p=__________ g/cm3。 形式存在。则该步主要反应的方程为
形式存在。则该步主要反应的方程为__________ ,该步骤不能使用陶瓷容器,原因是__________ 。
(5)步骤④调滤液2的pH使之变__________ (填“大”或“小”)。原因是__________ (用离子方程式表示)。
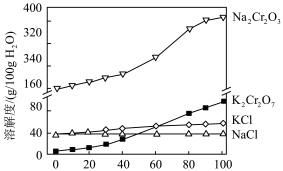
(6)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,分离得到K2Cr2O7固体的方法是__________ ,冷却到__________ (填标号)得到的K2Cr2O7固体产品最多。
(7)已知Ksp(Ag2CrO4 )=1.0×10-12、Ksp(AgCl)=2.0×10-10, 若用10LNaCl溶液溶解0.1mol的Ag2CrO4固体,则NaCl溶液的最初浓度不得低于__________ mol/L。
(1)基态Cr原子价电子轨道分布图为
(2)配合物[Cr(NH3)4(H2O)2]Cl中提供电子对形成配位键的原子是
(3)铬的一种氧化物晶胞结构如图所示,若六棱柱的底面边长为lnm,高为hnm,NA代表同伏加德罗常数的值,则该晶体的密度p=
 形式存在。则该步主要反应的方程为
形式存在。则该步主要反应的方程为(5)步骤④调滤液2的pH使之变
(6)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,分离得到K2Cr2O7固体的方法是
(7)已知Ksp(Ag2CrO4 )=1.0×10-12、Ksp(AgCl)=2.0×10-10, 若用10LNaCl溶液溶解0.1mol的Ag2CrO4固体,则NaCl溶液的最初浓度不得低于
您最近一年使用:0次
解题方法
2 . 东晋《华阳国志•南中志》已有白铜(铜镍合金)的记载,回答下列问题:
(1)镍元素基态原子的电子排布式为______ ,3d能级上的未成对的电子数为______ 。
(2)硫酸镍溶于氨水形成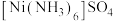 蓝色溶液,在
蓝色溶液,在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为______ ,配位原子是______ , 中阴离子的立体构型是
中阴离子的立体构型是______ 。
(3)单质铜及镍都是由______ 键形成的晶体,元素铜与镍的第二电离能分别为: kJ⋅mol
kJ⋅mol ,
,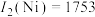 kJ⋅mol
kJ⋅mol ,
,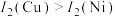 的原因是
的原因是____________ 。
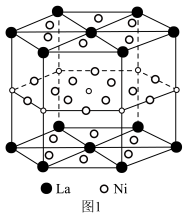
(4)现有La、Ni合金是较为理想的储氢材料,其晶胞结构如图1所示:______ 。
②已知晶胞参数边长为a nm,高为b nm,设阿伏加德罗常数的值为 。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为
。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为______ g·cm 。
。
(5)用含镍废料(含镍、铝、氧化铁、碳等杂质)提取蓄电池材料 ,流程如图2所示:
,流程如图2所示: 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。
①酸浸时镍的浸出率与温度的关系如图3所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是____________ (从两个角度分析)。
②证明“沉镍”中, 已经沉淀完全的实验步骤及现象为
已经沉淀完全的实验步骤及现象为____________ 。
③电解过程产生的氯气在弱碱条件下生成了 ,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式
,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式____________ 。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成
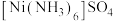 蓝色溶液,在
蓝色溶液,在 中
中 与
与 之间形成的化学键称为
之间形成的化学键称为 中阴离子的立体构型是
中阴离子的立体构型是(3)单质铜及镍都是由
 kJ⋅mol
kJ⋅mol ,
,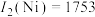 kJ⋅mol
kJ⋅mol ,
,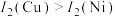 的原因是
的原因是(4)现有La、Ni合金是较为理想的储氢材料,其晶胞结构如图1所示:
②已知晶胞参数边长为a nm,高为b nm,设阿伏加德罗常数的值为
 。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为
。若一个晶胞内可以储存18个氢原子,则储氢后的晶胞密度为 。
。(5)用含镍废料(含镍、铝、氧化铁、碳等杂质)提取蓄电池材料
 ,流程如图2所示:
,流程如图2所示: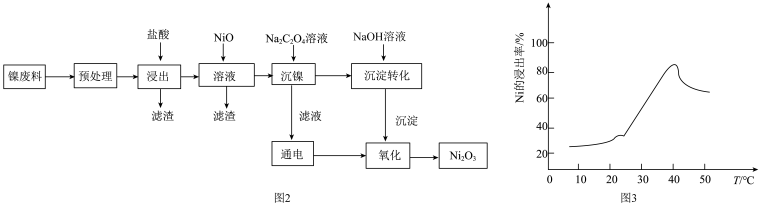
 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。①酸浸时镍的浸出率与温度的关系如图3所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是
②证明“沉镍”中,
 已经沉淀完全的实验步骤及现象为
已经沉淀完全的实验步骤及现象为③电解过程产生的氯气在弱碱条件下生成了
 ,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式
,再把二价镍氧化为三价镍,写出“氧化”反应的离子方程式
您最近一年使用:0次
3 . 锰的化合物用途与性质的探究,有关物质及颜色: (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:
Ⅰ.用 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
(1)操作Ⅰ为______ ,操作Ⅱ为______ 。
(2)无色液体A是______ ,.定性检验A的试剂是______ ,现象是____________ 。
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程____________ 。
Ⅱ.探究 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略): 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
实验ⅱ:物质a为40% KOH溶液,C中通入 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。
(4)通入 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为____________ 。
(5) 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是____________ 。
(6)浓碱条件下, 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为____________ 。
(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因____________ 。
 (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:Ⅰ.用
 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。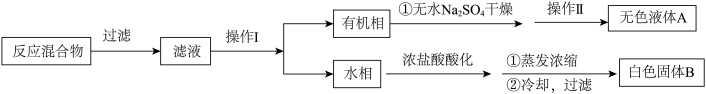
(1)操作Ⅰ为
(2)无色液体A是
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程
Ⅱ.探究
 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略):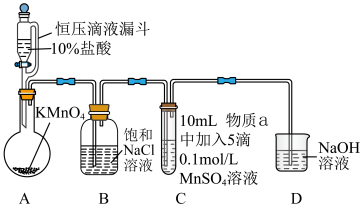
 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。实验ⅱ:物质a为40% KOH溶液,C中通入
 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。(4)通入
 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为(5)
 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是(6)浓碱条件下,
 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因
您最近一年使用:0次
名校
解题方法
4 . 用NaOH标准溶液滴定食用白醋,测定其中醋酸含量的操作中正确的是
| A.盛白醋溶液的锥形瓶滴定前用白醋溶液润洗2~3次 |
| B.酸式滴定管在装液前要用白醋溶液润洗2~3次 |
| C.配标准溶液是称取4.0g NaOH固体放入1000mL容量瓶中,然后加水至刻度 |
| D.用甲基橙作指示剂,溶液恰好由红色变为黄色,为滴定终点 |
您最近一年使用:0次
2024-04-21更新
|
263次组卷
|
2卷引用:天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷
解题方法
5 . 燃煤烟气中含有 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。
(1)已知:




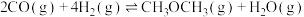

用 、
、 表示
表示 ,
,
___________ 。
(2)气体转化: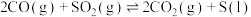
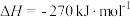 。
。
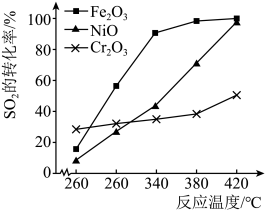
①相同条件下,分别选取 、NiO、
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是___________ 。
②若在2L恒容密闭容器中,将3mol CO、1mol 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=___________ 。
③向反应容器中再分别通入下列气体,可以使 转化率增大的是
转化率增大的是___________ (填字母)。
a.CO b. c.
c. d.
d.
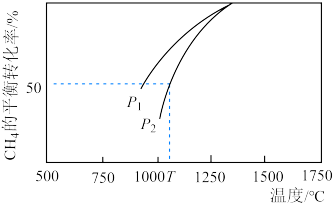
(3) 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
___________  (填“>”或“<”=)。若
(填“>”或“<”=)。若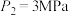 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中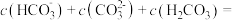
___________  ,此时溶液pH=a,
,此时溶液pH=a,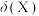 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则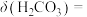
___________ (用含a、b、c的式子表示)。(已知 的两步电离常数
的两步电离常数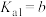 ,
,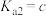 )
)
 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。(1)已知:




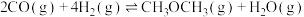

用
 、
、 表示
表示 ,
,
(2)气体转化:
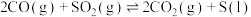
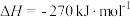 。
。①相同条件下,分别选取
 、NiO、
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是
②若在2L恒容密闭容器中,将3mol CO、1mol
 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=③向反应容器中再分别通入下列气体,可以使
 转化率增大的是
转化率增大的是a.CO b.
 c.
c. d.
d.
(3)
 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“>”或“<”=)。若
(填“>”或“<”=)。若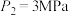 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)
 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中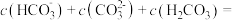
 ,此时溶液pH=a,
,此时溶液pH=a,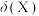 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则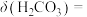
 的两步电离常数
的两步电离常数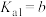 ,
,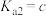 )
)
您最近一年使用:0次
解题方法
6 . 请回答下列问题:
Ⅰ.已知: 和HClO的电离平衡常数(25℃)如下:
和HClO的电离平衡常数(25℃)如下:
(1)相同物质的量浓度的 、
、 、NaClO溶液,pH由小到大的顺序是
、NaClO溶液,pH由小到大的顺序是___________ 。
(2)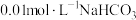 的溶液中
的溶液中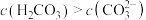 ,结合化学用语解释其原因:
,结合化学用语解释其原因:___________ 。
(3)请写出NaClO溶液中通入少量二氧化碳的离子方程式___________ 。
(4)盐碱地(含有较多的NaCl、 )不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因
)不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因___________ ,用石膏降低其碱性的反应原理___________ (用离子方程式及必要的文字说明)。
(5)根据酸碱质子理论,给出质子( )的物质是酸,给出质子的能力越强,酸性越强。已知:
)的物质是酸,给出质子的能力越强,酸性越强。已知: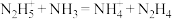 ,
, ,写出上述物质的酸性由强到弱的顺序
,写出上述物质的酸性由强到弱的顺序___________ 。
Ⅱ.在粗制 晶体中常含有杂质
晶体中常含有杂质 。在提纯时,为了除去
。在提纯时,为了除去 ,常加入少量
,常加入少量 ,使
,使 氧化为
氧化为 ,然后调节溶液pH=4,可以达到除去
,然后调节溶液pH=4,可以达到除去 而不损失的目的。
而不损失的目的。
(6)通过计算解释原因___________ (已知:①25℃时 饱和溶液中
饱和溶液中 。②25℃时
。②25℃时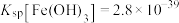 ,
,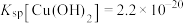 )。
)。
(7)计算过程:___________ 。
Ⅰ.已知:
 和HClO的电离平衡常数(25℃)如下:
和HClO的电离平衡常数(25℃)如下:| 化学式 |  | HClO |
电离平衡常数( ) ) |   |  |
 、
、 、NaClO溶液,pH由小到大的顺序是
、NaClO溶液,pH由小到大的顺序是(2)
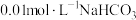 的溶液中
的溶液中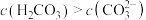 ,结合化学用语解释其原因:
,结合化学用语解释其原因:(3)请写出NaClO溶液中通入少量二氧化碳的离子方程式
(4)盐碱地(含有较多的NaCl、
 )不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因
)不利于农作物生长,通过施加适量的石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因(5)根据酸碱质子理论,给出质子(
 )的物质是酸,给出质子的能力越强,酸性越强。已知:
)的物质是酸,给出质子的能力越强,酸性越强。已知: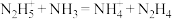 ,
, ,写出上述物质的酸性由强到弱的顺序
,写出上述物质的酸性由强到弱的顺序Ⅱ.在粗制
 晶体中常含有杂质
晶体中常含有杂质 。在提纯时,为了除去
。在提纯时,为了除去 ,常加入少量
,常加入少量 ,使
,使 氧化为
氧化为 ,然后调节溶液pH=4,可以达到除去
,然后调节溶液pH=4,可以达到除去 而不损失的目的。
而不损失的目的。(6)通过计算解释原因
 饱和溶液中
饱和溶液中 。②25℃时
。②25℃时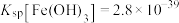 ,
,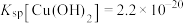 )。
)。(7)计算过程:
您最近一年使用:0次
名校
7 . 完成下列问题。
(1)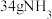 与标况下
与标况下___________ L 气体含相同数目H原子。
气体含相同数目H原子。
(2)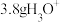 含电子数目为
含电子数目为___________ 。
(3)三种盐混合溶液中含 和
和 ,则
,则 的物质的量为
的物质的量为___________ 。
(4)取某浓度氢氧化钠溶液 ,通入一定量
,通入一定量 ,随后取
,随后取 溶液,向其中逐滴滴入
溶液,向其中逐滴滴入 的盐酸,在标准状况下产生
的盐酸,在标准状况下产生 的体积(y轴)与所加入盐酸的体积(x轴)的关系如图:
的体积(y轴)与所加入盐酸的体积(x轴)的关系如图:
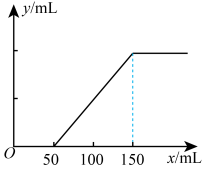
①通入 后所得溶液溶质是
后所得溶液溶质是___________ (填化学式),其物质的量之比为___________ 。
②氢氧化钠溶液的物质的量浓度为___________ 。
(5)下列几种导电性变化图象,把符合要求的图象序号填在相应的题目后面横线上:
A. B.
B.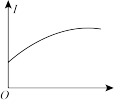 C.
C.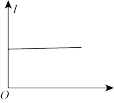
向 溶液中通入
溶液中通入 直至过量
直至过量______ (提示 );向
);向 溶液通入少量
溶液通入少量
____ ;)向氨水中通入 直至过量
直至过量______ ;向饱和石灰水中不断通入
______ 。
(1)
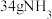 与标况下
与标况下 气体含相同数目H原子。
气体含相同数目H原子。(2)
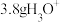 含电子数目为
含电子数目为(3)三种盐混合溶液中含
 和
和 ,则
,则 的物质的量为
的物质的量为(4)取某浓度氢氧化钠溶液
 ,通入一定量
,通入一定量 ,随后取
,随后取 溶液,向其中逐滴滴入
溶液,向其中逐滴滴入 的盐酸,在标准状况下产生
的盐酸,在标准状况下产生 的体积(y轴)与所加入盐酸的体积(x轴)的关系如图:
的体积(y轴)与所加入盐酸的体积(x轴)的关系如图:
①通入
 后所得溶液溶质是
后所得溶液溶质是②氢氧化钠溶液的物质的量浓度为
(5)下列几种导电性变化图象,把符合要求的图象序号填在相应的题目后面横线上:
A.
 B.
B. C.
C.
向
 溶液中通入
溶液中通入 直至过量
直至过量 );向
);向 溶液通入少量
溶液通入少量
 直至过量
直至过量
您最近一年使用:0次
名校
解题方法
8 . 按写出下列反应的方程式:
(1)钠投入氯化铁溶液中反应的离子方程式:______ 。
(2)过氧化钠与二氧化碳反应的化学方程式:______ 。
(3)氯气与水反应的离子方程式:______ 。
(4)漂白粉应密封避光保存,原因为______ 、______ (用化学方程式解释)。
(5)硫酸氢钠与氢氧化钡反应至溶液呈中性的离子方程式:______ 。
(6)氯酸钾和浓盐酸制氯气的化学方程式:______ 。
(7)“84消毒液”(主要成分是NaClO)与“洁厕灵”(主要成分为HCl)不能混用的原因(离子方程式):______ 。
(1)钠投入氯化铁溶液中反应的离子方程式:
(2)过氧化钠与二氧化碳反应的化学方程式:
(3)氯气与水反应的离子方程式:
(4)漂白粉应密封避光保存,原因为
(5)硫酸氢钠与氢氧化钡反应至溶液呈中性的离子方程式:
(6)氯酸钾和浓盐酸制氯气的化学方程式:
(7)“84消毒液”(主要成分是NaClO)与“洁厕灵”(主要成分为HCl)不能混用的原因(离子方程式):
您最近一年使用:0次
名校
9 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1) 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为___________ , 水解反应的产物为
水解反应的产物为___________ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式___________ , 的分子空间构型为
的分子空间构型为___________ 。 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角___________  中
中 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因___________ 。
(3)已知: 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到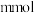 铜粉和
铜粉和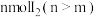 的固体混合物中,振荡。
的固体混合物中,振荡。
实验记录如下:
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是___________ 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
溶液,___________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是___________ 。
(4)一定条件下, 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
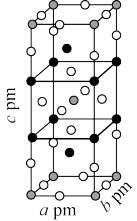
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为___________ 。
(1)
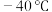 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式 的分子空间构型为
的分子空间构型为 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角 中
中 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)已知:
 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到 铜粉和
铜粉和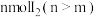 的固体混合物中,振荡。
的固体混合物中,振荡。实验记录如下:
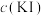 | 实验现象 | |
| 实验Ⅰ |  | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ |  | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ |  |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是 溶液,
溶液,(4)一定条件下,
 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为
您最近一年使用:0次
名校
10 . 用强光照射新制氯水,测得溶液pH与光照时间关系如下图。
已知氯水中存在反应I: 。下列说法不正确的是
。下列说法不正确的是

已知氯水中存在反应I:
 。下列说法不正确的是
。下列说法不正确的是
| A.根据图中数据,光照过程中氯水pH降低,溶液c(H+)增大,反应I逆向移动 |
| B.往氯水中滴加AgNO3溶液,反应I正向移动,c(H+)增大 |
| C.往氯水中滴加Na2CO3溶液,反应I正向移动,c(H+)减小 |
| D.氯气难溶于饱和NaCl溶液的其中一个原因是在饱和NaCl溶液中反应I被抑制 |
您最近一年使用:0次
2023-10-22更新
|
212次组卷
|
3卷引用:天津市第一中学2023-2024学年高二上学期11月期中考试化学试题



