名校
1 . 科学家通过对火星岩石样本的研究提出,未来在火星可利用该岩石做催化剂进行人工光合作用,其中涉及的反应之一为 (该条件下所有物质均为气态)。下列说法错误的是。
(该条件下所有物质均为气态)。下列说法错误的是。
 (该条件下所有物质均为气态)。下列说法错误的是。
(该条件下所有物质均为气态)。下列说法错误的是。| A.该岩石可以加快该化学反应的速率 |
| B.改变温度可以改变该化学反应的限度 |
C.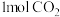 和 和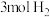 充分反应可得到 充分反应可得到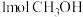 |
| D.混合气体的总质量保持不变可判断该反应达到化学平衡状态 |
您最近一年使用:0次
名校
解题方法
2 . 常温下,将除去表面氧化膜的Al片、Cu片插入浓 中组成原电池(如图1所示),测得原电池的电流(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是。
中组成原电池(如图1所示),测得原电池的电流(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是。
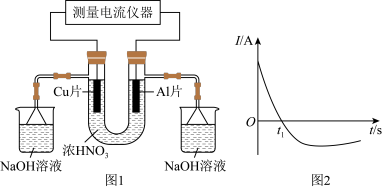
 中组成原电池(如图1所示),测得原电池的电流(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是。
中组成原电池(如图1所示),测得原电池的电流(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是。
A. 时刻前,Al片作负极 时刻前,Al片作负极 |
B. 时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应 时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应 |
C. 时刻后,Cu得电子作负极,电流方向发生改变 时刻后,Cu得电子作负极,电流方向发生改变 |
D.烧杯中发生的离子反应为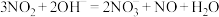 |
您最近一年使用:0次
名校
解题方法
3 . 下列离子方程式正确的是。
A.硅酸钠溶液中通入 : :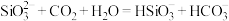 |
B.向烧碱溶液中加入一小段铝片: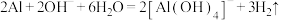 |
C.向新制氯水中滴加少量的 溶液: 溶液: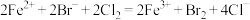 |
D.碳酸钙加入醋酸中: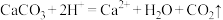 |
您最近一年使用:0次
名校
解题方法
4 . 化学在抗击新冠病毒的战役中作用显著,下列说法错误的是。
| A.84消毒液能使新冠病毒的蛋白质变性,从而用于公共场所的杀菌消毒 |
| B.口罩中的聚丙烯树脂,可由丙烯经加聚反应制得 |
| C.常用质量分数为75%的医用酒精杀灭新冠病毒 |
D.千金藤素(化学式为 )属于有机化合物,中国科学家发现其对新冠病毒具有显著抑制效果 )属于有机化合物,中国科学家发现其对新冠病毒具有显著抑制效果 |
您最近一年使用:0次
5 . 下图为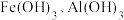 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是
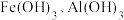 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是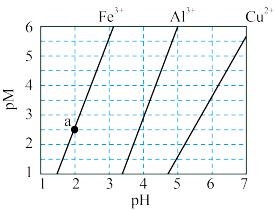
A.由 点可求得 点可求得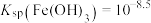 |
B. 时 时 的溶解度为 的溶解度为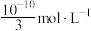 |
C.浓度均为 的 的 和 和 可通过分步沉淀进行分离 可通过分步沉淀进行分离 |
D.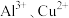 混合溶液中 混合溶液中 时二者不会同时沉淀 时二者不会同时沉淀 |
您最近一年使用:0次
2023-06-09更新
|
16989次组卷
|
33卷引用:河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题
河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题2023年高考全国甲卷化学真题(已下线)T13-溶液中的离子平衡(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题16 水溶液中的离子平衡(已下线)2023年高考山东卷化学真题变式题(不定项选择题)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)海南省海南中学2023-2024学年高三上学期第0次月考化学试题四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)第32讲难溶电解质的溶解平衡(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析福建泉州培元中学2023-2024学年上学期高三10月月考化学试题(已下线)选择题11-16福建省福州第四中学2023-2024学年高三上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省淮北市2023-2024学年高三上学期1月调研化学试题(已下线)选择题11-15(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)天津市耀华中学2023-2024学年高二上学期1月期末化学试题天津市耀华中学2023-2024学年高二上学期期末学情调研化学试卷山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷
6 . 实验室将粗盐提纯并配制 的
的 溶液。下列仪器中,本实验必须用到的有
溶液。下列仪器中,本实验必须用到的有
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
 的
的 溶液。下列仪器中,本实验必须用到的有
溶液。下列仪器中,本实验必须用到的有①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
| A.①②④⑥ | B.①④⑤⑥ | C.②③⑦⑧ | D.①⑤⑥⑧ |
您最近一年使用:0次
2023-06-09更新
|
13004次组卷
|
27卷引用:2024届河南省南阳市方城县第一高级中学高一上学期1月期末模拟预测化学试题
2024届河南省南阳市方城县第一高级中学高一上学期1月期末模拟预测化学试题2023年高考全国甲卷化学真题(已下线)T9-化学实验基础(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题13 化学实验基础(已下线)第08练 实验仪器的选用与基本操作 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点07 物质的量浓度(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点巩固卷12 化学实验基础(一)(3大考点67题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)河南省商丘市第一高级中学2022-2023学年高二下学期期末考试化学试题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)实验01 配制一定物质的量浓度的溶液-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)天津市南开中学2023-2024学年高三上学期第一次月考化学试题天津市南开中学2023-2024学年高三上学期第一次月检测化学试题天津市南开区2023-2024学年高三上学期阶段性质量检测(一)化学试题(已下线)考点1 常见仪器使用和实验基本操作(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第1讲 常用的仪器及基本操作(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)热点09 物质的分离、提纯、检验与鉴别河南省焦作市沁阳市第一中学2022-2023学年高一下学期6月份月考 化学试题(已下线)FHgkyldyjhx13(已下线)第02讲 物质的量浓度(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
7 . 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 纯碱可用于治疗胃溃疡 | 纯碱可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
B |  中的少量HCl杂质可将气体通入饱和 中的少量HCl杂质可将气体通入饱和 溶液除去 溶液除去 |  可与HCl反应 可与HCl反应 | Ⅰ对,Ⅱ错,无 |
C |  溶液中混有少量 溶液中混有少量 杂质,可加入适量NaOH除去 杂质,可加入适量NaOH除去 |  可与NaOH反应生成 可与NaOH反应生成 | Ⅰ对,Ⅱ对,有 |
D |  是淡黄色粉末 是淡黄色粉末 |  做供氧剂 做供氧剂 | Ⅰ对,Ⅱ对,有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-08更新
|
331次组卷
|
11卷引用:河南省南阳市第一中学校2022-2023学年高一上学期12月月考化学试题
河南省南阳市第一中学校2022-2023学年高一上学期12月月考化学试题河北省石家庄市第十八中学2021-2022学年高一上学期期中考试化学试题期中学业水平测试第一节 钠及其化合物 第2课时 钠的化合物 焰色试验安徽省肥东凯悦中学2021-2022学年高一上学期第三次自主检测化学试题河南省鹤壁市浚县第一中学2022-2023学年高一上学期10月考试化学试题广东省茂名化州市第一中学2021-2022学年高一上学期第二次月考化学试题黑龙江省勃利县高级中学2022-2023学年高一上学期11月期中考试化学试题辽宁省大连市金州高级中学2023-2024学年高一上学期10月月考化学试题辽宁省朝阳市名校联考2023-2024学年高一上学期期中考试化学试题 广东省广州市广外、铁一、广大附中等三校2023~2024学年高一上学期期中联考化学试题
名校
8 . 回答下列问题
(1)根据相关物质的电离常数(25℃),回答下列问题:
①
 HCN
HCN 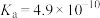

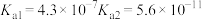
相同pH的① ,②
,② ,③
,③ ,④
,④ 溶液,物质的量浓度由大到小的顺序:
溶液,物质的量浓度由大到小的顺序:______ 。
②室温时 的电离平衡常数
的电离平衡常数 ,向 a L
,向 a L  溶液中加入b
溶液中加入b  固体
固体 (溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原
(溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原 溶液的浓度为
溶液的浓度为______ 
③实验室在制备 常用饱和食盐水除去其中混有的
常用饱和食盐水除去其中混有的 (g),请用化学平衡移动原理解释
(g),请用化学平衡移动原理解释 难溶于饱和食盐水的原因
难溶于饱和食盐水的原因______ 。
(2)常温下,将pH均为3,体积均为 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随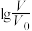 的变化如图所示。
的变化如图所示。______ (填写序号)。
①溶液中溶质的物质的量浓度HA>HB; ②溶液中溶质的物质的量浓度HA<HB;
③开始反应时的速率HA>HB; ④开始反应时的速率HA=HB;
⑤HA溶液里有锌剩余; ⑥HB溶液里有锌剩余
(3)亚磷酸( )是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
)是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
常温下,已知 溶液中含磷粒子的浓度之和为
溶液中含磷粒子的浓度之和为 ,溶液中含磷粒子的物质的量分数(
,溶液中含磷粒子的物质的量分数( )与溶液pH的关系如图所示。
)与溶液pH的关系如图所示。 溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为
溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为______ 。
(4)利用草酸( )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。
某次实验抽取血样10.00mL,加适量的草酸铵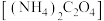 溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的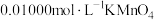 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液12.00mL。
溶液12.00mL。
相关离子方程式为: 。
。
①达到滴定终点的现象是______ 。
②血液样品中 浓度为
浓度为______  (保留4位有效数字)。
(保留4位有效数字)。
③下列操作可使所测结果偏高的是______ (填标号)。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
(5)常温下,向浓度为 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: 的电离常数K=
的电离常数K=______ (保留一位有效数字)
②比较b、c、d三点时的溶液中,由水电离出的 由大到小顺序为
由大到小顺序为______ 。
③根据以上滴定曲线判断下列说法正确的是______ (溶液中N元素只存在 和
和 两种形式)。
两种形式)。
A.点b所示溶液中: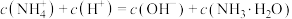
B.点c所示溶液中:
C.点d所示溶液中: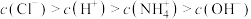
D.滴定过程中可能有: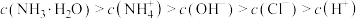
(1)根据相关物质的电离常数(25℃),回答下列问题:
①

 HCN
HCN 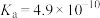

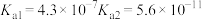
相同pH的①
 ,②
,② ,③
,③ ,④
,④ 溶液,物质的量浓度由大到小的顺序:
溶液,物质的量浓度由大到小的顺序:②室温时
 的电离平衡常数
的电离平衡常数 ,向 a L
,向 a L  溶液中加入b
溶液中加入b  固体
固体 (溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原
(溶液体积变化忽略不计),恢复至室温,混合液呈中性,则原 溶液的浓度为
溶液的浓度为
③实验室在制备
 常用饱和食盐水除去其中混有的
常用饱和食盐水除去其中混有的 (g),请用化学平衡移动原理解释
(g),请用化学平衡移动原理解释 难溶于饱和食盐水的原因
难溶于饱和食盐水的原因(2)常温下,将pH均为3,体积均为
 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随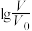 的变化如图所示。
的变化如图所示。
①溶液中溶质的物质的量浓度HA>HB; ②溶液中溶质的物质的量浓度HA<HB;
③开始反应时的速率HA>HB; ④开始反应时的速率HA=HB;
⑤HA溶液里有锌剩余; ⑥HB溶液里有锌剩余
(3)亚磷酸(
 )是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。
)是一种二元弱酸,可用作还原剂、尼龙增白剂、亚磷酸盐原料、农药中间体以及有机磷水处理药剂的原料。常温下,已知
 溶液中含磷粒子的浓度之和为
溶液中含磷粒子的浓度之和为 ,溶液中含磷粒子的物质的量分数(
,溶液中含磷粒子的物质的量分数( )与溶液pH的关系如图所示。
)与溶液pH的关系如图所示。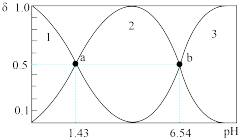
 溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为
溶液混合后得到的溶液呈(填“酸”或“碱”)性,溶液中离子浓度由大到小的排列顺序为(4)利用草酸(
 )及草酸盐的性质可测定人体血液中钙离子的浓度。
)及草酸盐的性质可测定人体血液中钙离子的浓度。某次实验抽取血样10.00mL,加适量的草酸铵
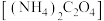 溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的
溶液,析出草酸钙沉淀,将此沉淀洗涤后溶于强酸得草酸,再用硫酸酸化的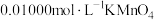 标准液平行滴定三次,平均消耗
标准液平行滴定三次,平均消耗 溶液12.00mL。
溶液12.00mL。相关离子方程式为:
 。
。①达到滴定终点的现象是
②血液样品中
 浓度为
浓度为 (保留4位有效数字)。
(保留4位有效数字)。③下列操作可使所测结果偏高的是
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
(5)常温下,向浓度为
 、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题: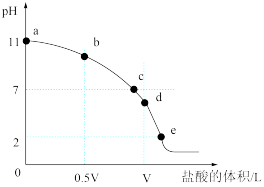
 的电离常数K=
的电离常数K=②比较b、c、d三点时的溶液中,由水电离出的
 由大到小顺序为
由大到小顺序为③根据以上滴定曲线判断下列说法正确的是
 和
和 两种形式)。
两种形式)。A.点b所示溶液中:
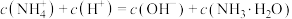
B.点c所示溶液中:

C.点d所示溶液中:
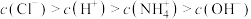
D.滴定过程中可能有:
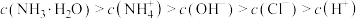
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.硫酸是重要的化工原料,我国主要采用接触法生产硫酸,主要过程如下:
(1)基态Fe原子核外未成对电子数为______ ,KSCN溶液是检验 的常用试剂,
的常用试剂, 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为______ 。
(2)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大
表示,其中m代表参与形成大键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为______ 。 分子中键角
分子中键角
______  中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
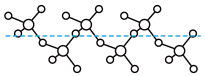
(3)固态 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是______ (填“桥氧”或“端基氧”)。
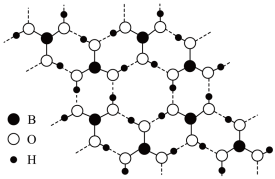
Ⅱ.硼酸( )是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
)是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
(4)一种硼酸盐的阴离子为 ,
, 结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出
结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出 的结构图(注明所带电荷数)
的结构图(注明所带电荷数)______ 。
(5)1mol 晶体中含有
晶体中含有______ mol氢键,请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:______ 。

(1)基态Fe原子核外未成对电子数为
 的常用试剂,
的常用试剂, 中含有的
中含有的 键与
键与 键的数目之比为
键的数目之比为(2)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大
表示,其中m代表参与形成大键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 中键角
中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(3)固态
 能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
能以无限长链形式存在(如图所示),长链结构中,连接2个S原子的O原子称为桥氧,连接1个S原子的O原子称为端基氧,则与S原子形成化学键键长更大的是
Ⅱ.硼酸(
 )是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
)是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
(4)一种硼酸盐的阴离子为
 ,
, 结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出
结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出 的结构图(注明所带电荷数)
的结构图(注明所带电荷数)(5)1mol
 晶体中含有
晶体中含有
您最近一年使用:0次
名校
解题方法
10 . I.铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,在化学上称为铁系元素,其化合物在生产生活中应用广泛。
(1)第四电离能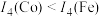 ,其原因是
,其原因是______ ;
(2)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是______
II.碳的多种同素异形体及一系列化合物广泛应用于科研、医疗、工农业生产等领域。钴单质及其化合物在生产、生活中有广泛应用。回答下列问题:

(3)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是______(填编号)。
(4)以甲醇为溶剂, 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中N原子的杂化类型有
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中N原子的杂化类型有______ 。
(5)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含Co原子数为______ ;晶胞底面呈正六边形,边长为apm,设 为阿伏加德罗常数的值,晶胞的密度
为阿伏加德罗常数的值,晶胞的密度 ,则该晶胞的高b为
,则该晶胞的高b为______ pm(列出计算式)。

(1)第四电离能
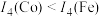 ,其原因是
,其原因是(2)Fe、Co、Ni与Ca都位于第四周期且最外层电子数相同,但相应单质的熔点,Fe、Co、Ni明显高于Ca,其原因是
II.碳的多种同素异形体及一系列化合物广泛应用于科研、医疗、工农业生产等领域。钴单质及其化合物在生产、生活中有广泛应用。回答下列问题:

(3)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是______(填编号)。
A. | B. | C. | D.苯 |
 可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中N原子的杂化类型有
可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示),色胺酮分子中N原子的杂化类型有(5)金属钴晶体的晶胞呈六棱柱形,其结构如图所示,每个晶胞中含Co原子数为
 为阿伏加德罗常数的值,晶胞的密度
为阿伏加德罗常数的值,晶胞的密度 ,则该晶胞的高b为
,则该晶胞的高b为
您最近一年使用:0次



