1 . 某兴趣小组对FeSO4的一些性质进行探究实验。回答下列问题:
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变_____ 色,说明样品已变质。同学甲认为若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,发生反应的离子方程式为______________ 。
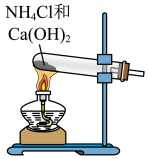
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。________________ 。
②装置C中盛放的溶液为________ ;装置D中盛放的溶液为________ (填标号)。
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是_____________ 。
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为_____________ 。
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。

②装置C中盛放的溶液为
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为
您最近一年使用:0次
2 . 合成氨是人类科学技术发展史上的一项重大成就。实验室利用如右图所示装置及药品制取氨气:_____________ 。
(2)下列装置中,可用于收集氨的是_________ (填标号)。______________ 。
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g) 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
①2min内该反应的平均反应速率v(N2)=______ mol/(L·min)
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为____________ mol/L。
③能说明该反应已经达到平衡状态的是____________ 。
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为_____ 。
(2)下列装置中,可用于收集氨的是
a. 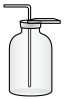 b.
b. 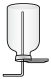 c.
c. 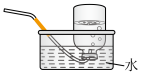
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g)
 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:①2min内该反应的平均反应速率v(N2)=
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为
③能说明该反应已经达到平衡状态的是
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 材料是人类赖以生存和发展的基础,下列有关说法错误的是
| A.传统的无机非金属材料多为硅酸盐材料 |
| B.高纯硅广泛应用于信息技术和新能源技术领域 |
| C.碳纳米材料在信息,医药等领域有广阔应用前景 |
| D.SiC因含有离子键而具有优异的高温抗氧化性能 |
您最近一年使用:0次
4 . 柳州市博物馆是我市的文化名片。下列有关展品主要成分为合金的是
A.兽骨 | B.青铜器 |
C.纸张 | D.青花瓷 |
您最近一年使用:0次
解题方法
5 . 下列有关物质结构和性质的说法错误的是
A. 晶体中存在 晶体中存在 与 与 之间的离子键,为强烈相互作用 之间的离子键,为强烈相互作用 |
B.依据价层电子对互斥理论预测, 的空间结构为三角锥形 的空间结构为三角锥形 |
| C.液氧和煤油可做火箭推进剂,液氧分子间靠范德华力凝聚在一起 |
D.NaCl(800.7℃)的熔点远高于 (-68.8℃),原因是两者晶体类型不同 (-68.8℃),原因是两者晶体类型不同 |
您最近一年使用:0次
2024-04-30更新
|
447次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
名校
6 . 某单质A经下图所示过程可转化为D,D为强酸或强碱,则单质A不可能为
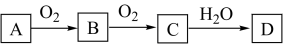
| A.N2 | B.Na | C.C | D.S |
您最近一年使用:0次
7 . 关于元素及其化合物的性质,下列说法正确的是
A.浓硝酸有强氧化性,常温下铁与浓硝酸反应可制备 |
| B.浓硫酸具有吸水性,所以用浓硫酸在纸上书写的字迹变黑 |
C.氧化镁与盐酸反应得到氯化镁溶液,加热蒸干所得溶液得到无水 |
D.久置空气中的 溶液变浑浊且颜色变深,原因是 溶液变浑浊且颜色变深,原因是 被氧化为硫单质 被氧化为硫单质 |
您最近一年使用:0次
2024-04-16更新
|
362次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
解题方法
8 . 柳州是国家老工业基地。下列说法错误的是
| A.熟石灰具有碱性,可用熟石灰处理工业上的酸性废水 |
| B.柳州五菱汽车的废旧电池需要回收,一般是掩埋处理 |
| C.柳州钢铁厂车间生产钢铁,将炽热的钢水注入干燥的模具 |
| D.氨具有还原性,柳州化工厂通过氨的催化氧化等过程制硝酸 |
您最近一年使用:0次
2024-04-16更新
|
255次组卷
|
2卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
解题方法
9 . 将二氧化碳资源化是实现“碳中和”目标的重要手段。回答下列问题:
(1)利用 和重整技术可获得合成气(主要成分为CO和
和重整技术可获得合成气(主要成分为CO和 ),反应如下:
),反应如下:
I:

Ⅱ:
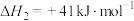
反应 的
的
___________  ,该反应活化能
,该反应活化能 (正)
(正)___________  (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
(2)二氧化碳催化加氢可合成乙醇,其反应原理为: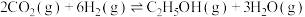 ,该反应的平衡常数与温度的关系如表。
,该反应的平衡常数与温度的关系如表。
①该反应为___________ 反应(填“吸热”或“放热”),在___________ 时可自发进行(填“高温”“低温”或“任意温度”)。
②恒容绝热容器中发生上述反应,下列说法正确的是___________ 。
A.加入合适的催化剂可以提高 的平衡转化率
的平衡转化率
B.反应达平衡后容器内温度保持不变
C.反应达平衡时 一定成立
一定成立
D.容器内气体密度不变时说明达到了平衡状态
③设m为起始时的投料比,即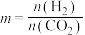 。通过实验得到图像如下:
。通过实验得到图像如下:___________ (填 、
、 或
或 ),理由是
),理由是___________ 。图乙表示在 ,起始压强为4 MPa的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系,
,起始压强为4 MPa的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应的压强平衡常数
温度时,该反应的压强平衡常数
___________ 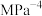 (用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
(1)利用
 和重整技术可获得合成气(主要成分为CO和
和重整技术可获得合成气(主要成分为CO和 ),反应如下:
),反应如下:I:


Ⅱ:

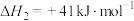
反应
 的
的
 ,该反应活化能
,该反应活化能 (正)
(正) (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。(2)二氧化碳催化加氢可合成乙醇,其反应原理为:
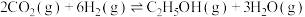 ,该反应的平衡常数与温度的关系如表。
,该反应的平衡常数与温度的关系如表。| 温度/K | 400 | 500 |
| 平衡常数/K | 9 | 5.3 |
②恒容绝热容器中发生上述反应,下列说法正确的是
A.加入合适的催化剂可以提高
 的平衡转化率
的平衡转化率B.反应达平衡后容器内温度保持不变
C.反应达平衡时
 一定成立
一定成立D.容器内气体密度不变时说明达到了平衡状态
③设m为起始时的投料比,即
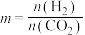 。通过实验得到图像如下:
。通过实验得到图像如下: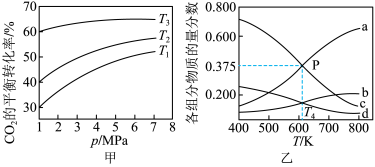
 、
、 或
或 ),理由是
),理由是 ,起始压强为4 MPa的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系,
,起始压强为4 MPa的恒容条件下,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应的压强平衡常数
温度时,该反应的压强平衡常数
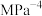 (用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
您最近一年使用:0次
2024-04-01更新
|
683次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
解题方法
10 . 氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色等。工业上常用辉铋矿(主要成分是 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。 在
在 时开始水解,
时开始水解,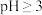 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;
②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为___________ 。
(2)“浸渣”的主要成分是S和___________ ,“浸取”时生成S的离子方程式为___________ 。
(3)“充分搅拌”时加入盐酸羟胺的目的是___________ 。
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为___________ ,发生反应的化学方程式为___________ 。
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是___________ 。
(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。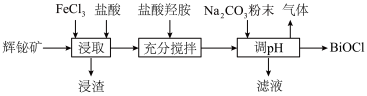
 在
在 时开始水解,
时开始水解,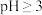 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
| 金属离子 |  |  |
| 开始沉淀的pH | 1.9 | 7.2 |
| 沉淀完全的pH | 2.9 | 8.2 |
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为
(2)“浸渣”的主要成分是S和
(3)“充分搅拌”时加入盐酸羟胺的目的是
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入
 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。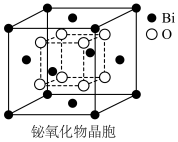
您最近一年使用:0次
2024-04-01更新
|
630次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)



