名校
解题方法
1 . 化学与生产、生活和社会息息相关,下列有关说法错误的是
| A.用于火箭发动机的碳化硅陶瓷是一种新型无机非金属材料 |
| B.载人飞船采用了太阳能刚性电池阵,将太阳能转化为电能供飞船使用 |
| C.运动员剧烈运动后,补充的运动饮料中含有糖类和一定浓度的NaCl、KCl等 |
| D.合成氨的反应塔与外加电源的正极相连,并维持一定的电压可以钝化防腐 |
您最近一年使用:0次
2024-06-02更新
|
90次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗县平罗中学高三下学期模拟预测理综试题-高中化学
名校
2 . 安立生坦是一种治疗肺动脉高血压药物,由芳香化合物A合成其中间体G的一种合成路线如下:
(1)A的化学名称是___________ ,由C生成D的反应类型是___________ 。
(2)D的结构简式是___________ ,F的结构简式是___________ 。
(3)B与NaOH溶液反应的化学方程式是___________ 。
(4)含有两个苯环的芳香化合物X是E的同分异构体,X中不含其他环状结构,X在酸性条件下水解只生成一种有机物,则X有___________ 种,其中核磁振氢谱有3组峰,峰面积之比为3:2:2的化合物的结构简式为___________ 。
(5)写出用甲烷和苯为原料制备化合物2,4,6-三硝基苯甲酸的合成路线:___________ (无机试剂任选)。

②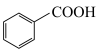
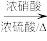
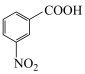
(1)A的化学名称是
(2)D的结构简式是
(3)B与NaOH溶液反应的化学方程式是
(4)含有两个苯环的芳香化合物X是E的同分异构体,X中不含其他环状结构,X在酸性条件下水解只生成一种有机物,则X有
(5)写出用甲烷和苯为原料制备化合物2,4,6-三硝基苯甲酸的合成路线:
您最近一年使用:0次
2024-06-02更新
|
441次组卷
|
4卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学河北省石家庄市河北正定中学2023-2024学年高三下学期4月模拟考试化学试题(已下线)江苏省南京师范大学附属中学2024届高三下学期5月模拟化学试题2024届江西省吉安市第一中学高三下学期三模化学试题
名校
解题方法
3 . Z是医药工业和香料工业的重要中间体,合成路线如图所示。下列说法正确的是
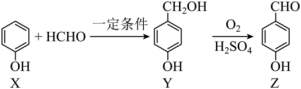
| A.X和Y互为同系物 |
| B.X→Y属于取代反应 |
| C.Y苯环上的一氯代物有2种 |
| D.1mol Z在一定条件下与H2反应,最多消耗3molH2 |
您最近一年使用:0次
名校
解题方法
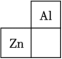
4 . 锌在工业中有重要作用,也是人体必需的微量元素。锌元素在周期表中的位置如图所示。___________ ,其核外电子共占据 ___________ 条轨道。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
(3)中医典籍中记载了炉甘石(ZnCO3)可用于治疗皮肤炎症或表面创伤。ZnCO3中,负离子的空间构型为 ___________ ,Zn、C、O的电负性由小到大的顺序是 ___________ 。
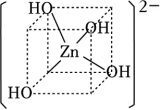
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供___________ ,Zn2+的杂化方式为 ___________ 。
解释ZnCl2与ZnBr2熔点存在差异的原因 ___________ 。
(6)ZnF2晶胞如图所示,一个晶胞中含有___________ 个F﹣。若NA表示阿伏加德罗常数的值,则ZnF2晶体(摩尔质量为M)的密度为 ___________ g•cm-3(用含a、c、M、NA的代数式表示)。
(2)自然界中共存在五种常见的锌的稳定同位素,其中丰度最高的核素含有34个中子,该核素可以表示为 ___________。
| A.34Zn | B.34Zn | C.64Zn | D.64Zn |
(4)锌的氢氧化物既能溶于强酸,又能溶于强碱。Zn(OH)2溶于强碱生成[Zn(OH)4]2﹣,结构如图所示。该微粒中OH﹣提供孤电子对,Zn2+提供
| 卤化锌 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 283 | 394 |
(6)ZnF2晶胞如图所示,一个晶胞中含有

您最近一年使用:0次
名校
解题方法
5 . 以“全氢电池”为电源直接电解氯化钠溶液制备 和HClO的装置如图所示(工作时,
和HClO的装置如图所示(工作时, 在双极膜界面处被催化解离成
在双极膜界面处被催化解离成 和
和 )。下列说法错误的是
)。下列说法错误的是
 和HClO的装置如图所示(工作时,
和HClO的装置如图所示(工作时, 在双极膜界面处被催化解离成
在双极膜界面处被催化解离成 和
和 )。下列说法错误的是
)。下列说法错误的是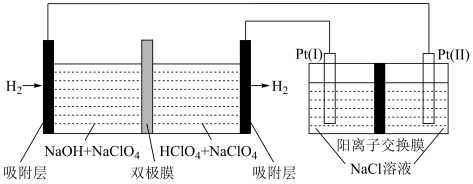
A.“全氢电池”的总反应为 |
B.“全氢电池”的双极膜中产生的 向右移动, 向右移动, 向左移动 向左移动 |
C.阳极区发生的电极反应为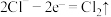 |
D.理论上负极消耗1mol  ,电解池阳极区减少1mol阳离子(忽略HClO的电离) ,电解池阳极区减少1mol阳离子(忽略HClO的电离) |
您最近一年使用:0次
2024-05-29更新
|
349次组卷
|
2卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
6 . 已知反应: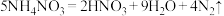 ,若
,若 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
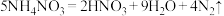 ,若
,若 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是A.生成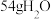 时,转移电子数目为 时,转移电子数目为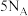 | B. 的 的 溶液中 溶液中 的数目为 的数目为 |
C.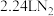 与 与 所含的电子数均为 所含的电子数均为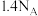 | D.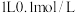 的 的 溶液中 溶液中 的数目为 的数目为 |
您最近一年使用:0次
2024-05-29更新
|
89次组卷
|
2卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
解题方法
7 . 随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应(DRM)可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为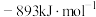 、
、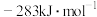 和
和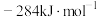 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:___________ 。
(2)甲烷干重整过程中可能存在反应:
R1: (主反应)
(主反应)
R2:
R3:
R4: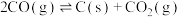
R5: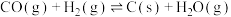
各反应的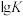 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。___________ (填“升高温度”或“降低温度”),简述判断的理由:___________ 。
(3)在 、进料配比
、进料配比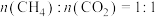 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。___________ ℃。
②在最佳温度、p条件下,向某2L的恒容密闭容器中加入2mol 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
___________ (保留两位有效数字,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压=物质的量分数×平衡总压强)。
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol 和1mol CO,发生反应
和1mol CO,发生反应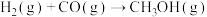 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。
___________  ;15min时改变的条件不可能是
;15min时改变的条件不可能是___________ (填标号)。
A.充入 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
 和
和 )直接转化为合成气(主要成分为CO和
)直接转化为合成气(主要成分为CO和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。(1)已知:
 、CO和
、CO和 的燃烧热(ΔH)分别为
的燃烧热(ΔH)分别为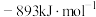 、
、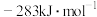 和
和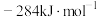 。写出甲烷干重整反应的热化学方程式:
。写出甲烷干重整反应的热化学方程式:(2)甲烷干重整过程中可能存在反应:
R1:
 (主反应)
(主反应)R2:

R3:

R4:
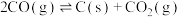
R5:
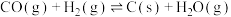
各反应的
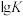 (K为各反应的平衡常数)与温度的关系如图所示。
(K为各反应的平衡常数)与温度的关系如图所示。
(3)在
 、进料配比
、进料配比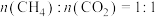 、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、
、温度为500~1000℃的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。
②在最佳温度、p条件下,向某2L的恒容密闭容器中加入2mol
 和2mol
和2mol  ,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4
,设只发生R1、R2两个反应。达平衡后,测得容器中CO的浓度为1.4 ,
, 的转化率为90%,则此时R1反应的压强平衡常数
的转化率为90%,则此时R1反应的压强平衡常数
(4)恒容绝热条件下仅发生主反应时,下列情况能说明该反应达到平衡状态的有___________(填标号)。
A. 和 和 的转化率相等 的转化率相等 | B.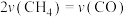 |
C. 的体积分数保持不变 的体积分数保持不变 | D.体系的温度不再变化 |
(5)合成气可以用于生成甲醇,在容积为2L的恒容密闭容器中加入2mol
 和1mol CO,发生反应
和1mol CO,发生反应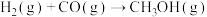 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。

 ;15min时改变的条件不可能是
;15min时改变的条件不可能是A.充入
 B.充入CO C.通入惰性气体
B.充入CO C.通入惰性气体
您最近一年使用:0次
2024-05-20更新
|
88次组卷
|
5卷引用:2024届宁夏石嘴山市第三中学高三下学期四模理综试题-高中化学
名校
解题方法
8 . 物质M转化为物质N的反应如图,下列叙述正确的是

| A.物质M与物质N互为同系物 | B.M中所有的原子可能在同一平面上 |
C.1mol N与碳酸钠反应得44g | D.M、N均能发生加成反应和取代反应 |
您最近一年使用:0次
2024-05-19更新
|
118次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
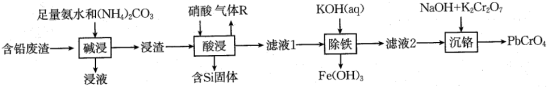
9 . 铬酸铅(PbCrO4)又称铬黄,是一种重要的黄色颜料,常用作橡胶、水彩、色纸的着色剂。以含铅废渣(主要成分是PbSO4和ZnO,还含Fe3O4、SiO2等)为原料制备铬酸铅的流程如下:
②常温下,几种难溶电解质的溶度积如下:
回答下列问题:
(1)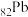 位于周期表第
位于周期表第___________ 周期___________ 族,PbCrO4中Cr的化合价为___________ 。
(2)“碱浸”中PbSO4转化反应的离子方程式为___________ 。
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为___________ 。
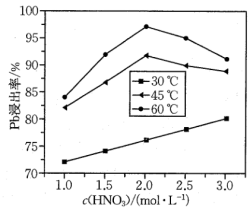
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为___________ 。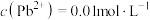 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为___________ 。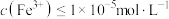 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。
(6)“沉铬”中生成PbCrO4反应的离子方程式为___________ 。
②常温下,几种难溶电解质的溶度积如下:
| 电解质 | PbCO3 | PbSO4 | PbCrO4 | Pb(OH)2 | Fe(OH)3 |
 | 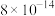 |  | 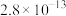 | 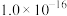 | 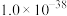 |
(1)
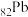 位于周期表第
位于周期表第(2)“碱浸”中PbSO4转化反应的离子方程式为
(3)已知:“酸浸”中6.3gHNO3作氧化剂时转移0.3mol电子。气体R在空气中的颜色变化为
(4)“酸浸”中铅元素浸出率与温度、硝酸浓度的关系如图所示。“酸浸”最佳条件为
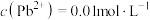 ,“除铁”中控制pH范围为
,“除铁”中控制pH范围为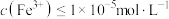 ,则表明Fe3+已完全沉淀。
,则表明Fe3+已完全沉淀。(6)“沉铬”中生成PbCrO4反应的离子方程式为
您最近一年使用:0次
2024-05-18更新
|
81次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学
名校
10 . X、Y、Z、W为原子序数依次增大且互不相邻的四种短周期主族元素,X为元素周期表中原子半径最小的元素,X与W同主族,Y、Z的最外层电子数之和与W的核外电子总数相等。下列说法错误的是
| A.简单离子半径:Z>W | B.仅由X、Y形成的化合物不止一种 |
| C.Y、Z的最高价氧化物对应的水化物均为弱酸 | D.化合物WZ为离子化合物 |
您最近一年使用:0次
2024-05-18更新
|
101次组卷
|
2卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期模拟预测理综试题-高中化学



