名校
解题方法
1 . 回答下列问题:
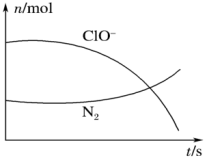
(1)某反应体系中有H2O、ClO-、NH 、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式_______ ,消耗1 mol还原剂,转移电子数为_______ 。
(2)Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是_______ ,相关反应的离子方程式是_______ 。
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,当有68 g NH3参加反应时,被氧化的物质为_______ ,生成的还原产物的质量为_______ g。
(4)K2FeO4(铁元素为+6价)可用作水处理剂,它可由以下反应制得,请配平下列离子方程式_____ 。
_______Cl2 + _______ Fe(OH)3+_______ OH- = _______ FeO + _______ Cl- +_______ H2O
+ _______ Cl- +_______ H2O
(1)某反应体系中有H2O、ClO-、NH
 、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,写出该反应的离子方程式
(2)Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,当有68 g NH3参加反应时,被氧化的物质为
(4)K2FeO4(铁元素为+6价)可用作水处理剂,它可由以下反应制得,请配平下列离子方程式
_______Cl2 + _______ Fe(OH)3+_______ OH- = _______ FeO
 + _______ Cl- +_______ H2O
+ _______ Cl- +_______ H2O
您最近一年使用:0次
名校
2 . 某催化剂主要含Ni、Ni(OH)2、NiS及少量Zn、Fe、CuO、CaO、SiO2等杂质,从中制备金属Ni的工艺流程如下:
回答下列问题:
(1)为提高废镍催化剂的浸出速率,可采取的措施有_____ (答一条即可)。
(2)反应 的平衡常数K=
的平衡常数K=_____ 。滤渣1的成分除CuS外还有_____ 。
(3)NaClO氧化 为
为 的离子方程式为
的离子方程式为_____ 。
(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是_____ 。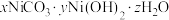 。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为
。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为_____ 。
(6)“分解”时通N2的作用是_____ 。
| 物质 | NiS | ZnS | CuS | FeS | CaF2 |
 (20℃) (20℃) |  |  |  |  |  |
(1)为提高废镍催化剂的浸出速率,可采取的措施有
(2)反应
 的平衡常数K=
的平衡常数K=(3)NaClO氧化
 为
为 的离子方程式为
的离子方程式为(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是
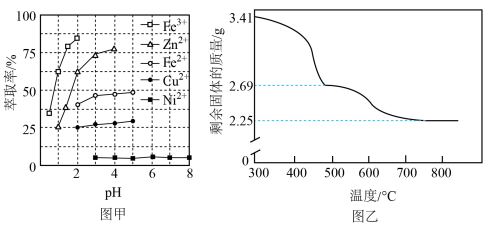
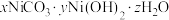 。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为
。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为(6)“分解”时通N2的作用是
您最近一年使用:0次
2023-09-25更新
|
598次组卷
|
4卷引用:2024届宁夏回族自治区石嘴山市平罗中学高三下学期三模理综试题-高中化学
名校
3 . KI可用作利尿剂、治疗慢性支气管炎,实验室中制备一定量KI的过程及实验装置(加热及夹持装置已省略)如下:
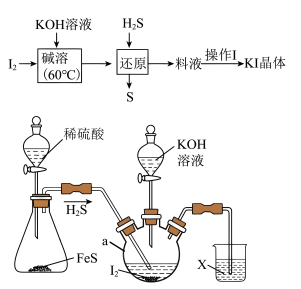
回答下列问题:
(1)仪器a的名称是___________ ,“碱溶”时,用水浴加热的优点是 ___________ 。
(2)“碱溶”时,碘发生歧化反应,氧化产物可用于加碘盐的生产中,则“碱溶”时氧化产物与还原产物的物质的量之比为___________ ,若“碱溶”时,KOH过量,通硫化氢时,写出“还原”时发生反应的离子方程式___________ 。
(3)烧杯中X不可以选用的试剂___________ 。(填标号)
a.NaOH b.CuSO4 c.KMnO4 d.硝酸
(4)为测定KI的纯度,称取0.5g 样品溶于水,然后用0. 0500mol·L-1的酸性KMnO4标准溶液滴定(10I- +2 +16H+ = 5I2+2Mn2+ +8H2O), 若滴定终点时平均消耗11. 80mL标准溶液,则样品的纯度为
+16H+ = 5I2+2Mn2+ +8H2O), 若滴定终点时平均消耗11. 80mL标准溶液,则样品的纯度为___________ (保留两位有效数字),若滴定终点读数时仰视刻度线,则测定KI纯度的结果___________ (填 “偏大”或“偏小”)。

回答下列问题:
(1)仪器a的名称是
(2)“碱溶”时,碘发生歧化反应,氧化产物可用于加碘盐的生产中,则“碱溶”时氧化产物与还原产物的物质的量之比为
(3)烧杯中X不可以选用的试剂
a.NaOH b.CuSO4 c.KMnO4 d.硝酸
(4)为测定KI的纯度,称取0.5g 样品溶于水,然后用0. 0500mol·L-1的酸性KMnO4标准溶液滴定(10I- +2
 +16H+ = 5I2+2Mn2+ +8H2O), 若滴定终点时平均消耗11. 80mL标准溶液,则样品的纯度为
+16H+ = 5I2+2Mn2+ +8H2O), 若滴定终点时平均消耗11. 80mL标准溶液,则样品的纯度为
您最近一年使用:0次
名校
解题方法
4 . 用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾[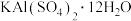 ]有如下两条途径。
]有如下两条途径。
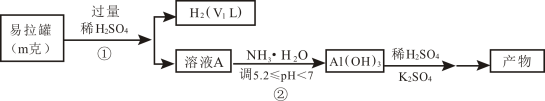
途径I
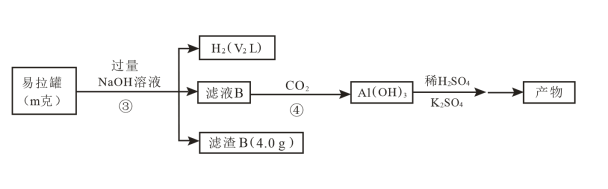
途径II
回答下列问题:
(1)Al元素在周期表中的位置为_______ 。
(2)溶液A中的金属离子有_______ 、_______ 、 。
。
(3)过程②生成 的离子方程式为
的离子方程式为_______ 。
(4)过程③发生反应的离子方程式为_______ 。
(5)下列关于产物的说法中,错误的是_______ (填标号)。
A.用KSCN溶液可以检验产物中是否含有
B.向明矾中加入 ,发生反应的离子方程式为
,发生反应的离子方程式为
C.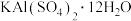 属于混合物
属于混合物
(6)途径II与途径I比较,优点有_______ (写出一点即可)。
(7)若V1与V2之差为2.24L(已折算成标准状况),则m克易拉罐样品中含Fe_______ g。
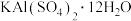 ]有如下两条途径。
]有如下两条途径。途径I

途径II

回答下列问题:
(1)Al元素在周期表中的位置为
(2)溶液A中的金属离子有
 。
。(3)过程②生成
 的离子方程式为
的离子方程式为(4)过程③发生反应的离子方程式为
(5)下列关于产物的说法中,错误的是
A.用KSCN溶液可以检验产物中是否含有

B.向明矾中加入
 ,发生反应的离子方程式为
,发生反应的离子方程式为
C.
 属于混合物
属于混合物(6)途径II与途径I比较,优点有
(7)若V1与V2之差为2.24L(已折算成标准状况),则m克易拉罐样品中含Fe
您最近一年使用:0次
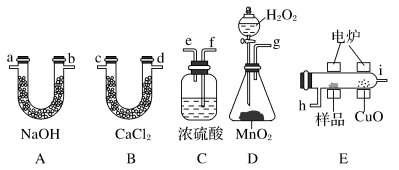
5 . 化学上常用燃烧法确定有机物的组成。这种方法是在电炉里加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图所列装置是用燃烧法确定有机物分子式常用的装置。
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是__ 。
(2)C装置中浓H2SO4的作用是___ 。
(3)D装置中MnO2的作用是__ 。
(4)燃烧管中CuO的作用是___ 。
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为___ 。
(6)要确定该有机物的分子式,还要___ 。

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
(6)要确定该有机物的分子式,还要
您最近一年使用:0次
2021-01-03更新
|
446次组卷
|
12卷引用:宁夏石嘴山市第三中学2019-2020学年高二10月月考化学试题
宁夏石嘴山市第三中学2019-2020学年高二10月月考化学试题(已下线)2011-2012年新疆乌鲁木齐市第八中学高一下学期期末考试化学卷2015-2016学年辽宁大连经济技术开发区得胜高中高二下期中化学试卷2018版化学(苏教版)高考总复习专题十二课时跟踪训练--认识有机化合物【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题3.2有机化合物结构的测定能力提升山西省朔州市怀仁县第一中学2018-2019学年高二下学期第二次月考化学试题天津市南开中学人教版高中化学选修5预习练习:第一章 第四节 研究有机化合物的一般步骤和方法 第2课时江西省南昌市新建区第二中学2020-2021学年高二上学期“新星计划”体验营10月考化学试题(已下线)1.4 研究有机化合物的一般步骤和方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)1.2 研究有机化合物的一般方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)1.2.2 确定有机化合物的实验式与分子结构-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)
名校
6 . A→J有如图所示的转化关系(反应条件、部分反应物和产物已忽略):其中A、D为银白色金属单质;B为淡黄色粉末,C为红棕色粉末,E为黑色晶体;H久置于空气中,由白色固体变为灰绿色,最终变成红褐色Ⅰ;B和I在一定条件下反应生成J,J的化学式为Na2FeO4,它能够杀菌消毒,是一种优良的净水剂。

(1)物质C的化学式___________ ;物质B的电子式为___________
(2)写出反应的化学反应方程式:⑤___________
(3)写出反应的离子方程式:⑦___________
(4)Na2FeO4还可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请书写离子方程式:____________ 。根据Na2FeO4元素的价态及反应前后的产物推测Na2FeO4杀菌消毒做净水剂的原因___________ 。
(5)可用滴定分析法测定Na2FeO4的纯度,已知: FeO +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3+OH-;2CrO
+Fe(OH)3+OH-;2CrO +2H+=Cr2O
+2H+=Cr2O +H2O ; Cr2O
+H2O ; Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
+6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
①上述样品中高铁酸钠的质量分数为___________ 。
② 若到达滴定终点时仰视读数,将导致所测定的样品质量分数___________ 。(偏大、偏小、不变)

(1)物质C的化学式
(2)写出反应的化学反应方程式:⑤
(3)写出反应的离子方程式:⑦
(4)Na2FeO4还可在碱性条件下,用NaClO氧化Fe(OH)3来制备,请书写离子方程式:
(5)可用滴定分析法测定Na2FeO4的纯度,已知: FeO
 +CrO
+CrO +2H2O=CrO
+2H2O=CrO +Fe(OH)3+OH-;2CrO
+Fe(OH)3+OH-;2CrO +2H+=Cr2O
+2H+=Cr2O +H2O ; Cr2O
+H2O ; Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:
+6Fe2++14H+=2Cr3++6Fe3++7H2O。现称量2.28g高铁酸钠粗样品溶解,加入足量KCrO2充分反应后过滤,将滤液定容于250mL容量瓶,每次取25mL定容后的溶液,加入稀硫酸进行酸化,再用0.100mol/L的(NH4)2Fe(SO4)2标准溶液滴定三次,每次消耗标准液的体积分别为28.36mL、29.98mL、30.02mL。则:①上述样品中高铁酸钠的质量分数为
② 若到达滴定终点时仰视读数,将导致所测定的样品质量分数
您最近一年使用:0次
7 . 某化学小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁(Fe2O3),并进行铁含量的测定。主要操作步骤如下:
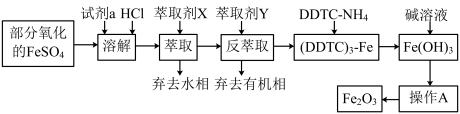
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH 。
。
请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式_________ 。
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的___ 放气;为提高萃取率和产品产量,实验时应进行的操作是__________ 。
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)____ 。
(4)操作A为_____ 、_____ 、______ 。产品处理时,温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图所示,则温度最好控制在______ ℃。

(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用______ (填仪器名称)移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定,消耗K2Cr2O7溶液20.60mL。产品中铁的含量为______ (假设杂质不与K2Cr2O7反应)。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH
 。
。请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)
(4)操作A为

(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用
您最近一年使用:0次
2020-07-28更新
|
390次组卷
|
6卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
8 . 钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
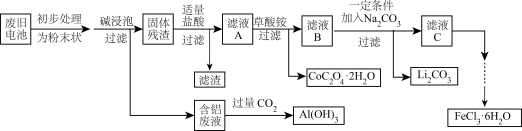
已知:①还原性:Cl->Co2+;
②Fe3+和 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________ 。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________ (填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______ (填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。

已知:①还原性:Cl->Co2+;
②Fe3+和
 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:(1)废旧电池初步处理为粉末状的目的是
(2)从含铝废液得到Al(OH)3的离子方程式为
(3)滤液A中的溶质除HCl、LiCl外还有
(4)滤渣的主要成分为
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
| Ⅱ | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
您最近一年使用:0次
2020-03-27更新
|
783次组卷
|
5卷引用:宁夏石嘴山市第三中学2020届高三一模考试理综化学试题
9 . 实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)在该反应中,HCl表现的性质有______ 、________ .
①MnO2 +4HCl(浓) Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为________ (填化学式),被氧化物质的物质的量为 _____ ,同时转移电子数为_____ (用NA表示)。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_________ ,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______ 。
(4)②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____ 。
(5)已知反应4HCl(g)+O2 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______ 。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______ 。
(1)在该反应中,HCl表现的性质有
①MnO2 +4HCl(浓)
 Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O (2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为
(4)②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为
(5)已知反应4HCl(g)+O2
 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为
您最近一年使用:0次
名校
解题方法
10 . 焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________ ;CO2中所含共价键的类型_____________ 。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。_______________ 。
(3)SO2 与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________________ ,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________________ 。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+H2SO4,该反应中,氧化产物是______ ;若反应中转移了0.04mol的电子,有________ g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。
为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为__________ (杂质不参与反应)。(保留至0.1%)
(6)“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。请写出金属钒与浓硝酸反应的离子方程式:_______________________________________ 。
(7)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:__________ 、_________ 。
(1)碳原子的原子结构示意图是
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。
(3)SO2 与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+H2SO4,该反应中,氧化产物是
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。
为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为
(6)“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。请写出金属钒与浓硝酸反应的离子方程式:
(7)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:
您最近一年使用:0次



