1 . 燃料气主要成分为CO和 ,利用燃料气合成甲烷反应原理为
,利用燃料气合成甲烷反应原理为 。回答下列问题:
。回答下列问题:
(1)已知: 、CO、
、CO、 的燃烧热分别为
的燃烧热分别为 、
、 、
、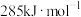 ,则反应
,则反应 的
的
_______ 。
(2)在恒容容器中充入 、2molCO,分别在催化剂M、N作用下发生反应
、2molCO,分别在催化剂M、N作用下发生反应 ,氢气体积分数与反应时间和温度变化关系如图所示:
,氢气体积分数与反应时间和温度变化关系如图所示:
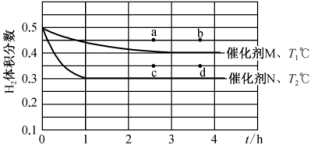
①据图判断,
_______ (填“>”“<”或“=”) ,催化剂催化效果:M
,催化剂催化效果:M_______ (填“强于”或“弱于”)N。
②在温度 ℃下,若在恒压容器中充入4mol
℃下,若在恒压容器中充入4mol 、4molCO,则刚达到平衡时
、4molCO,则刚达到平衡时 体积分数符合上图中的
体积分数符合上图中的_______ (填“a”“b”“c”或“d”)点。
(3)在温度T℃下,向恒容反应器中加入等物质的量的 和
和 发生反应
发生反应 ,开始时总压为72kPa,研究表明
,开始时总压为72kPa,研究表明 的生成速率
的生成速率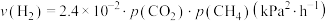 ,某时刻反应处于平衡状态,测得该温度下,
,某时刻反应处于平衡状态,测得该温度下, ,则该时刻
,则该时刻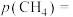
_______ kPa,
_______ 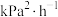 ;该温度下,该反应的化学平衡常数
;该温度下,该反应的化学平衡常数
_______  (列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
(列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
 ,利用燃料气合成甲烷反应原理为
,利用燃料气合成甲烷反应原理为 。回答下列问题:
。回答下列问题:(1)已知:
 、CO、
、CO、 的燃烧热分别为
的燃烧热分别为 、
、 、
、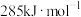 ,则反应
,则反应 的
的
(2)在恒容容器中充入
 、2molCO,分别在催化剂M、N作用下发生反应
、2molCO,分别在催化剂M、N作用下发生反应 ,氢气体积分数与反应时间和温度变化关系如图所示:
,氢气体积分数与反应时间和温度变化关系如图所示:
①据图判断,

 ,催化剂催化效果:M
,催化剂催化效果:M②在温度
 ℃下,若在恒压容器中充入4mol
℃下,若在恒压容器中充入4mol 、4molCO,则刚达到平衡时
、4molCO,则刚达到平衡时 体积分数符合上图中的
体积分数符合上图中的(3)在温度T℃下,向恒容反应器中加入等物质的量的
 和
和 发生反应
发生反应 ,开始时总压为72kPa,研究表明
,开始时总压为72kPa,研究表明 的生成速率
的生成速率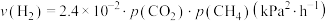 ,某时刻反应处于平衡状态,测得该温度下,
,某时刻反应处于平衡状态,测得该温度下, ,则该时刻
,则该时刻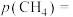

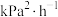 ;该温度下,该反应的化学平衡常数
;该温度下,该反应的化学平衡常数
 (列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
(列出表达式,平衡分压代替平衡浓度计算,分压-总压×物质的量分数),
您最近一年使用:0次
名校
2 . 联苄(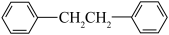 )是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度
)是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度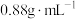 )和1,2-二氯乙烷(
)和1,2-二氯乙烷(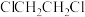 ,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
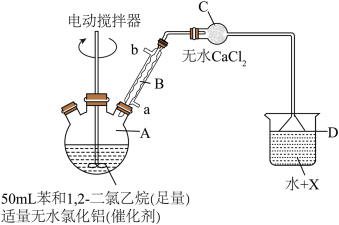
实验过程:将无水氯化铝、苯、1,2-二氯乙烷依次加入仪器A中,开动电动搅拌器将试剂混合,水浴加热(60~65℃)装置A约1h,将装置A中液态混合物,通过“一系列”操作后得到44g联苄。
回答下列问题:
(1)仪器B的名称是_______ ,若蒸馏水从b口进入,则从原料利用角度分析,导致的结果是_______ 。
(2)仪器C的作用是_______ ,若实验结束时烧杯中的液体变红,则试剂X可能是_______ 。
(3)“一系列”操作包括用稀盐酸洗涤→…→用无水硫酸镁处理→蒸馏。用稀盐酸洗涤的具体操作为_______ ,用硫酸镁处理后的操作是_______ ,蒸馏的目的是_______ 。
(4)该实验中联苯的产率为_______ (保留三位有效数字)。
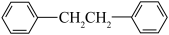 )是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度
)是合成某类抗肿瘤药物的中间体,其熔点为52℃,沸点为284℃,易溶于氯仿、醚,不溶于水。实验室以苯(沸点80.1℃、密度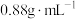 )和1,2-二氯乙烷(
)和1,2-二氯乙烷(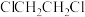 ,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
,熔点-35.3℃、沸点83.5℃,不溶于水)为原料,利用如图所示装置(加热及夹持装置已省略)可制得联苄。
实验过程:将无水氯化铝、苯、1,2-二氯乙烷依次加入仪器A中,开动电动搅拌器将试剂混合,水浴加热(60~65℃)装置A约1h,将装置A中液态混合物,通过“一系列”操作后得到44g联苄。
回答下列问题:
(1)仪器B的名称是
(2)仪器C的作用是
(3)“一系列”操作包括用稀盐酸洗涤→…→用无水硫酸镁处理→蒸馏。用稀盐酸洗涤的具体操作为
(4)该实验中联苯的产率为
您最近一年使用:0次
2022-07-06更新
|
300次组卷
|
2卷引用:湖北省鄂州市2021-2022学年高二下学期期末质量监测化学试题
3 . 一种由芳香烃A制备H的合成路线如图所示:
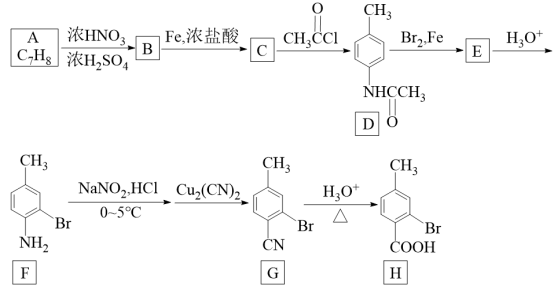
已知: ,其中R为烃基。
,其中R为烃基。
回答下列问题:
(1)A的化学名称为_______ ;A→B的反应类型为_______ 。
(2)C的结构简式为_______ ;D中含氧官能团名称为_______ 。
(3)写出D→E的化学方程式:_______ 。
(4)符合下列条件的H的同分异构体的结构简式有_______ 种(不含立体异构)。
①在酸性条件下能发生水解反应 ②能发生银镜反应 ③苯环上有两种取代基
(5)已知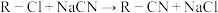 。设计以A为原料制备苯乙酸的合成路线:
。设计以A为原料制备苯乙酸的合成路线:_______ (其他无机试剂任用)。

已知:
 ,其中R为烃基。
,其中R为烃基。回答下列问题:
(1)A的化学名称为
(2)C的结构简式为
(3)写出D→E的化学方程式:
(4)符合下列条件的H的同分异构体的结构简式有
①在酸性条件下能发生水解反应 ②能发生银镜反应 ③苯环上有两种取代基
(5)已知
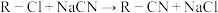 。设计以A为原料制备苯乙酸的合成路线:
。设计以A为原料制备苯乙酸的合成路线:
您最近一年使用:0次
4 . I.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂,对臭氧层无破坏作用。
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H=—90.8kJ/mol
CH3OH(g) △H=—90.8kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=—41.3kJ/mol
CO2(g)+H2(g) △H=—41.3kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H =
CH3OCH3(g)+CO2(g)的△H =___________ ,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的平衡转化率,下列选项中可以采取的措施是:___________ 。(填序号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
(2)已知上述(1)中反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
①比较此时正、逆反应速率的大小:v正___________ v逆(填“>”、“<”或“=”)。
②若在此密闭容器中开始加入21molCH3OH,则达到平衡时c(CH3OH)=___________ ;
II.工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为:
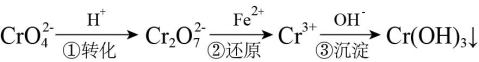
(3)流程第①步存在平衡:2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,能说明第①步反应达平衡状态的是
+H2O,能说明第①步反应达平衡状态的是____ (填序号)
A.Cr2O 和CrO
和CrO 的浓度相同 B.2v(Cr2O
的浓度相同 B.2v(Cr2O )=v(CrO
)=v(CrO ) C.溶液的颜色不变
) C.溶液的颜色不变
(4)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为
Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为_____ 。
方法2:电解法
(5)该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是_____ 。
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g) △H=—90.8kJ/mol
CH3OH(g) △H=—90.8kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=—23.5kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H=—41.3kJ/mol
CO2(g)+H2(g) △H=—41.3kJ/mol总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的△H =
CH3OCH3(g)+CO2(g)的△H =a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.分离出二甲醚
(2)已知上述(1)中反应②2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为100,此温度下在10L密闭容器中加入CH3OH,反应到某时刻测得容器中各组分的物质的量如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/(mol) | 4.0 | 6.0 | 6.0 |
②若在此密闭容器中开始加入21molCH3OH,则达到平衡时c(CH3OH)=
II.工业废水中常含有一定量的Cr2O
 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。方法1:还原沉淀法。该法的工艺流程为:

(3)流程第①步存在平衡:2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,能说明第①步反应达平衡状态的是
+H2O,能说明第①步反应达平衡状态的是A.Cr2O
 和CrO
和CrO 的浓度相同 B.2v(Cr2O
的浓度相同 B.2v(Cr2O )=v(CrO
)=v(CrO ) C.溶液的颜色不变
) C.溶液的颜色不变(4)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为
Cr3+(aq)+3OH—(aq)常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为方法2:电解法
(5)该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释阴极附近溶液pH升高的原因是
您最近一年使用:0次
解题方法
5 . I.已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)______ 。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为______ (填序号)。
(3)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN—),下列关系正确的是___ 。
a.c(H+)<c(OH—) b.c(H+)+c(HCN)=c(OH—)+c(CN—) c.c(HCN)+c(CN—)=0.01mol/L
(4)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为____ 。
II.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。含氰废水中的氰化物常以[Fe(CN)6]3—和CN—的形式存在,工业上有多种废水处理方法。其中电解处理法如图:

(5)用如图所示装置处理含CN—废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO—将CN—氧化为无害物质而除去。铁电极为_____ (填“阴极”或“阳极”),阳极产生的ClO—的电极反应为____ ,阳极产生的ClO—将CN—氧化为无害物质而除去的离子方程式为____ 。
| 醋酸 | 氢硫酸 | 氢氰酸 |
| Ka=1.8×10-5 | Ka1=9.1×10-8、Ka2=1.1×10-12 | Ka=4.9×10-10 |
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN—),下列关系正确的是
a.c(H+)<c(OH—) b.c(H+)+c(HCN)=c(OH—)+c(CN—) c.c(HCN)+c(CN—)=0.01mol/L
(4)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为
II.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。含氰废水中的氰化物常以[Fe(CN)6]3—和CN—的形式存在,工业上有多种废水处理方法。其中电解处理法如图:

(5)用如图所示装置处理含CN—废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO—将CN—氧化为无害物质而除去。铁电极为
您最近一年使用:0次
6 . 有机化学实验中,常用甲醛与盐酸作为氯甲基(-CH2Cl)化试剂。以下是一种新型有效、副作用小的镇痛消炎药J的合成路线:

(1)若要确定F分子中氢原子的种类,可用下列的___________ 测定(填选项)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(2)上述A→J的有机物中,含有手性碳原子的分子 有___________ 种。
(3)反应①化学方程式为___________ ;已知吡啶(C5H5N)分子含有六元环,吡啶的分子结构类似于苯。则反应⑧使用吡啶的理由___________ 。
(4)由I生成J,中间需要经过两步反应。
第1步:在酸性条件下加热水解,生成有机物y;
第2步:在水溶液里y与固体NaHCO3反应,经过一系列操作可得结晶水合物J。
则由I生成y的化学方程式是___________ 。
(5)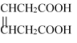 是合成
是合成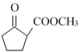 的重要中间体。参照上述题中的合成路线,请你设计由1,3-丁二烯合成
的重要中间体。参照上述题中的合成路线,请你设计由1,3-丁二烯合成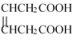 的一种合成路线(无机试剂任选):
的一种合成路线(无机试剂任选):___________

(1)若要确定F分子中氢原子的种类,可用下列的
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(2)上述A→J的有机物中,含有手性碳原子的
(3)反应①化学方程式为
(4)由I生成J,中间需要经过两步反应。
第1步:在酸性条件下加热水解,生成有机物y;
第2步:在水溶液里y与固体NaHCO3反应,经过一系列操作可得结晶水合物J。
则由I生成y的化学方程式是
(5)
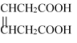 是合成
是合成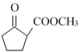 的重要中间体。参照上述题中的合成路线,请你设计由1,3-丁二烯合成
的重要中间体。参照上述题中的合成路线,请你设计由1,3-丁二烯合成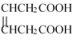 的一种合成路线(无机试剂任选):
的一种合成路线(无机试剂任选):
您最近一年使用:0次
名校
解题方法
7 . 废旧铅蓄电池会导致铅污染,国内外对废蓄电池的湿法处理进行了广泛研究,RSR工艺回收铅是其成果之一。具体化工流程如下:
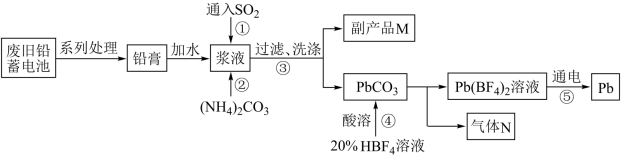
已知:Ⅰ.铅膏主要成分是 、
、 ;
;
Ⅱ. 是强酸;
是强酸;
Ⅲ.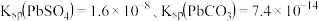 。
。
回答下列问题:
(1)写出步骤①反应的化学方程式_______ 。
(2)写出副产品M的一种用途_______ 。
(3)步骤②中存在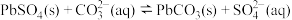 平衡,该反应平衡常数
平衡,该反应平衡常数
_______ 。检验 固体是否洗涤干净的操作是
固体是否洗涤干净的操作是_______ 。
(4)步骤④加入 时边加边搅拌的目的是
时边加边搅拌的目的是_______ 。
(5)步骤⑤电解 溶液时,阴极反应式为
溶液时,阴极反应式为_______ ,阳极产生单质气体,分子式为_______ 。整个流程中,可以循环使用的物质化学式为_______ 。
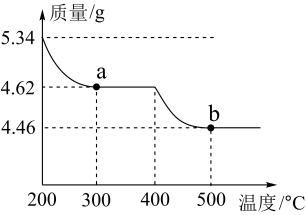
(6)已知焙烧 可制得铅的氧化物,为了研究其产物成分取
可制得铅的氧化物,为了研究其产物成分取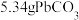 进行焙烧,其热重曲线如图所示,请写出500℃时所得铅的氧化物的化学式
进行焙烧,其热重曲线如图所示,请写出500℃时所得铅的氧化物的化学式_______ 。

已知:Ⅰ.铅膏主要成分是
 、
、 ;
;Ⅱ.
 是强酸;
是强酸;Ⅲ.
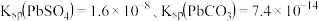 。
。回答下列问题:
(1)写出步骤①反应的化学方程式
(2)写出副产品M的一种用途
(3)步骤②中存在
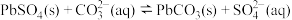 平衡,该反应平衡常数
平衡,该反应平衡常数
 固体是否洗涤干净的操作是
固体是否洗涤干净的操作是(4)步骤④加入
 时边加边搅拌的目的是
时边加边搅拌的目的是(5)步骤⑤电解
 溶液时,阴极反应式为
溶液时,阴极反应式为(6)已知焙烧
 可制得铅的氧化物,为了研究其产物成分取
可制得铅的氧化物,为了研究其产物成分取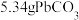 进行焙烧,其热重曲线如图所示,请写出500℃时所得铅的氧化物的化学式
进行焙烧,其热重曲线如图所示,请写出500℃时所得铅的氧化物的化学式
您最近一年使用:0次
2021-04-16更新
|
509次组卷
|
2卷引用:湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题
名校
解题方法
8 . 实验室模拟工业制备硫氰化钾的实验装置如下图所示(部分夹持装置已略去):

已知: 是密度比水大且不溶于水的液体,
是密度比水大且不溶于水的液体, 不溶于
不溶于 。在一定条件下发生反应:
。在一定条件下发生反应: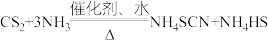 ,生成物中
,生成物中 的热稳定性较
的热稳定性较 差。请回答下列问题:
差。请回答下列问题:
(1)装置A中恒压滴液漏斗中的试剂是_______ 。
(2)三颈烧瓶内盛放有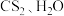 和固体催化剂,进气导管口插入下层
和固体催化剂,进气导管口插入下层 液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中
液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中 的生成速率,则X的化学式为
的生成速率,则X的化学式为_______ 。
(3)反应一段时间后,关闭 ,保持三颈烧瓶内液体温度
,保持三颈烧瓶内液体温度 ℃一段时间,其目的是
℃一段时间,其目的是_______ ;然后打开 ,继续保持液温
,继续保持液温 ℃,缓缓滴入适量的
℃,缓缓滴入适量的 溶液,制得较纯净的KSCN溶液,该反应的化学方程式为
溶液,制得较纯净的KSCN溶液,该反应的化学方程式为_______ 。
(4)装置E吸收尾气,防止污染环境,其中吸收 生成无色无味气体的离子方程式为
生成无色无味气体的离子方程式为_______ 。
(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、降温结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
测定晶体中KSCN的含量:称取 样品,配成
样品,配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴_______ 溶液(填化学式)作指示剂,用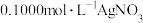 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。该晶体中
。该晶体中 的质量分数为
的质量分数为_______ 。[已知:滴定时发生的反应: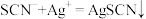 (白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数
(白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数_______ 。(选填“偏大”、“偏小”或“无影响”)

已知:
 是密度比水大且不溶于水的液体,
是密度比水大且不溶于水的液体, 不溶于
不溶于 。在一定条件下发生反应:
。在一定条件下发生反应: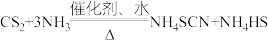 ,生成物中
,生成物中 的热稳定性较
的热稳定性较 差。请回答下列问题:
差。请回答下列问题:(1)装置A中恒压滴液漏斗中的试剂是
(2)三颈烧瓶内盛放有
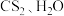 和固体催化剂,进气导管口插入下层
和固体催化剂,进气导管口插入下层 液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中
液体中,该反应比较缓慢,实验中可通过观察C中现象来控制A中 的生成速率,则X的化学式为
的生成速率,则X的化学式为(3)反应一段时间后,关闭
 ,保持三颈烧瓶内液体温度
,保持三颈烧瓶内液体温度 ℃一段时间,其目的是
℃一段时间,其目的是 ,继续保持液温
,继续保持液温 ℃,缓缓滴入适量的
℃,缓缓滴入适量的 溶液,制得较纯净的KSCN溶液,该反应的化学方程式为
溶液,制得较纯净的KSCN溶液,该反应的化学方程式为(4)装置E吸收尾气,防止污染环境,其中吸收
 生成无色无味气体的离子方程式为
生成无色无味气体的离子方程式为(5)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、降温结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
测定晶体中KSCN的含量:称取
 样品,配成
样品,配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴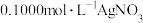 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。该晶体中
。该晶体中 的质量分数为
的质量分数为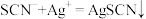 (白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数
(白色)]。滴定达到终点后,发现滴定管尖嘴部分有悬滴,则KSCN的质量分数
您最近一年使用:0次
2021-04-16更新
|
480次组卷
|
3卷引用:湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题
湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)01(含考试版、答题卡、参考答案、全解全析)吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期第三次摸底测试化学试题
解题方法
9 . 下列有关说法不正确的是
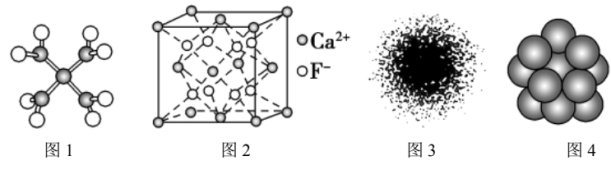

| A.四水合铜离子的模型如图1所示,1个四水合铜离子中有4个配位键 |
B. 晶体的晶胞如图2所示,设 晶体的晶胞如图2所示,设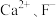 半径分别为 半径分别为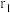 和 和 ,晶胞边长为a,则有 ,晶胞边长为a,则有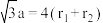 |
| C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 |
| D.金属Cu中原子堆积模型如图4所示,为最密堆积,Cu原子的配位数为12 |
您最近一年使用:0次
2021-04-16更新
|
760次组卷
|
3卷引用:湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题
湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题(已下线)难点9 晶胞的相关计算-2021年高考化学【热点·重点·难点】专练(山东专用)第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题
名校
解题方法
10 . 图中是利用垃圾假单胞菌株分解有机物的电化学原理图。下列说法不正确的是
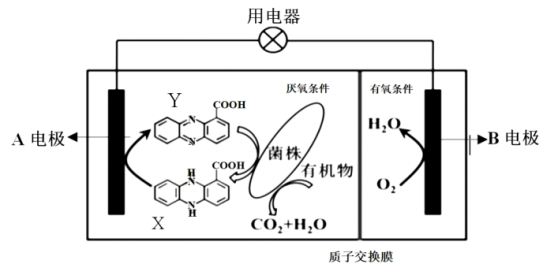

| A.该电池不能在高温下工作 |
| B.A、B均可用石墨作电极 |
C.A电极上发生氧化反应,电极反应式为: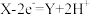 |
D.若有机物为葡萄糖,每处理 葡萄糖有 葡萄糖有 透过质子交换膜移动到右室 透过质子交换膜移动到右室 |
您最近一年使用:0次
2021-04-16更新
|
1095次组卷
|
4卷引用:湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题
湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)01(含考试版、答题卡、参考答案、全解全析)(已下线)【浙江新东方】高中化学20210621-010【2021】【高三下】吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期第三次摸底测试化学试题



