名校
解题方法
1 . 某同学在实验室模拟工业制备H2SO4,再用制得的浓H2SO4制备C2H4气体,并设计实验检验气体产物。
Ⅰ.制备H2SO4的重要一步是制SO3(熔点:16.8℃,沸点:44.8℃)
某同学在实验室中根据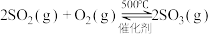 ,设计如图1所示实验装置来制备SO3固体。回答下列问题:
,设计如图1所示实验装置来制备SO3固体。回答下列问题:______ ;A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是____________________ 。
②装置D盛放的是______ 溶液,其作用是____________________ 。
③实验开始时的操作顺序为______ 。(选填“a”或“b”)
a.先点燃E处的酒精灯后将混合气体通入E。
b.先将混合气体通入E后点燃E处的酒精灯。
Ⅱ.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:____________________ 。操作中应迅速升温至______ ℃。
(3)反应前在②中放入几块碎瓷片的目的是____________________ 。
Ⅲ.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是______ (填序号),原因是____________________ 。
Ⅰ.制备H2SO4的重要一步是制SO3(熔点:16.8℃,沸点:44.8℃)
某同学在实验室中根据
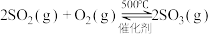 ,设计如图1所示实验装置来制备SO3固体。回答下列问题:
,设计如图1所示实验装置来制备SO3固体。回答下列问题: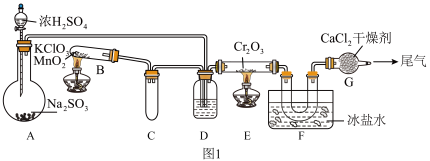
②装置D盛放的是
③实验开始时的操作顺序为
a.先点燃E处的酒精灯后将混合气体通入E。
b.先将混合气体通入E后点燃E处的酒精灯。
Ⅱ.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:

(3)反应前在②中放入几块碎瓷片的目的是
Ⅲ.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙烯 |
② | 澄清 | 变浑浊 | 产物含有CO2 |
③ | 通过品红溶液 | 红色褪去 | 产物含有SO2 |
您最近一年使用:0次
名校
2 . 回答下列问题
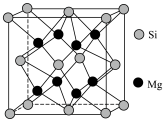
(1)基态Cu的价电子排布式为______ 。 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为______ ,配体为______ ,配位体所含元素中,电负性最大的是______ ,第一电离能最大的元素是______ 。
(2) 中心原子的价层电子对数目为
中心原子的价层电子对数目为______ ;叠氮酸根 的几何构型为
的几何构型为______ 。
(3)对羟基苯甲醛( )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是______ 。
(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):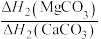
______ 1(选填“>”、“<”或“=”,下同);
②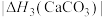
______ 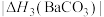 。
。
(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长:
______  (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是______ 。______ 。
②阿伏加德罗常数的值为 ,该晶体的摩尔体积为
,该晶体的摩尔体积为______  (列出计算式)。
(列出计算式)。
(1)基态Cu的价电子排布式为
 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为(2)
 中心原子的价层电子对数目为
中心原子的价层电子对数目为 的几何构型为
的几何构型为(3)对羟基苯甲醛(
 )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):

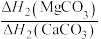
②
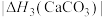
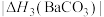 。
。(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长:
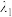
 (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是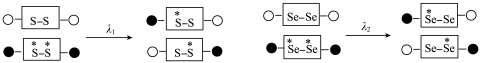
②阿伏加德罗常数的值为
 ,该晶体的摩尔体积为
,该晶体的摩尔体积为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
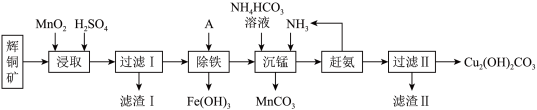
3 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图。
②
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______ 。(任写一种),除铁时溶液的pH值调控范围为:______ 。
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:____________________ 。
(3)常温下“除铁”时加入的试剂A可用______ ,若加A后溶液的pH调为5,则溶液中 的浓度为
的浓度为______  。
。
(4)沉锰的离子方程式为:____________________ 。滤液Ⅱ经蒸发结晶得到的盐主要是______ 。(写化学式)
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是______ 。
金属离子 |
|
|
|
|
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |

(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:
(3)常温下“除铁”时加入的试剂A可用
 的浓度为
的浓度为 。
。(4)沉锰的离子方程式为:
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
名校
4 . 利用CH4与CO2进行催化重整,对温室气体的减排具有重要意义,催化重整时发生的反应: ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
(1)已知: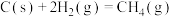
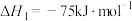

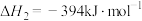
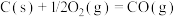
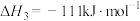
催化重整反应 的
的
______  。
。
(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为______ ;用H2表示的反应速率为______  。
。
(3)已知:常温下CH3COOH的电离常数 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、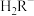 、
、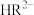 、
、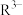 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显______ 性(选填“酸”或“碱”或“中”),常温下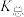 的数量级为
的数量级为______ 。 (
( 、
、 、
、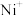 等)与O3反应可得
等)与O3反应可得 。
。 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: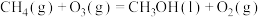 ;
;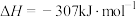 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应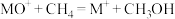 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是______ (填“a”或“b”)。300K、60 s时 的转化率为
的转化率为______ (列出算式)。 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(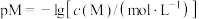 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
______ 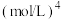 。
。
 ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:(1)已知:
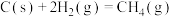
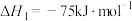

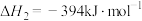
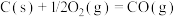
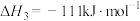
催化重整反应
 的
的
 。
。(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生
 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为 。
。(3)已知:常温下CH3COOH的电离常数
 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、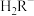 、
、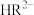 、
、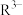 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显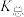 的数量级为
的数量级为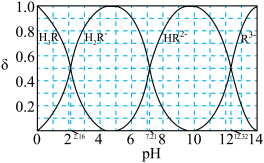
 (
( 、
、 、
、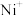 等)与O3反应可得
等)与O3反应可得 。
。 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: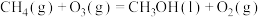 ;
;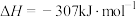 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应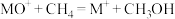 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是 的转化率为
的转化率为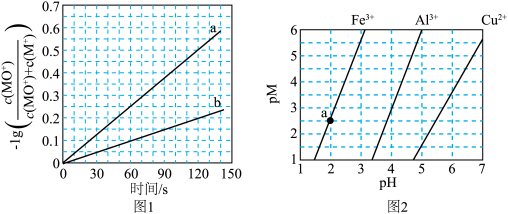
 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(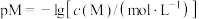 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
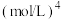 。
。
您最近一年使用:0次
5 . 研究碳氧化合物、氮氧化合物、硫氧化合物的处理对缓解环境污染、能源危机具有重要意义。
(1)已知:①碳的燃烧热为393.5
②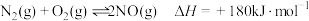
则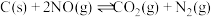 的
的
___________  。
。
(2)用焦炭还原 的反应为:
的反应为: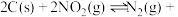
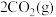 ,向两个容积均为
,向两个容积均为 、反应温度分别为
、反应温度分别为 、
、 的恒温恒容密闭容器中分别加入足量的焦炭和一定量的
的恒温恒容密闭容器中分别加入足量的焦炭和一定量的 ,测得各容器中
,测得各容器中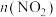 随反应时间
随反应时间 的变化情况如图所示;
的变化情况如图所示;___________ (填“放热”或“吸热”)反应。
② 时,
时,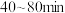 ,用
,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为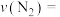
___________ , 时该反应的化学平衡常数
时该反应的化学平衡常数
___________  。
。
③ 下,
下,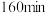 时,向容器中再加入焦炭和
时,向容器中再加入焦炭和 各
各 ,平衡向
,平衡向___________ (填“正”或“逆”)反应方向移动,再次达到平衡后, 的转化率比原平衡
的转化率比原平衡___________ (填“增大”“减小”或“不变”)。
(3)工业上除去氮氧化物的反应为:
①用该法除NO,投料比一定时提高NO平衡转化率的方法有___________ 、___________ 。
②反应温度过高,会发生以下副反应: ;
; ;某科研小组通过系列实验,分析得出脱硝率与氨氮比[
;某科研小组通过系列实验,分析得出脱硝率与氨氮比[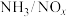 表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是
表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是___________ 。
(1)已知:①碳的燃烧热为393.5

②
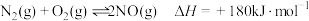
则
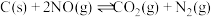 的
的
 。
。(2)用焦炭还原
 的反应为:
的反应为: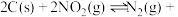
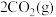 ,向两个容积均为
,向两个容积均为 、反应温度分别为
、反应温度分别为 、
、 的恒温恒容密闭容器中分别加入足量的焦炭和一定量的
的恒温恒容密闭容器中分别加入足量的焦炭和一定量的 ,测得各容器中
,测得各容器中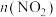 随反应时间
随反应时间 的变化情况如图所示;
的变化情况如图所示;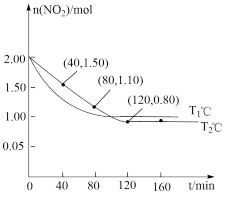
②
 时,
时,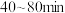 ,用
,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为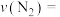
 时该反应的化学平衡常数
时该反应的化学平衡常数
 。
。③
 下,
下,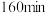 时,向容器中再加入焦炭和
时,向容器中再加入焦炭和 各
各 ,平衡向
,平衡向 的转化率比原平衡
的转化率比原平衡(3)工业上除去氮氧化物的反应为:

①用该法除NO,投料比一定时提高NO平衡转化率的方法有
②反应温度过高,会发生以下副反应:
 ;
; ;某科研小组通过系列实验,分析得出脱硝率与氨氮比[
;某科研小组通过系列实验,分析得出脱硝率与氨氮比[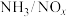 表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是
表示氨氮比]、温度的关系如图所示,从下图可以看出,最佳氨氮比为2.0,理由是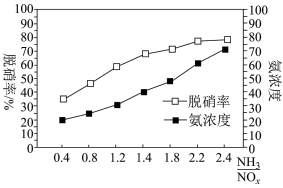
您最近一年使用:0次
名校
6 . 完成下列各题。
(1)甲烷高温下可分解为乙炔和氢气。写出甲烷分解的方程式为_______ 。
I.甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
①CO能与银氨溶液反应: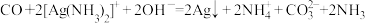
② 为红色,不与
为红色,不与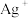 反应,能发生反应:
反应,能发生反应: 。
。
(2)装置A中反应的化学方程式为_______ 。
(3)按气流方向各装置从左到右的连接顺序为A→F→___ →C→G(填字母)。
Ⅱ.实验中滴加稀盐酸的操作为:先打开分液漏斗上口的玻璃塞(或先使分液漏斗上口的玻璃塞的凹槽对准漏斗上的小孔),再将分液漏斗下面的打开,使稀盐酸缓慢滴下。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是_______ ;装置F的作用为______ 。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有 :
:_______ 。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1
 溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
(1)甲烷高温下可分解为乙炔和氢气。写出甲烷分解的方程式为
I.甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
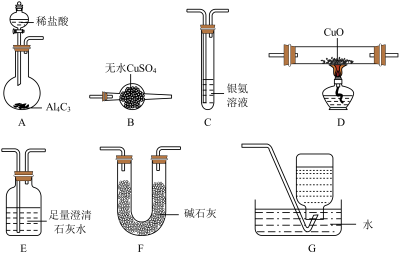
①CO能与银氨溶液反应:
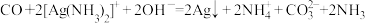
②
 为红色,不与
为红色,不与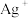 反应,能发生反应:
反应,能发生反应: 。
。(2)装置A中反应的化学方程式为
(3)按气流方向各装置从左到右的连接顺序为A→F→
Ⅱ.实验中滴加稀盐酸的操作为:先打开分液漏斗上口的玻璃塞(或先使分液漏斗上口的玻璃塞的凹槽对准漏斗上的小孔),再将分液漏斗下面的打开,使稀盐酸缓慢滴下。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有
 :
:②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1

 溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。| 实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
| 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
您最近一年使用:0次
名校
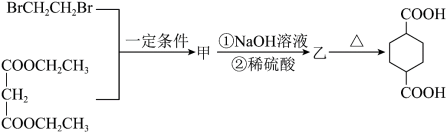
7 . 环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:
(1)A的结构简式为___________ 。
(2)B→C的反应类型为___________ 。该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为___________ 。
(3)D→E的化学方程式为___________ 。
(4)M是G的同分异构体,写出同时满足下列条件的M的结构简式___________ 。(不考虑立体异构)
①1molM与足量银氨溶液反应生成4molAg; ②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为___________ ,乙的结构简式为___________ 。
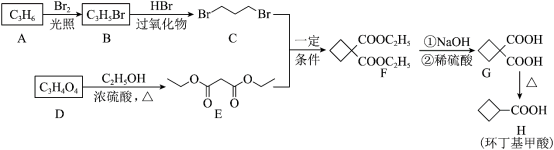
(1)A的结构简式为
(2)B→C的反应类型为
(3)D→E的化学方程式为
(4)M是G的同分异构体,写出同时满足下列条件的M的结构简式
①1molM与足量银氨溶液反应生成4molAg; ②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为
您最近一年使用:0次
解题方法
8 . 中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果于北京时间 9 月 24 日由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用 CH4与 CO2制备“合成气”(CO、H2),合成气可直接制备甲醇,反应原理为:

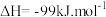 。
。
(1)已知:
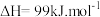 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)
计算 C—H 的键能 x= ______________ kJ/mol,(保留一位小数)。
(2)若要该反应自发进行,_______ (填“高温”或“低温”)更有利,该反应必须在高温下才能启动,原因是_______ 。
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式____________ 。
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
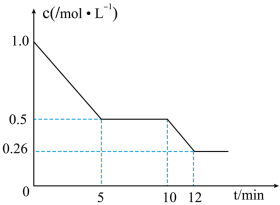
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:_______ 。
②T1℃时,该反应的化学平衡常数 K=_______ 。
③10min 时,改变的外界条件可能是_______ 。
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将_______ (填“向左进行”“向右进行”“达到平衡”或“无法判断”)。

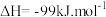 。
。(1)已知:

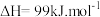 ,部分键能数据如下:(CO 的结构式为 C≡O)
,部分键能数据如下:(CO 的结构式为 C≡O)| 共价键 | C≡O | C—O | C—H | O—H | H—H |
| 键能/(kJ/mol) | 1072 | 326 | 464 | 436 |
(2)若要该反应自发进行,
(3)已知:H2 (g)的燃烧热ΔH=-285.8kJ.mol-1,写出H2 (g)燃烧热的热化学反应方程式
(4)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 |
| B.混合气体的密度不再变化 |
| C.CO 的百分含量不再变化 |
| D.CO、H2、CH3OH 的物质的量之比为 1∶2∶1 |
(5)T1℃下,在 2L 恒容密闭容器中充入 2molCO 和 6molH2合成 CH3OH(g),测得 CO 的物质的量浓度随反应时间的变化如图所示:
②T1℃时,该反应的化学平衡常数 K=
③10min 时,改变的外界条件可能是
(6)T1℃下,在 1L 恒容密闭容器中充入 2molCO、2molH2和 3molCH3OH(g),此时反应将
您最近一年使用:0次
解题方法
9 . 某学习小组为了探究 CH3COOH 的电离情况,进行了如下实验。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
(1)该滴定涉及的离子反应方程式为__________________ 。
(2)滴定时量取 20.00ml 的待测液,选择的仪器为_______________ 。
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为_______________ ,到达滴定终点的判断:_______________ 。
(4)该醋酸中 CH3COOH 的物质的量浓度为_______________ 。
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
(6)根据表中数据可以得出 CH3COOH 是弱电解质的结论,你认为得出此结论的依据是 _______________ 。
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将_______________ (填“增大”“减小”或“不变”)。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
| 试验次数 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
(2)滴定时量取 20.00ml 的待测液,选择的仪器为
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为
(4)该醋酸中 CH3COOH 的物质的量浓度为
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
| A.酸式滴定管洗净后未用待装液润洗 |
| B.滴定前碱式滴定管尖端处有气泡,滴定后气泡消失 |
| C.摇动锥形瓶用力过猛,使少量溶液溅出 |
| D.滴定前仰视读数,滴定完毕俯视读数 |
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
| 浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.100 | 0.200 |
| PH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将
您最近一年使用:0次
解题方法
10 . 工业废弃物铬钒渣中含有价格相对较高且稀缺的钒(V)、铬(Cr)元素,铬钒渣中铬、钒均以低价含氧酸盐(不溶于水,也不溶于碱性溶液)形式存在,杂质的成分主要为 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: 与
与 固体能发生反应。
固体能发生反应。
②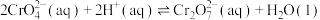 。
。
③25℃时, ,
,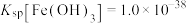 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。
(1)“煅烧”时为加快反应速率,可采取的措施为___________ ;“煅烧”时铬元素被氧化为相应的最高价含氧酸盐,则该最高价含氧酸盐中铬元素的化合价为___________ 价。
(2)写出“煅烧”时 与
与 固体反应的化学方程式:
固体反应的化学方程式:___________ 。
(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:___________ 。
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=___________ 。
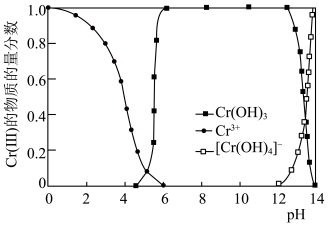
(5)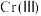 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于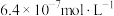 ,则调节pH的范围为
,则调节pH的范围为___________ {已知:25℃时,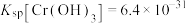 }。
}。 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ ; 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为___________ 。
 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: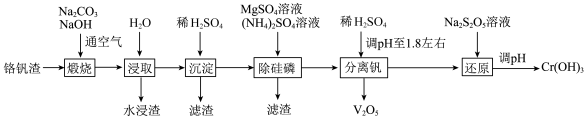
 与
与 固体能发生反应。
固体能发生反应。②
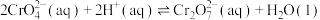 。
。③25℃时,
 ,
,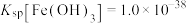 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。(1)“煅烧”时为加快反应速率,可采取的措施为
(2)写出“煅烧”时
 与
与 固体反应的化学方程式:
固体反应的化学方程式:(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=
(5)
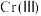 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于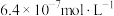 ,则调节pH的范围为
,则调节pH的范围为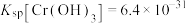 }。
}。
 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为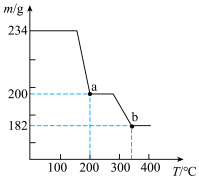
您最近一年使用:0次

 溶液
溶液




