解题方法
1 . 从海水中提取溴的工业流程如图,下列说法错误的是
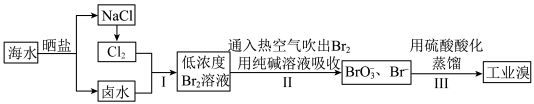
| A.海水晒盐利用的是蒸发结晶法 |
B.电解熔融氯化钠获得金属钠的同时还可获得 |
| C.步骤II中溴与碳酸钠的反应中氧化剂与还原剂的物质的量之比为1∶1 |
| D.通入热空气吹出Br₂,利用了溴的挥发性 |
您最近一年使用:0次
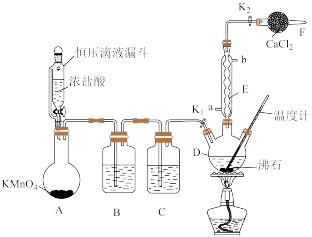
2 . 一氯化苄(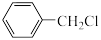 )具有刺激性气味,不溶于水,可混溶于多数有机溶剂中,是一种重要的化工、医药中间体。某兴趣小组设计的制备一氯化苄并分离出产物的实验装置如图(部分夹持装置已略)。
)具有刺激性气味,不溶于水,可混溶于多数有机溶剂中,是一种重要的化工、医药中间体。某兴趣小组设计的制备一氯化苄并分离出产物的实验装置如图(部分夹持装置已略)。
反应原理为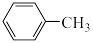 +Cl2
+Cl2
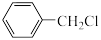 +HCl。
+HCl。
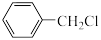 +Cl2
+Cl2
 +HCl
+HCl
 +Cl2
+Cl2
 +HCl
+HCl
| 物理性质 | 熔点/℃ | 沸点/℃ | 密度/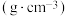 |
| 甲苯 |  | 110 | 0.86 |
| 一氯化苄 | 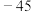 | 179 | 1.10 |
(1)A中发生反应的离子方程式为
(2)恒压滴液漏斗中支管的作用是
(3)仪器D的名称是
(4)该装置的缺陷是
(5)若向装置D中加入16.0mL甲苯,反应结束后,混合物经蒸馏,得到产物12.0mL,一氯化苄的产率约为
(6)工业上常采用如图所示的流程制备一氯化苄[反应区维持
 ],该流程的优点是
],该流程的优点是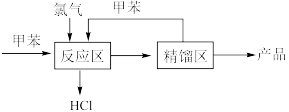
您最近一年使用:0次
2024-07-25更新
|
57次组卷
|
4卷引用:云南省楚雄彝族自治州2023-2024学年高二下学期7月期末考试化学试题
3 . 抗疟疾药物阿莫地喹的合成路线如图。
(1)B的名称为_______ 。
(2)A和B反应生成C的化学方程式为_______ 。
(3)D中含氧官能团的名称为_______ 。
(4)E的结构简式为_______ ;G+K→L的反应类型为_______ 。
(5)J中C原子的杂化轨道类型为_______ ,已知N原子周围电子云密度越大,碱性越强,则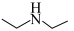 的碱性比
的碱性比
_______ (填“强”或“弱”)。
(6)在H的同分异构体中,同时满足下列条件的结构共有_______ 种。
① 与苯环直接相连
与苯环直接相连
②能和 溶液反应生成
溶液反应生成
其中,核磁共振氢谱显示有5组峰,且峰面积之比为2:2:2:2:1的H的结构简式为_______ 。
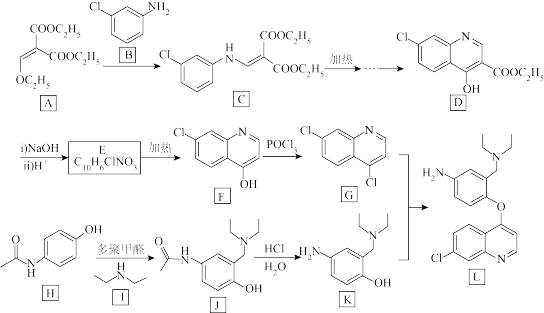
(1)B的名称为
(2)A和B反应生成C的化学方程式为
(3)D中含氧官能团的名称为
(4)E的结构简式为
(5)J中C原子的杂化轨道类型为
 的碱性比
的碱性比
(6)在H的同分异构体中,同时满足下列条件的结构共有
①
 与苯环直接相连
与苯环直接相连②能和
 溶液反应生成
溶液反应生成
其中,核磁共振氢谱显示有5组峰,且峰面积之比为2:2:2:2:1的H的结构简式为
您最近一年使用:0次
解题方法
4 . 以废旧锌锰干电池的炭包(含炭粉、 、
、 和少量Fe、Cu等物质)为原料,从中回收
和少量Fe、Cu等物质)为原料,从中回收 的工艺流程如图:
的工艺流程如图:
(1)“酸浸”时为加快反应速率,提高浸取效率,可采取的措施有___________ (任写一点),“酸浸”过程中,Cu与稀硝酸反应的离子方程式为___________ 。
(2)“灼烧”的目的是___________ 。
(3)“溶解”时加入 可将
可将 转化为硫酸锰,
转化为硫酸锰, 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是___________ 。
(4)写出“焙烧”过程的化学方程式:___________ 。
(5)利用铝热反应原理可将 转化为Mn,写出该反应的化学方程式:
转化为Mn,写出该反应的化学方程式:___________ 。
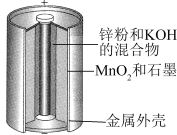
(6)碱性锌锰干电池是一种使用广泛的便携式电源,结构如图所示。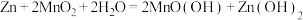 。
。
① 中Mn的化合价为
中Mn的化合价为___________ 价。
②该电池工作时,正极的电极反应式为___________ 。
 、
、 和少量Fe、Cu等物质)为原料,从中回收
和少量Fe、Cu等物质)为原料,从中回收 的工艺流程如图:
的工艺流程如图: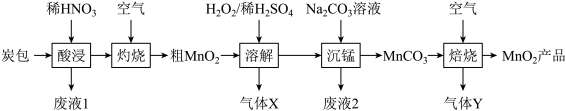
(1)“酸浸”时为加快反应速率,提高浸取效率,可采取的措施有
(2)“灼烧”的目的是
(3)“溶解”时加入
 可将
可将 转化为硫酸锰,
转化为硫酸锰, 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是(4)写出“焙烧”过程的化学方程式:
(5)利用铝热反应原理可将
 转化为Mn,写出该反应的化学方程式:
转化为Mn,写出该反应的化学方程式:(6)碱性锌锰干电池是一种使用广泛的便携式电源,结构如图所示。
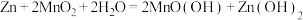 。
。①
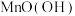 中Mn的化合价为
中Mn的化合价为②该电池工作时,正极的电极反应式为
您最近一年使用:0次
解题方法
5 . 化学反应速率和限度是研究化学反应的重要角度。回答下列问题:
Ⅰ.在催化剂作用下,可利用光能分解水制备氢气,已知断裂1mol ,1mol
,1mol 中的化学键分别要吸收436kJ和496kJ能量,断裂1mol
中的化学键分别要吸收436kJ和496kJ能量,断裂1mol 键需要吸收463kJ能量。
键需要吸收463kJ能量。
(1)2mol 完全分解需
完全分解需___________ (填“放出”或“吸收”)___________ kJ能量。
(2)下列能正确表示该过程能量变化的示意图是___________(填标号)。
Ⅱ.某兴趣小组将除去氧化膜的镁条投入少量稀盐酸中进行实验,速率实验测得氢气的产生速率变化情况如图所示。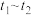 速率变化的主要原因是
速率变化的主要原因是___________ 。
(4) 速率变化的主要原因是
速率变化的主要原因是___________ 。
Ⅲ.某课题研究小组利用活性炭处理氮氧化物,发生反应: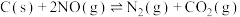 。
。
(5)一定温度下,在容积固定的密闭容器中发生上述反应,下列可以表明反应达到化学平衡状态的是___________(填标号)。
(6)该小组在两个2L的密闭容器中分别加入活性炭(足量)和1.0molNO,测得两容器在不同温度下NO的物质的量变化如下表:
① ℃时,0~5min内,反应速率
℃时,0~5min内,反应速率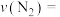
___________ 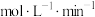 。
。
②两容器内温度的关系为
___________ (填“>”“<”或“=”) 。
。
Ⅰ.在催化剂作用下,可利用光能分解水制备氢气,已知断裂1mol
 ,1mol
,1mol 中的化学键分别要吸收436kJ和496kJ能量,断裂1mol
中的化学键分别要吸收436kJ和496kJ能量,断裂1mol 键需要吸收463kJ能量。
键需要吸收463kJ能量。(1)2mol
 完全分解需
完全分解需(2)下列能正确表示该过程能量变化的示意图是___________(填标号)。
A.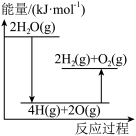 | B.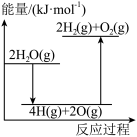 | C. | D.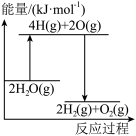 |
Ⅱ.某兴趣小组将除去氧化膜的镁条投入少量稀盐酸中进行实验,速率实验测得氢气的产生速率变化情况如图所示。
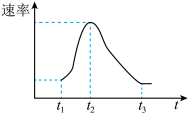
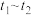 速率变化的主要原因是
速率变化的主要原因是(4)
 速率变化的主要原因是
速率变化的主要原因是Ⅲ.某课题研究小组利用活性炭处理氮氧化物,发生反应:
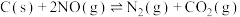 。
。(5)一定温度下,在容积固定的密闭容器中发生上述反应,下列可以表明反应达到化学平衡状态的是___________(填标号)。
A.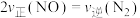 | B. 与 与 的物质的量之比为1∶1 的物质的量之比为1∶1 |
| C.NO的体积分数不再改变 | D.容器内气体总压强不再改变 |
(6)该小组在两个2L的密闭容器中分别加入活性炭(足量)和1.0molNO,测得两容器在不同温度下NO的物质的量变化如下表:
容器1( ℃) ℃) | 容器2( ℃) ℃) | |||||||||
| 0 | 0 | 5min | 9min | min | 10min | 12min | 0 | 5min | 9min | 10min |
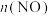 /mol /mol | 1.00 | 0.58 | 0.42 | 0.40 | 0.40 | 1.00 | 1.00 | 0.50 | 0.34 | 0.34 |
 ℃时,0~5min内,反应速率
℃时,0~5min内,反应速率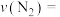
 。
。②两容器内温度的关系为

 。
。
您最近一年使用:0次
6 . 氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水,溶于浓盐酸生成氯亚铜酸,溶于氨水生成氯化二氨合亚铜,不溶于乙醇,可用作催化剂、杀菌剂、媒染剂、脱色剂等。可通过如下反应制备氯化亚铜: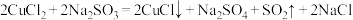 。回答下列问题:
。回答下列问题:
(1)基态Cu原子的价层电子轨道表示式为_______ ,上述反应涉及的元素中位于元素周期表p区的有_______ 种。
(2)O、Na、Cl的电负性由大到小的顺序为_______ 。
(3) 分子中S的杂化方式为
分子中S的杂化方式为_______ ,其空间结构为_______ 形。
(4) 的热稳定性不如CuCl,其原因为
的热稳定性不如CuCl,其原因为_______ (从原子结构角度分析)。
(5)CuCl的晶胞结构示意图如图,设 为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,0,0),晶胞边长为a pm。
为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,0,0),晶胞边长为a pm。 最近且等距离的
最近且等距离的 有
有_______ 个。
②2号原子的坐标为_______ 。
③CuCl晶体的密度为_______  。
。
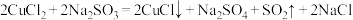 。回答下列问题:
。回答下列问题:(1)基态Cu原子的价层电子轨道表示式为
(2)O、Na、Cl的电负性由大到小的顺序为
(3)
 分子中S的杂化方式为
分子中S的杂化方式为(4)
 的热稳定性不如CuCl,其原因为
的热稳定性不如CuCl,其原因为(5)CuCl的晶胞结构示意图如图,设
 为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,0,0),晶胞边长为a pm。
为阿伏加德罗常数的值,1号原子的坐标为(0,0,0),3号原子的坐标为(1,0,0),晶胞边长为a pm。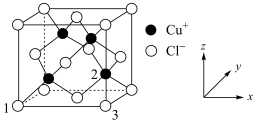
 最近且等距离的
最近且等距离的 有
有②2号原子的坐标为
③CuCl晶体的密度为
 。
。
您最近一年使用:0次
7 . 乙苯主要用于生产苯乙烯。已知下列反应的热化学方程式: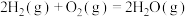
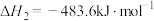
回答下列问题:_______ (填“有”或“无”)π键的断裂。
②该反应的催化剂为_______ 。
(3)向密闭容器中通入2 mol (g)和1 mol
(g)和1 mol  ,若容器内仅发生
,若容器内仅发生 氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图所示。
氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图所示。
_______ (填“>”“<”或“=”) 。
。
②若X表示压强,则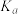 、
、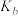 、
、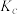 由大到小的顺序是
由大到小的顺序是_______ 。
③若A点的压强为150 kPa,则A点对应条件下,该反应的平衡常数
_______ kPa( 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(4)研究人员发现利用 氧化乙苯脱氢制苯乙烯效果更好,与
氧化乙苯脱氢制苯乙烯效果更好,与 氧化乙苯脱氢制苯乙烯相比,使用
氧化乙苯脱氢制苯乙烯相比,使用 的优点有
的优点有_______ (写出一点即可)。
①直接脱氢: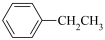 (g)⇌
(g)⇌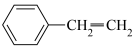 (g)+H2(g)
(g)+H2(g)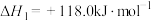
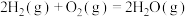
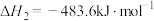
回答下列问题:
(1) 氧化乙苯脱氢反应③2
氧化乙苯脱氢反应③2 (g)+O2(g)=2
(g)+O2(g)=2 (g)+2H2O(g)
(g)+2H2O(g)  的
的
 ,
, 氧化乙苯脱氢反应在
氧化乙苯脱氢反应在
②该反应的催化剂为
(3)向密闭容器中通入2 mol
 (g)和1 mol
(g)和1 mol  ,若容器内仅发生
,若容器内仅发生 氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图所示。
氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图所示。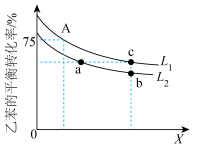

 。
。②若X表示压强,则
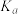 、
、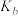 、
、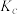 由大到小的顺序是
由大到小的顺序是③若A点的压强为150 kPa,则A点对应条件下,该反应的平衡常数

 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(4)研究人员发现利用
 氧化乙苯脱氢制苯乙烯效果更好,与
氧化乙苯脱氢制苯乙烯效果更好,与 氧化乙苯脱氢制苯乙烯相比,使用
氧化乙苯脱氢制苯乙烯相比,使用 的优点有
的优点有
您最近一年使用:0次
8 . 已知 为二元弱酸,常温下,
为二元弱酸,常温下, NaHA水溶液中,
NaHA水溶液中, 、
、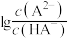 随溶液pH的变化曲线如图所示(忽略调pH时溶液体积的变化)。下列说法正确的是
随溶液pH的变化曲线如图所示(忽略调pH时溶液体积的变化)。下列说法正确的是
 为二元弱酸,常温下,
为二元弱酸,常温下, NaHA水溶液中,
NaHA水溶液中, 、
、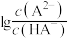 随溶液pH的变化曲线如图所示(忽略调pH时溶液体积的变化)。下列说法正确的是
随溶液pH的变化曲线如图所示(忽略调pH时溶液体积的变化)。下列说法正确的是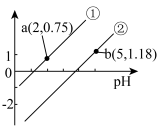
A.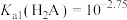 |
B.曲线②代表 随溶液pH的变化曲线 随溶液pH的变化曲线 |
C.pH=7时,溶液中一定存在 |
D.NaHA溶液中: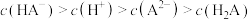 |
您最近一年使用:0次
9 . 化学与生活、环境、能源、科技等息息相关。下列叙述错误的是
| A.饮用水加活性炭净水的同时可杀菌消毒 | B. 是一种大气污染物,会形成酸雨 是一种大气污染物,会形成酸雨 |
| C.天然气是清洁燃料,属于不可再生能源 | D.车规级芯片的主要成分单晶硅是共价晶体 |
您最近一年使用:0次
解题方法
10 . 氮的化合物是重要的化工原料,也是空气污染物的重要来源,其转化一直是化学研究的热点。
(1)下列有关NH3的说法正确的是___________(填标号)。
(2)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟的成分是___________ (写化学式)。
③经过一段时间可观察到装置N中的现象为___________ 。
(3)经过装置N出来的尾气中会含有NO、NO2等氮氧化物:
①下列环境问题与氮的氧化物排放有关的是___________ (填标号)。
A.酸雨 B.白色污染 C.光化学烟雾 D.温室效应
②为消除它们对环境的污染,可用NH3处理,已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则该混合气体中NO和NO2的物质的量之比为___________ 。
(4)工厂生产出的浓硝酸可用铝槽车或铁槽车来运输,是因为在常温下,浓硝酸能使铝、铁等发生___________ 现象,说明浓硝酸具有很强的___________ 性。
(1)下列有关NH3的说法正确的是___________(填标号)。
| A.工业合成NH3需要在400—500°C、10-30MPa,催化剂条件下进行 |
| B.NH3可用来生产碳铵和尿素等化肥 |
| C.NH3可用浓硫酸或无水氯化钙干燥 |
| D.NH3受热易分解,需置于冷暗处保存 |
(2)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
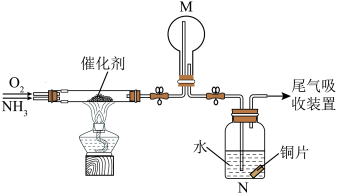
②一段时间后,观察到装置M中有白烟生成,该白烟的成分是
③经过一段时间可观察到装置N中的现象为
(3)经过装置N出来的尾气中会含有NO、NO2等氮氧化物:
①下列环境问题与氮的氧化物排放有关的是
A.酸雨 B.白色污染 C.光化学烟雾 D.温室效应
②为消除它们对环境的污染,可用NH3处理,已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则该混合气体中NO和NO2的物质的量之比为
(4)工厂生产出的浓硝酸可用铝槽车或铁槽车来运输,是因为在常温下,浓硝酸能使铝、铁等发生
您最近一年使用:0次



