名校
解题方法
1 . 铁及其化合物在生产生活中有极其重要的用途,请回答下列问题:
(1)铁元素是组成人体必不可少的元素之一,以下几种常见的铁元素粒子,既有氧化性又有还原性的是__________ 。
A. Fe B. C.
C. 
(2)取少量 粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为
粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为__________ ,反应后得到的溶液记为A。
(3)取少量A置于试管中,滴入几滴NaOH溶液,可观察到红褐色沉淀(记为B)生成,反应的离子方程式为__________ 。
(4)在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中滴入__________ (填饱和“A”或“B”),继续煮沸至溶液呈__________ 色,停止加热,即制得 胶体(记为C)。
胶体(记为C)。
(5)另取一只小烧杯也加入25mL蒸馏水,接着向烧杯中加入少量 溶液,振荡均匀后的液体记为D,将C与D一起放置于暗处,分别用激光笔照射,出现
溶液,振荡均匀后的液体记为D,将C与D一起放置于暗处,分别用激光笔照射,出现__________ (填“相同”或“不相同”)的现象,其中C中可以看到__________ (填现象)。
(6)人体血红蛋白分子中含有 ,正是这些
,正是这些 使血红蛋白分子具有载氧功能。亚硝酸钠(
使血红蛋白分子具有载氧功能。亚硝酸钠( )可将人体血红蛋白中的
)可将人体血红蛋白中的 转化为
转化为 ,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中
,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中 发生
发生__________ 反应,说明亚硝酸钠具有__________ 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有__________ 性。
(1)铁元素是组成人体必不可少的元素之一,以下几种常见的铁元素粒子,既有氧化性又有还原性的是
A. Fe B.
 C.
C. 
(2)取少量
 粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为
粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为(3)取少量A置于试管中,滴入几滴NaOH溶液,可观察到红褐色沉淀(记为B)生成,反应的离子方程式为
(4)在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中滴入
 胶体(记为C)。
胶体(记为C)。(5)另取一只小烧杯也加入25mL蒸馏水,接着向烧杯中加入少量
 溶液,振荡均匀后的液体记为D,将C与D一起放置于暗处,分别用激光笔照射,出现
溶液,振荡均匀后的液体记为D,将C与D一起放置于暗处,分别用激光笔照射,出现(6)人体血红蛋白分子中含有
 ,正是这些
,正是这些 使血红蛋白分子具有载氧功能。亚硝酸钠(
使血红蛋白分子具有载氧功能。亚硝酸钠( )可将人体血红蛋白中的
)可将人体血红蛋白中的 转化为
转化为 ,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中
,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中 发生
发生
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
对于数以千万计的化学物质和十分丰富的化学变化,分类法的作用几乎是无可替代。某化学兴趣小组对下列四组物质进行研究
A.HCl、 、
、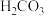 、
、
B. 、
、 、
、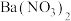 、
、
C. 溶液、蒸馏水、
溶液、蒸馏水、 悬浊液、
悬浊液、 胶体
胶体
D.NaOH、KOH、 、
、
(1)填写下列空白
(2)分类方法应用广泛,属于同一类的物质具有相似性, 、
、 、
、 、
、 都属于酸性氧化物,由
都属于酸性氧化物,由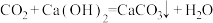 ,可得出
,可得出 与NaOH反应的化学方程式为
与NaOH反应的化学方程式为__________ 。此反应__________ (填“属于”或“不属于”)氧化还原反应。
对于数以千万计的化学物质和十分丰富的化学变化,分类法的作用几乎是无可替代。某化学兴趣小组对下列四组物质进行研究
A.HCl、
 、
、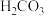 、
、
B.
 、
、 、
、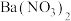 、
、
C.
 溶液、蒸馏水、
溶液、蒸馏水、 悬浊液、
悬浊液、 胶体
胶体D.NaOH、KOH、
 、
、
(1)填写下列空白
| A组 | B组 | C组 | D组 | |
| 分类标准 | 含氧酸 | ② | 分散系 | ④ |
| 不属于该类别的物质 | ① |  | ③ |  |
 、
、 、
、 、
、 都属于酸性氧化物,由
都属于酸性氧化物,由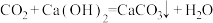 ,可得出
,可得出 与NaOH反应的化学方程式为
与NaOH反应的化学方程式为
您最近一年使用:0次
解题方法
3 . 铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
Ⅰ.
(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有_____ 元素。
(2)铁元素有三种常见的氧化物,分别是FeO、 、
、 。其中具有磁性的是
。其中具有磁性的是_____ ,可作红色颜料的是_____ 。
(3)某补铁口服液中含有 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为_____ 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,此过程中利用了维生素C的_____ 性。
(4) 可作为铜电路板的腐蚀液,其反应原理为Cu与
可作为铜电路板的腐蚀液,其反应原理为Cu与 溶液反应生成
溶液反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_____ 。向反应后的溶液中加入_____ ,可回收Cu,并得到 溶液。
溶液。
Ⅱ.高铁酸钾( )是一种新型、高效、多功能水处理剂。工业上制备高铁酸钾的流程如下图所示:
)是一种新型、高效、多功能水处理剂。工业上制备高铁酸钾的流程如下图所示:
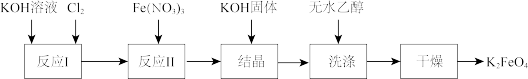
(5)下列说法错误的是_____。
(6)用电解饱和食盐水获得原料氯气的过程中有2mol电子发生转移,试计算理论上最多可制得氯气的体积(标准状况)是_____ L。
Ⅰ.
(1)生铁含有C、Si、Mn、S、P等元素,其中属于金属元素的除Fe外,还有
(2)铁元素有三种常见的氧化物,分别是FeO、
 、
、 。其中具有磁性的是
。其中具有磁性的是(3)某补铁口服液中含有
 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加KSCN溶液,若溶液变为(4)
 可作为铜电路板的腐蚀液,其反应原理为Cu与
可作为铜电路板的腐蚀液,其反应原理为Cu与 溶液反应生成
溶液反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 溶液。
溶液。Ⅱ.高铁酸钾(
 )是一种新型、高效、多功能水处理剂。工业上制备高铁酸钾的流程如下图所示:
)是一种新型、高效、多功能水处理剂。工业上制备高铁酸钾的流程如下图所示:
(5)下列说法错误的是_____。
A. 中铁元素的化合价为+6价 中铁元素的化合价为+6价 |
| B.用无水乙醇洗涤可以减少产品的损耗 |
C.反应Ⅱ中的氧化剂是 |
| D.高铁酸根离子具有强氧化性,能杀菌消毒 |
您最近一年使用:0次
解题方法
4 . Ⅰ.氯气及氯的化合物的“价-类”二维图体现了化学变化之美。
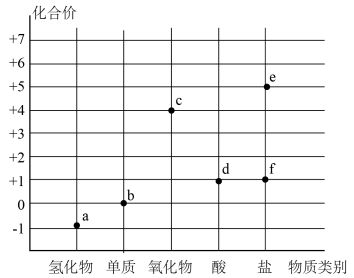
(1)f(84消毒液的主要成分)可用于环境杀菌消毒,f的化学式是_____ 。
(2)不同价态的氯元素可以相互转化,请写出反应前后存在3种价态氯元素的化学方程式_____ 。
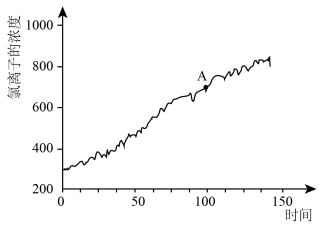
(3)将氯离子传感器插入新制b的水溶液广口瓶中,与数据采集器、计算机连接,用强光照射瓶中溶液,采集数据所得图像如图所示。A点溶液发生分解反应的离子方程式为_____ 。
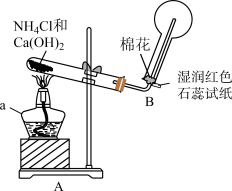
Ⅱ.氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(4)实验一:用如图所示装置制备并收集 。仪器a的名称为
。仪器a的名称为_____ ,装置A中产生 的化学方程式为
的化学方程式为_____ ,装置B中用圆底烧瓶收集 的方法为
的方法为_____ (填“向上排空气法”或“向下排空气法”),当湿润红色石蕊试纸颜色变为_____ 色,表示已经收集满 。
。

(1)f(84消毒液的主要成分)可用于环境杀菌消毒,f的化学式是
(2)不同价态的氯元素可以相互转化,请写出反应前后存在3种价态氯元素的化学方程式
(3)将氯离子传感器插入新制b的水溶液广口瓶中,与数据采集器、计算机连接,用强光照射瓶中溶液,采集数据所得图像如图所示。A点溶液发生分解反应的离子方程式为

Ⅱ.氨是一种重要的化工产品,也是重要的化工原料。某化学小组在实验室制备氨并完成相关性质实验。
(4)实验一:用如图所示装置制备并收集
 。仪器a的名称为
。仪器a的名称为 的化学方程式为
的化学方程式为 的方法为
的方法为 。
。
您最近一年使用:0次
5 . 请按要求填写下列空白:
(1)① 中,阴离子空间结构为
中,阴离子空间结构为___________ ,C原子的杂化方式为___________ 。
②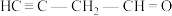 分子中含有
分子中含有___________ 个 键,
键,___________ 个 键。
键。
(2)① ;②
;② ;③
;③ ;④
;④ 这些物质中含有极性键的非极性分子的是
这些物质中含有极性键的非极性分子的是___________ (填编号)。
(3)写出 的VSEPR模型名称
的VSEPR模型名称___________ , 的空间结构
的空间结构___________
(4)三价铬离子能形成多种配位化合物。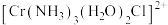 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(1)①
 中,阴离子空间结构为
中,阴离子空间结构为②
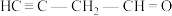 分子中含有
分子中含有 键,
键, 键。
键。(2)①
 ;②
;② ;③
;③ ;④
;④ 这些物质中含有极性键的非极性分子的是
这些物质中含有极性键的非极性分子的是(3)写出
 的VSEPR模型名称
的VSEPR模型名称 的空间结构
的空间结构(4)三价铬离子能形成多种配位化合物。
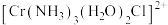 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是
您最近一年使用:0次
6 . I.化学兴趣小组对以下实验进行探究:
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式______ 。
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移______ mol电子。
(3)下列有关Fe2+的说法不正确的是_______ (选填序号)。
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是_______ (选填序号)。
(5)稀溴水的颜色为_______ 。
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式_______ 。另将Fe2+逐滴滴加到另一份稀溴水溶液中,加入几滴______ 溶液,溶液变为红色,证明Br2能将Fe2+氧化为Fe3+。
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为______ mol/L。
(1)牙膏摩擦剂由碳酸钙、氢氧化铝组成;写出氢氧化铝与NaOH溶液反应的离子方程式
II.现欲探究铁及其化合物的氧化性或还原性,请完成以下实验报告:
(2)称取用磨砂纸打磨后的铁钉2.8g放入50.0mL稀硫酸中,充分反应后若2.8g纯净的Fe全部参加反应。反应中转移
(3)下列有关Fe2+的说法不正确的是
| A.可以先加KSCN溶液再加氯水来检验Fe2+ |
| B.可以先加铁粉再加KSCN溶液来检验Fe2+ |
| C.能使酸性KMnO4溶液紫色褪去 |
| D.能观察到溶液颜色为浅绿色 |
III.卤族元素是典型的非金属元素,已知稀溴水与稀铁盐(含Fe3+)溶液的颜色相近;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2。请完成以下实验报告:
(4)关于F、Cl、Br、I的比较,不正确的是
| A.它们的原子核外电子层数随核电荷数的增加而增多 |
| B.单质(F2、Cl2、Br2、I2)的氧化性随核电荷数的增加而减弱 |
| C.被其他卤素单质从卤化物中置换出来的可能性随原子序数的增加而增大 |
| D.它们的氢化物的稳定性随原子序数的增加而增强 |
(6)将Fe2+逐滴滴加到稀溴水溶液中,再加入几滴淀粉碘化钾溶液。溶液变为蓝色,不能证明证明Br2能将Fe2+氧化为Fe3+,因为Br2与I-作用产生的碘可以使淀粉变蓝,写出Br2与I-作用的离子方程式
(7)另取20mLFeSO4溶液,向其中通入Cl2。若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为
您最近一年使用:0次
解题方法
7 . 回答下列问题:
(1)如图利用氧化还原反应设计而成的原电池:
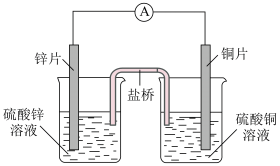
①左边烧杯内发生___________ (填“氧化”或“还原”)反应。
②右边烧杯内的电极反应式是___________ 。
③外电路中电子的流向是___________ 。
④电池总反应离子方程式是___________ 。盐桥M中装有KCl溶液和琼脂,其作用是 ___________ 。
(2)采用惰性电极电解饱和食盐水,阴极电极反应方程式___________ 。总反应的离子方程式___________ 。
(3)采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图示。
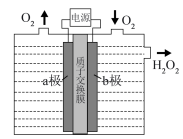
①a电极的名称是___________ 极。
②b极的电极反应方程式是___________ 。
(1)如图利用氧化还原反应设计而成的原电池:

①左边烧杯内发生
②右边烧杯内的电极反应式是
③外电路中电子的流向是
④电池总反应离子方程式是
(2)采用惰性电极电解饱和食盐水,阴极电极反应方程式
(3)采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图示。

①a电极的名称是
②b极的电极反应方程式是
您最近一年使用:0次
8 . 请运用反应热的知识填写下列空白:
(1)已知: (s,白磷)=
(s,白磷)= (s,黑磷)
(s,黑磷) 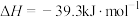 ;
;
 (s,白磷)=
(s,白磷)= (s,红磷)
(s,红磷) 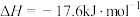 ;
;
由此推知,其中最稳定的磷单质是___________ 。
(2)①硅粉与HCl在300℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为___________ 。
②在 25℃ 和 101kPa时,4 g硫粉在O2中完全燃烧生成SO2气体,放出37 kJ的热量,写出表示S燃烧热的热化学方程式:___________ 。
(3)已知上述反应中相关的化学键键能数据如下:
则该反应的 ΔH = ___________ 。
(4)将 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①

②

③

反应③的 ΔH3 =___________ (用ΔH1,ΔH2表示)
(5)①2Cu2O(s) + O2(g) =4CuO(s) ΔH1=-277kJ·mol-1
②8CuO(s) + CH4(g)=4Cu2O(s) + CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
反应CH4(g) +2O2(g)=CO2(g)+2H2O(g) ΔH=___________ kJ·mol-1
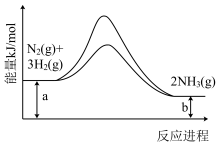
(6)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式___________ 。
(1)已知:
 (s,白磷)=
(s,白磷)= (s,黑磷)
(s,黑磷) 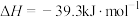 ;
; (s,白磷)=
(s,白磷)= (s,红磷)
(s,红磷) 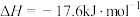 ;
;由此推知,其中最稳定的磷单质是
(2)①硅粉与HCl在300℃时反应生成1 mol SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为
②在 25℃ 和 101kPa时,4 g硫粉在O2中完全燃烧生成SO2气体,放出37 kJ的热量,写出表示S燃烧热的热化学方程式:
(3)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
(4)将
 氢化为
氢化为 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:①


②


③


反应③的 ΔH3 =
(5)①2Cu2O(s) + O2(g) =4CuO(s) ΔH1=-277kJ·mol-1
②8CuO(s) + CH4(g)=4Cu2O(s) + CO2(g)+2H2O(g) ΔH2=-348kJ·mol-1
反应CH4(g) +2O2(g)=CO2(g)+2H2O(g) ΔH=
(6)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式

您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)联三苯的结构是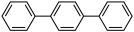 ,其一氯代物(C8H13Cl)有
,其一氯代物(C8H13Cl)有____________ 种。
(2)某有机化合物的结构确定:
①测定实验式:某含C、H、O三种元素的有机化合物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是_____ 。
②确定分子式:如图是该有机化合物的质谱图,则其相对分子质量为____ ;分子式为____ 。
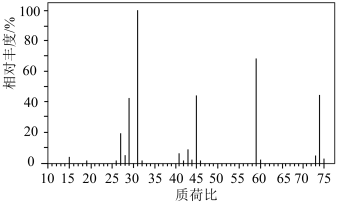
(3)己烷有____ 种同分异构体
(4)戊烷(C5H12)的某种同分异构体只有一种一氯代物,请书写它的结构简式_________
(5)1mol乙醇与足量钠反应生成的氢气在标准状况下的体积为____________ L。
(1)联三苯的结构是
 ,其一氯代物(C8H13Cl)有
,其一氯代物(C8H13Cl)有(2)某有机化合物的结构确定:
①测定实验式:某含C、H、O三种元素的有机化合物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是
②确定分子式:如图是该有机化合物的质谱图,则其相对分子质量为

(3)己烷有
(4)戊烷(C5H12)的某种同分异构体只有一种一氯代物,请书写它的结构简式
(5)1mol乙醇与足量钠反应生成的氢气在标准状况下的体积为
您最近一年使用:0次
2022-12-20更新
|
532次组卷
|
3卷引用:天津市第三中学2022-2023学年高二下学期期中质量检测化学试题
天津市第三中学2022-2023学年高二下学期期中质量检测化学试题广东省梅州市大埔县实验中学2021-2022学年高二下学期第一次段考(4月)化学试题(已下线)专题02 研究有机化合物的一般方法(知识串讲+专题过关)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)
名校
解题方法
10 . 完成下列反应的热化学方程式。
(1)沼气是一种能源,它的主要成分是CH4,常温下,0.5 mol CH4完全燃烧生成CO2(g)和液态水时,放出445 kJ热量,则热化学方程式为_______ 。
(2)已知H2S(g)完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为a kJ·mol-1,写出H2S的燃烧热的热化学方程式_______ 。
(3)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
则ΔH1=_______ kJ·mol-1。
(4)已知: ①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
试写出HF电离的热化学方程式_______ 。
(5)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
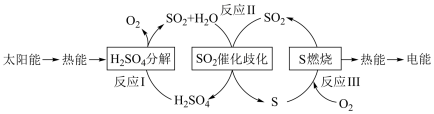
反应 I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应 III:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应II的热化学方程式:_______ 。
(1)沼气是一种能源,它的主要成分是CH4,常温下,0.5 mol CH4完全燃烧生成CO2(g)和液态水时,放出445 kJ热量,则热化学方程式为
(2)已知H2S(g)完全燃烧生成SO2(g)和H2O(l),H2S的燃烧热为a kJ·mol-1,写出H2S的燃烧热的热化学方程式
(3)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/ ( kJ·mol-1) | -1 560 | -1 411 | -286 |
(4)已知: ①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
试写出HF电离的热化学方程式
(5)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应 I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应 III:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应II的热化学方程式:
您最近一年使用:0次
2022-12-09更新
|
215次组卷
|
2卷引用:天津市红桥区2023-2024学年高三上学期期中考试化学试题



