名校
1 . 完成下列问题。
(1) 与NaOH溶液反应可得到
与NaOH溶液反应可得到 。
。
① 俗称纯碱,解释其水溶液呈碱性的原因,用离子方程式表示
俗称纯碱,解释其水溶液呈碱性的原因,用离子方程式表示___________ ,该溶液中离子浓度由大到小的顺序为___________ 。
② 溶液中
溶液中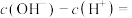
________ 。[用含 、
、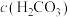 的关系式表示]
的关系式表示]
(2)查阅资料可知:常温下,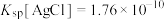
①银氨溶液中存在平衡: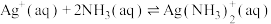 ,
,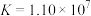 该反应平衡常数的表达式为
该反应平衡常数的表达式为
___________ 。
②计算得到可逆反应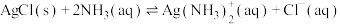 的化学平衡常数
的化学平衡常数
___________ (本空保留4位有效数字)。
(1)
 与NaOH溶液反应可得到
与NaOH溶液反应可得到 。
。①
 俗称纯碱,解释其水溶液呈碱性的原因,用离子方程式表示
俗称纯碱,解释其水溶液呈碱性的原因,用离子方程式表示②
 溶液中
溶液中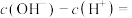
 、
、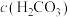 的关系式表示]
的关系式表示](2)查阅资料可知:常温下,
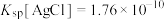
①银氨溶液中存在平衡:
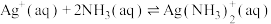 ,
,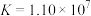 该反应平衡常数的表达式为
该反应平衡常数的表达式为
②计算得到可逆反应
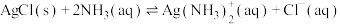 的化学平衡常数
的化学平衡常数
您最近一年使用:0次
名校
2 . 用现代分析仪器测定 粒子的大小。用氧化还原滴定法测定
粒子的大小。用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再以KSCN溶液作指示剂,用
,再以KSCN溶液作指示剂,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。
。
(1)滴定终点颜色变化为___________ 。
(2)滴定分析时,称取 (摩尔质量为Mg/mol)试样wg,消耗cmol/L
(摩尔质量为Mg/mol)试样wg,消耗cmol/L 标准溶液VmL,则
标准溶液VmL,则 质量分数表达式为
质量分数表达式为___________ 。
(3)下列操作对 质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果___________ 。
②若在滴定开始滴定管尖嘴处无气泡,滴定后滴定管尖嘴产生气泡,则测定结果___________ 。
 粒子的大小。用氧化还原滴定法测定
粒子的大小。用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再以KSCN溶液作指示剂,用
,再以KSCN溶液作指示剂,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。
。(1)滴定终点颜色变化为
(2)滴定分析时,称取
 (摩尔质量为Mg/mol)试样wg,消耗cmol/L
(摩尔质量为Mg/mol)试样wg,消耗cmol/L 标准溶液VmL,则
标准溶液VmL,则 质量分数表达式为
质量分数表达式为(3)下列操作对
 质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)①若在配制标准溶液过程中,烧杯中的
 溶液有少量溅出,使测定结果
溶液有少量溅出,使测定结果②若在滴定开始滴定管尖嘴处无气泡,滴定后滴定管尖嘴产生气泡,则测定结果
您最近一年使用:0次
2023-12-20更新
|
93次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期12月月考化学试题
名校
3 . 氯及其化合物有重要用途,氯气和 气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
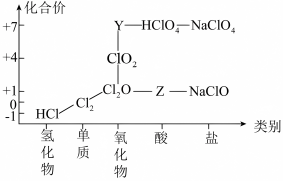
(1)根据图中信息写出Y、Z的化学式:______ 、______ 。
(2)已知高氯酸( )是强酸,写出高氯酸与氢氧化钠反应的离子方程式:
)是强酸,写出高氯酸与氢氧化钠反应的离子方程式:______ 。
(3)已知:消毒效率可用单位质量消毒剂得到的电子数的相对大小来表示。 是最早用于饮用水消毒的物质,
是最早用于饮用水消毒的物质, 是一种新的广谱消毒剂。等质量的
是一种新的广谱消毒剂。等质量的 和
和 消毒效率较高的是
消毒效率较高的是______ (填化学式);
(4)工业常用 和
和 溶液混合酸化后反应制得
溶液混合酸化后反应制得 气体,该反应的离子方程式为:
气体,该反应的离子方程式为:______ 。
(5)84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为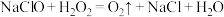 ,反应产生的
,反应产生的 促进藻类快速生长。
促进藻类快速生长。
①该反应说明氧化性:NaClO______  (填“>”或“<”)。
(填“>”或“<”)。
②当标准状况下有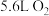 生成时,转移电子
生成时,转移电子______ mol。
高铁酸钠( )是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为
)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为 离子,制取高铁酸钠的化学方程式如下:
离子,制取高铁酸钠的化学方程式如下:
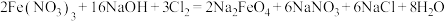
(6)在上述反应中______ (元素名称)元素被氧化,氧化剂是______ (化学式)。
(7)高铁酸钠( )是一种新型净水剂。在水处理过程中,
)是一种新型净水剂。在水处理过程中, 中的铁元素转化为
中的铁元素转化为 胶体,使水中悬浮物聚沉。向
胶体,使水中悬浮物聚沉。向 胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:
胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:______ 。
(8)实验室制备 胶体的离子方程式:
胶体的离子方程式:______ 。
 气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
气体均常用于自来水消毒。以下是氯元素的“价类二维图”的部分信息。请回答下列问题:
(1)根据图中信息写出Y、Z的化学式:
(2)已知高氯酸(
 )是强酸,写出高氯酸与氢氧化钠反应的离子方程式:
)是强酸,写出高氯酸与氢氧化钠反应的离子方程式:(3)已知:消毒效率可用单位质量消毒剂得到的电子数的相对大小来表示。
 是最早用于饮用水消毒的物质,
是最早用于饮用水消毒的物质, 是一种新的广谱消毒剂。等质量的
是一种新的广谱消毒剂。等质量的 和
和 消毒效率较高的是
消毒效率较高的是(4)工业常用
 和
和 溶液混合酸化后反应制得
溶液混合酸化后反应制得 气体,该反应的离子方程式为:
气体,该反应的离子方程式为:(5)84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。其原理为
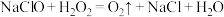 ,反应产生的
,反应产生的 促进藻类快速生长。
促进藻类快速生长。①该反应说明氧化性:NaClO
 (填“>”或“<”)。
(填“>”或“<”)。②当标准状况下有
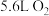 生成时,转移电子
生成时,转移电子高铁酸钠(
 )是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为
)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为 离子,制取高铁酸钠的化学方程式如下:
离子,制取高铁酸钠的化学方程式如下: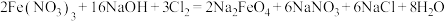
(6)在上述反应中
(7)高铁酸钠(
 )是一种新型净水剂。在水处理过程中,
)是一种新型净水剂。在水处理过程中, 中的铁元素转化为
中的铁元素转化为 胶体,使水中悬浮物聚沉。向
胶体,使水中悬浮物聚沉。向 胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:
胶体中逐滴加入HCl稀溶液至过量,会出现的现象是:(8)实验室制备
 胶体的离子方程式:
胶体的离子方程式:
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)今有11种物质:①盐酸;②石墨;③氯气;④ 晶体;⑤纯硫酸;⑥金刚石;⑦碱石灰;⑧乙醇;⑨熔融的
晶体;⑤纯硫酸;⑥金刚石;⑦碱石灰;⑧乙醇;⑨熔融的 ;⑩
;⑩ ;其中:
;其中:
①能导电的是(填序号,下同)_____________ ;
②属于电解质的是_____________ ;
(2)①19g某二价金属氯化物(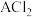 )中含有
)中含有 ,则
,则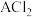 的摩尔质量是
的摩尔质量是______ ;
②现有标准状况下CO和 混合气体6.72L,其质量为11.6g,则此混合气体中,CO和
混合气体6.72L,其质量为11.6g,则此混合气体中,CO和 的物质的量之比是
的物质的量之比是______ ;
③质量相同的①HCl、② 、③
、③ 、④
、④ 四种气体中,在同温同压条件下,所占体积最小的是(填序号)
四种气体中,在同温同压条件下,所占体积最小的是(填序号)______ 。
(1)今有11种物质:①盐酸;②石墨;③氯气;④
 晶体;⑤纯硫酸;⑥金刚石;⑦碱石灰;⑧乙醇;⑨熔融的
晶体;⑤纯硫酸;⑥金刚石;⑦碱石灰;⑧乙醇;⑨熔融的 ;⑩
;⑩ ;其中:
;其中:①能导电的是(填序号,下同)
②属于电解质的是
(2)①19g某二价金属氯化物(
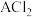 )中含有
)中含有 ,则
,则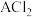 的摩尔质量是
的摩尔质量是②现有标准状况下CO和
 混合气体6.72L,其质量为11.6g,则此混合气体中,CO和
混合气体6.72L,其质量为11.6g,则此混合气体中,CO和 的物质的量之比是
的物质的量之比是③质量相同的①HCl、②
 、③
、③ 、④
、④ 四种气体中,在同温同压条件下,所占体积最小的是(填序号)
四种气体中,在同温同压条件下,所占体积最小的是(填序号)
您最近一年使用:0次
2023-12-11更新
|
78次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高一上学期11月期中考试化学试题
5 . 在常温下对反应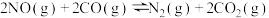 进行研究。
进行研究。
(1)若将3molNO和2molCO通入10L的恒容密闭容器中,在一定条件下发生上述反应,各组分的物质的量浓度随时间的变化情况如图所示。
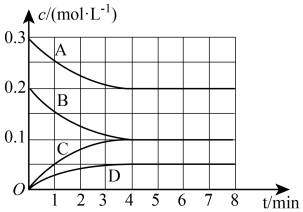
①图中曲线A表示___________ (填“NO”“CO”“ ”或“
”或“ ”,下同)的浓度变化,曲线C表示的是
”,下同)的浓度变化,曲线C表示的是___________ 的浓度变化。
②在0~4min内NO的平均反应速率,
___________ ,4min末 的浓度为
的浓度为___________ 。
③4min末,采用下列措施一定能加快上述反应速率的是___________ (填标号)。
A.升高体系的温度 B.充入一定量的O2
C.将容器体积变为5L D.充入一定量氦气
(2)下列叙述能说明上述反应已达到平衡状态的是___________ (填标号)。
a.容器内压强保持不变 b. 与
与 的物质的量之比为1:1
的物质的量之比为1:1
c.气体的密度保持不变 d.气体的平均相对分子质量保持不变
(3)根据图1数据计算该反应的平衡常数数值
___________ 。
 进行研究。
进行研究。(1)若将3molNO和2molCO通入10L的恒容密闭容器中,在一定条件下发生上述反应,各组分的物质的量浓度随时间的变化情况如图所示。

①图中曲线A表示
 ”或“
”或“ ”,下同)的浓度变化,曲线C表示的是
”,下同)的浓度变化,曲线C表示的是②在0~4min内NO的平均反应速率,

 的浓度为
的浓度为③4min末,采用下列措施一定能加快上述反应速率的是
A.升高体系的温度 B.充入一定量的O2
C.将容器体积变为5L D.充入一定量氦气
(2)下列叙述能说明上述反应已达到平衡状态的是
a.容器内压强保持不变 b.
 与
与 的物质的量之比为1:1
的物质的量之比为1:1c.气体的密度保持不变 d.气体的平均相对分子质量保持不变
(3)根据图1数据计算该反应的平衡常数数值

您最近一年使用:0次
名校
解题方法
6 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
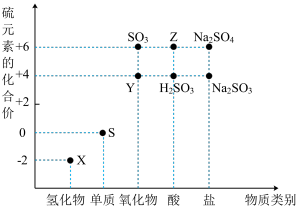
(1)写出化学式:Y___________ ,Z___________ 。
(2)X与Y能否共存___________ (填“能”或“不能”),若不能请写出化学方程式若能请说明理由___________ 。
(3) 与足量Z反应的离子方程式
与足量Z反应的离子方程式___________ 。
(4) 是重要的化工原料。
是重要的化工原料。 中硫元素的化合价为
中硫元素的化合价为___________ ,从氧化还原反应的角度分析,下列制备 的方案理论上可行的是
的方案理论上可行的是___________ (填序号)。
a. b.
b. c.
c. d.
d.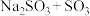
(5)写出Z的浓溶液与木炭发生反应的化学方程式___________ 。
(6)Y与稀硝酸反应,硝酸的还原产物为 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。

(1)写出化学式:Y
(2)X与Y能否共存
(3)
 与足量Z反应的离子方程式
与足量Z反应的离子方程式(4)
 是重要的化工原料。
是重要的化工原料。 中硫元素的化合价为
中硫元素的化合价为 的方案理论上可行的是
的方案理论上可行的是a.
 b.
b. c.
c.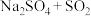 d.
d.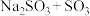
(5)写出Z的浓溶液与木炭发生反应的化学方程式
(6)Y与稀硝酸反应,硝酸的还原产物为
 ,写出反应的化学方程式:
,写出反应的化学方程式:
您最近一年使用:0次
2023-11-15更新
|
274次组卷
|
2卷引用:天津市北辰区2023-2024学年高三上学期11月期中考试化学试题
7 . 一定温度下,发生反应: (反应条件已略),现向2L密闭容器中充入
(反应条件已略),现向2L密闭容器中充入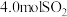 和
和 发生反应,测得
发生反应,测得 随时间的变化如下表:
随时间的变化如下表:
(1)①0~2min内,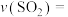
___________
②达到平衡时 的物质的量浓度为
的物质的量浓度为___________
(2)已知可逆反应: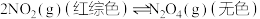 ,正反应为放热反应。将装有
,正反应为放热反应。将装有 和
和 混合气体的烧瓶放入热水中,观察到的现象
混合气体的烧瓶放入热水中,观察到的现象___________ ,产生该现象的原因是___________ 。
(3)在一定温度下,取一定量的冰醋酸加水稀释,稀释过程中溶液的导电能力I随加入水的体积V变化的曲线如图所示:

请回答下列问题:
①“O”点导电能力为0,说明冰醋酸没有电离,也说明了电解质发生电离的条件之一是___________ 。写出醋酸的电离方程式___________ 。
②a、b、c三点对应的溶液中, 最大的是
最大的是___________ 点,判断的理由是___________ 。
③a、b、c三点对应的溶液中, 电离程度最大的最
电离程度最大的最___________ 点。
 (反应条件已略),现向2L密闭容器中充入
(反应条件已略),现向2L密闭容器中充入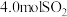 和
和 发生反应,测得
发生反应,测得 随时间的变化如下表:
随时间的变化如下表:| 时间/min | 1 | 2 | 3 | 4 | 5 |
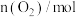 | 1.5 | 1.2 | 1.1 | 1.0 | 1.0 |
(1)①0~2min内,
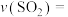
②达到平衡时
 的物质的量浓度为
的物质的量浓度为(2)已知可逆反应:
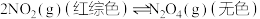 ,正反应为放热反应。将装有
,正反应为放热反应。将装有 和
和 混合气体的烧瓶放入热水中,观察到的现象
混合气体的烧瓶放入热水中,观察到的现象(3)在一定温度下,取一定量的冰醋酸加水稀释,稀释过程中溶液的导电能力I随加入水的体积V变化的曲线如图所示:

请回答下列问题:
①“O”点导电能力为0,说明冰醋酸没有电离,也说明了电解质发生电离的条件之一是
②a、b、c三点对应的溶液中,
 最大的是
最大的是③a、b、c三点对应的溶液中,
 电离程度最大的最
电离程度最大的最
您最近一年使用:0次
名校
8 . 回答下列问题。
(1)已知: 、
、 燃烧热分别为
燃烧热分别为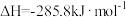 、
、 ,
,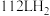 和
和 的混合气体(标准状况下)完全燃烧生成
的混合气体(标准状况下)完全燃烧生成 和液态水时放出
和液态水时放出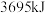 的热量,则混合气体中
的热量,则混合气体中 和
和 的物质的量之比是
的物质的量之比是___________ 。(整数比)
(2)某些共价键的键能数据如下表(单位: ):
):
把 分解为气态原子时,需要
分解为气态原子时,需要___________ (填“吸收”或“放出”)243kJ能量。由表中所列化学键形成的单质分子中,最稳定的是___________ ;
(3)发射火箭时用气态肼 作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知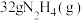 完全发生上述反应放出
完全发生上述反应放出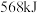 的热量,热化学方程式是:
的热量,热化学方程式是:___________ 。
(1)已知:
 、
、 燃烧热分别为
燃烧热分别为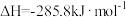 、
、 ,
,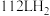 和
和 的混合气体(标准状况下)完全燃烧生成
的混合气体(标准状况下)完全燃烧生成 和液态水时放出
和液态水时放出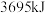 的热量,则混合气体中
的热量,则混合气体中 和
和 的物质的量之比是
的物质的量之比是(2)某些共价键的键能数据如下表(单位:
 ):
):| 共价键 |  |  |  |  |  |  |  |  |  |
| 键能 | 436 | 243 | 194 | 432 | 299 | 153 | 946 | 463 | 391 |
 分解为气态原子时,需要
分解为气态原子时,需要(3)发射火箭时用气态肼
 作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知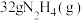 完全发生上述反应放出
完全发生上述反应放出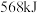 的热量,热化学方程式是:
的热量,热化学方程式是:
您最近一年使用:0次
2023-10-26更新
|
63次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期10月月考化学试题
9 . 按要求回答下列问题:
(1)将少量铁红(成分为 )加到适量盐酸中,得到黄色溶液。离子方程式为:
)加到适量盐酸中,得到黄色溶液。离子方程式为:_____ ;
(2)小烧杯中加入 蒸馏水,加热至沸腾,向沸水中滴入几滴上述黄色溶液,继续煮沸直至液体呈
蒸馏水,加热至沸腾,向沸水中滴入几滴上述黄色溶液,继续煮沸直至液体呈_____ 色,可制得 胶体。
胶体。 粒子直径大小的范围是
粒子直径大小的范围是_____ 。写出生成 胶体的化学方程式:
胶体的化学方程式:_____ 。
(3)制备 胶体时,加热煮沸时间过长,结果出现红褐色沉淀,滴加稀硫酸沉淀又溶解。沉淀溶解的离子方程式
胶体时,加热煮沸时间过长,结果出现红褐色沉淀,滴加稀硫酸沉淀又溶解。沉淀溶解的离子方程式_____ 。
(4)下列现象或过程不属于化学过程的是_____ 。
a.丁达尔效应 b.悬浊液静置后澄清 c.稀豆浆变质 d. 在空气中放置变质
在空气中放置变质
(5)当光束通过下列分散系时,能观察到丁达尔效应的是_____ 。
a.蒸馏水 b. 溶液 c.鸡蛋清加
溶液 c.鸡蛋清加 混合液 d.稀硫酸
混合液 d.稀硫酸
(1)将少量铁红(成分为
 )加到适量盐酸中,得到黄色溶液。离子方程式为:
)加到适量盐酸中,得到黄色溶液。离子方程式为:(2)小烧杯中加入
 蒸馏水,加热至沸腾,向沸水中滴入几滴上述黄色溶液,继续煮沸直至液体呈
蒸馏水,加热至沸腾,向沸水中滴入几滴上述黄色溶液,继续煮沸直至液体呈 胶体。
胶体。 粒子直径大小的范围是
粒子直径大小的范围是 胶体的化学方程式:
胶体的化学方程式:(3)制备
 胶体时,加热煮沸时间过长,结果出现红褐色沉淀,滴加稀硫酸沉淀又溶解。沉淀溶解的离子方程式
胶体时,加热煮沸时间过长,结果出现红褐色沉淀,滴加稀硫酸沉淀又溶解。沉淀溶解的离子方程式(4)下列现象或过程不属于化学过程的是
a.丁达尔效应 b.悬浊液静置后澄清 c.稀豆浆变质 d.
 在空气中放置变质
在空气中放置变质(5)当光束通过下列分散系时,能观察到丁达尔效应的是
a.蒸馏水 b.
 溶液 c.鸡蛋清加
溶液 c.鸡蛋清加 混合液 d.稀硫酸
混合液 d.稀硫酸
您最近一年使用:0次
10 . N、P两种元素位于元素周期表第VA族。请回答下列问题:
(1)基态氮原子的电子排布式为________ ;基态氮原子的价层电子的轨道表示式为________ 。
(2)基态磷原子中,其占据的最高能层的符号是________ ;基态磷原子占据的最高能级共有________ 个原子轨道,其形状是________ 。
(3)电负性:N________ P(填>或<)。
(4)雷酸汞曾被用作起爆药,雷酸汞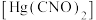 中C、N、O三种元素第一电离能从大到小的顺序为
中C、N、O三种元素第一电离能从大到小的顺序为________ >________ >________ (填元素符号)。
(1)基态氮原子的电子排布式为
(2)基态磷原子中,其占据的最高能层的符号是
(3)电负性:N
(4)雷酸汞曾被用作起爆药,雷酸汞
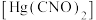 中C、N、O三种元素第一电离能从大到小的顺序为
中C、N、O三种元素第一电离能从大到小的顺序为
您最近一年使用:0次
2023-02-15更新
|
389次组卷
|
2卷引用:天津市朱唐庄中学2022-2023学年高二下学期3月阶段性检测化学试题



