1 . 根据短周期元素的性质回答下列问题。
I. 有较强的配位能力,许多金属离子都可以与
有较强的配位能力,许多金属离子都可以与 形成稳定的配合。反应
形成稳定的配合。反应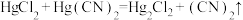 用于制备
用于制备 。
。
(1)上述反应的氧化剂是_______ 。
(2)写出 的结构简式
的结构简式_______ , 的空间构型是
的空间构型是_______ ;1mol 分子中
分子中 键为
键为_______ mol。
(3) 被称为拟卤素,性质与卤素相似,写出
被称为拟卤素,性质与卤素相似,写出 与氢氧化钠溶液反应的离子方程式
与氢氧化钠溶液反应的离子方程式_______ 。
(4)基态N价层电子排布式为_______ 。
Ⅱ.氟化镁( )晶胞是长方体,其结构如图所示
)晶胞是长方体,其结构如图所示 晶胞示意图中○表示
晶胞示意图中○表示_______ (填离子符号)。
(6)结合离子结构示意图,解释离子半径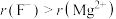 的原因
的原因_______ 。
(7) 晶胞中有
晶胞中有_______ 个 ;
;_______ 个 。
。
I.
 有较强的配位能力,许多金属离子都可以与
有较强的配位能力,许多金属离子都可以与 形成稳定的配合。反应
形成稳定的配合。反应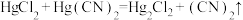 用于制备
用于制备 。
。(1)上述反应的氧化剂是
(2)写出
 的结构简式
的结构简式 的空间构型是
的空间构型是 分子中
分子中 键为
键为(3)
 被称为拟卤素,性质与卤素相似,写出
被称为拟卤素,性质与卤素相似,写出 与氢氧化钠溶液反应的离子方程式
与氢氧化钠溶液反应的离子方程式(4)基态N价层电子排布式为
Ⅱ.氟化镁(
 )晶胞是长方体,其结构如图所示
)晶胞是长方体,其结构如图所示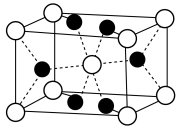
 晶胞示意图中○表示
晶胞示意图中○表示(6)结合离子结构示意图,解释离子半径
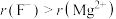 的原因
的原因(7)
 晶胞中有
晶胞中有 ;
; 。
。
您最近一年使用:0次
解题方法
2 . 完成下列问题
Ⅰ.现有下列十种物质:①蔗糖②熔融NaCl③盐酸④铜丝⑤NaOH固体⑥氧气⑦ 固体⑧乙醇⑨
固体⑧乙醇⑨ 溶液⑩液态
溶液⑩液态
(1)上述状态下物质中可导电的是___________ (填序号,下同)。
(2)上述状态下物质中不能导电,但属于电解质的是___________
(3)上述物质中属于非电解质的是___________ 。
Ⅱ.储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为: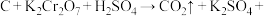
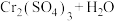 (未配平)。回答下列问题。
(未配平)。回答下列问题。
(4)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(5) 在该反应中表现出___________(填字母)。
在该反应中表现出___________(填字母)。
(6)配平上述方程式:___________ 。每生成2分子 ,该反应转移
,该反应转移___________ 个电子。
Ⅰ.现有下列十种物质:①蔗糖②熔融NaCl③盐酸④铜丝⑤NaOH固体⑥氧气⑦
 固体⑧乙醇⑨
固体⑧乙醇⑨ 溶液⑩液态
溶液⑩液态
(1)上述状态下物质中可导电的是
(2)上述状态下物质中不能导电,但属于电解质的是
(3)上述物质中属于非电解质的是
Ⅱ.储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:
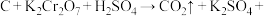
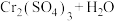 (未配平)。回答下列问题。
(未配平)。回答下列问题。(4)该反应中,还原剂是
(5)
 在该反应中表现出___________(填字母)。
在该反应中表现出___________(填字母)。| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
 ,该反应转移
,该反应转移
您最近一年使用:0次
3 . 根据反应 3H2S+2HNO3=3S↓+2NO+4H2O,回答下列问题。
(1)在上述反应中,氧化剂是___________ ,还原剂是___________ ,___________ 是还原产物。
(2)用双线桥表示出上述反应的电子的情况:___________ 。
(1)在上述反应中,氧化剂是
(2)用双线桥表示出上述反应的电子的情况:
您最近一年使用:0次
4 . Ⅰ.按要求填写下列内容:
(1)根据下列四种元素(O、H、Ca、C 、Na)写化学式:酸___________ ;碱___________ ;盐___________ 。(各写一种)
Ⅱ.下列物质①Cu;②SO2 ;③NaCl溶液;④HCl;⑤BaSO4固体;⑥NH3;⑦酒精;⑧硫酸溶液;⑨NaOH固体;⑩冰水混合物
(2)其中属于电解质的有___________ ;
(3)属于非电解质的有___________ 。
(1)根据下列四种元素(O、H、Ca、C 、Na)写化学式:酸
Ⅱ.下列物质①Cu;②SO2 ;③NaCl溶液;④HCl;⑤BaSO4固体;⑥NH3;⑦酒精;⑧硫酸溶液;⑨NaOH固体;⑩冰水混合物
(2)其中属于电解质的有
(3)属于非电解质的有
您最近一年使用:0次
5 . 回答下列问题。
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图。请写出NO2(g)和CO(g)反应的热化学方程式___________ 。
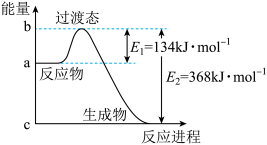
(2)用如图所示装置进行中和热的测定实验。
①仪器A的名称是___________ ,碎泡沫塑料的作用是___________ 。
②理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________ 。
(3)已知下列热化学方程式:
(ⅰ)2H2(g)+O2(g)=2H2O(l) H=−570 kJ∙mol−1,
H=−570 kJ∙mol−1,
(ⅱ)H2(g)+ O2(g)=H2O(g) ΔH=− 241.8kJ∙mol−1,
O2(g)=H2O(g) ΔH=− 241.8kJ∙mol−1,
(ⅲ)C(s)+ O2(g)=CO(g) ΔH=−55.5 kJ∙mol−1,
O2(g)=CO(g) ΔH=−55.5 kJ∙mol−1,
(ⅳ)C(s)+O2(g)=CO2(g) ΔH=−196.5 kJ∙mol−1
回答下列问题:
①H2的燃烧热为___________ ;
②写出CO燃烧热的热化学方程式___________ 。
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图。请写出NO2(g)和CO(g)反应的热化学方程式

(2)用如图所示装置进行中和热的测定实验。

①仪器A的名称是
②理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式
(3)已知下列热化学方程式:
(ⅰ)2H2(g)+O2(g)=2H2O(l)
 H=−570 kJ∙mol−1,
H=−570 kJ∙mol−1,(ⅱ)H2(g)+
 O2(g)=H2O(g) ΔH=− 241.8kJ∙mol−1,
O2(g)=H2O(g) ΔH=− 241.8kJ∙mol−1,(ⅲ)C(s)+
 O2(g)=CO(g) ΔH=−55.5 kJ∙mol−1,
O2(g)=CO(g) ΔH=−55.5 kJ∙mol−1,(ⅳ)C(s)+O2(g)=CO2(g) ΔH=−196.5 kJ∙mol−1
回答下列问题:
①H2的燃烧热为
②写出CO燃烧热的热化学方程式
您最近一年使用:0次
6 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
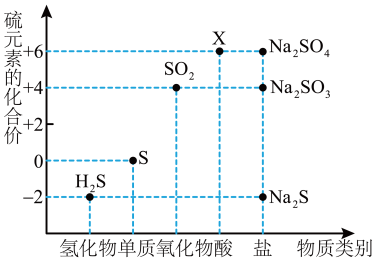
(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的___________ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应_________________ 。
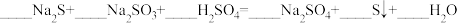
(5)一定条件下,在 密闭容器中发生反应:
密闭容器中发生反应: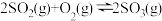 ,开始时加入
,开始时加入 、
、 、
、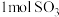 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为___________ ,在 末
末 的浓度为
的浓度为___________ 。若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”)
①升高温度,化学反应速率___________ ;
②再充入 ,化学反应速率
,化学反应速率___________ ;
③将容器体积变为 ,化学反应速率
,化学反应速率___________ 。

(1)X的浓溶液与碳在一定条件下可以发生反应,体现了X的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将
 与
与 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应
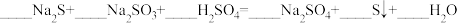
(5)一定条件下,在
 密闭容器中发生反应:
密闭容器中发生反应: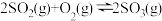 ,开始时加入
,开始时加入 、
、 、
、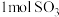 ,在
,在 末测得
末测得 的物质的量是
的物质的量是 ,用
,用 的浓度变化表示反应的平均速率为
的浓度变化表示反应的平均速率为 末
末 的浓度为
的浓度为①升高温度,化学反应速率
②再充入
 ,化学反应速率
,化学反应速率③将容器体积变为
 ,化学反应速率
,化学反应速率
您最近一年使用:0次
名校
解题方法
7 . I.高铁酸钾 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比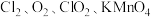 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为: ,该反应中
,该反应中 做
做_______ (填“氧化剂”、“还原剂”)。
(2)湿法制备高铁酸钾的反应体系中有六种微粒: 。
。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②若反应过程中转移了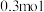 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为_______  。
。
II.将某铁铝合金均分为两份,一份加入足量盐酸,另一份加入足量 溶液,同温同压下产生的气体体积比为5∶4。
溶液,同温同压下产生的气体体积比为5∶4。
(3)样品中铁、铝物质的量之比为_______ 。
 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比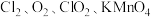 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入 至饱和,使高铁酸钾析出。
至饱和,使高铁酸钾析出。(1)干法制备高铁酸钠的主要反应为:
 ,该反应中
,该反应中 做
做(2)湿法制备高铁酸钾的反应体系中有六种微粒:
 。
。①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了
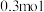 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。II.将某铁铝合金均分为两份,一份加入足量盐酸,另一份加入足量
 溶液,同温同压下产生的气体体积比为5∶4。
溶液,同温同压下产生的气体体积比为5∶4。(3)样品中铁、铝物质的量之比为
您最近一年使用:0次
8 . I.食醋是烹饪美食的调味品,有效成分主要为醋酸。
(1)配制250mL0.1mol/L的醋酸溶液,需5mol/L醋酸溶液的体积为_______ mL(保留到小数点后一位)
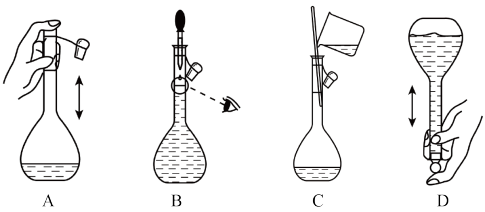
(2)下列关于某容积的容量瓶的操作,正确的是_______ 。
II.人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。
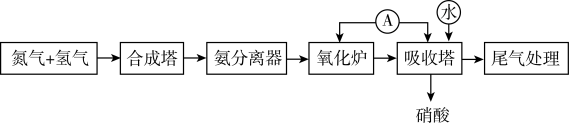
(3)“合成塔”内发生的化学反应中作氧化剂的是_______ (填化学式),金属镁在该氧化剂中燃烧的化学方程式为_______ ,其产物遇水生成的有刺激性气味气体的电子式为_______ ,分子构型为_______ ;“氧化炉”中氨气发生反应的化学方程式为_______ 。
(4)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是_______
(5)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理 为例,该反应中氧化剂与还原剂的物质的量之比为
为例,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(1)配制250mL0.1mol/L的醋酸溶液,需5mol/L醋酸溶液的体积为
(2)下列关于某容积的容量瓶的操作,正确的是

II.人工固氮合成氨,并通过氨氧化法制取硝酸的流程如图所示。

(3)“合成塔”内发生的化学反应中作氧化剂的是
(4)常温下,工业上选择铁或铝作盛装浓硝酸的罐体材料的主要原因是
(5)为了避免生成硝酸的过程中氮的氧化物污染环境,可用氨气处理尾气,将其转化为大气中含有的无害气体,以处理
 为例,该反应中氧化剂与还原剂的物质的量之比为
为例,该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
9 . 填空。
(1)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备 的反应原理如下:
的反应原理如下: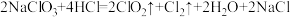
①该反应中,氧化剂是_______ ,氧化剂和还原剂的物质的量之比为_______ ,依据氧化还原反应规律判断,氧化性强弱为
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
② 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中,可将
除去,下列试剂中,可将 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.
d.
(2) 是一种重要的化学品,其合成方法不断发展。早期制备方法如下:
是一种重要的化学品,其合成方法不断发展。早期制备方法如下:
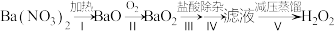
①I为分解反应,产物除BaO、 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是_______ 。
②II为可逆反应,促进该反应正向进行的措施是_______ (写出一种即可)。
③III中生成 ,反应的化学方程式是
,反应的化学方程式是_______ 。
④减压能够降低蒸馏温度,从 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:_______ 。
(1)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备
 的反应原理如下:
的反应原理如下: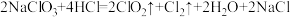
①该反应中,氧化剂是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)②
 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中,可将
除去,下列试剂中,可将 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.
d.
(2)
 是一种重要的化学品,其合成方法不断发展。早期制备方法如下:
是一种重要的化学品,其合成方法不断发展。早期制备方法如下: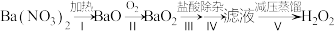
①I为分解反应,产物除BaO、
 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是②II为可逆反应,促进该反应正向进行的措施是
③III中生成
 ,反应的化学方程式是
,反应的化学方程式是④减压能够降低蒸馏温度,从
 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:
您最近一年使用:0次
2022-11-14更新
|
128次组卷
|
2卷引用:天津市河东区2022-2023学年高三上学期期中检测化学试题
解题方法
10 . 现有常温下的六份溶液:①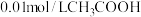 溶液;②
溶液;②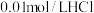 溶液;③
溶液;③ 的氨水;④
的氨水;④ 的
的 溶液;⑤
溶液;⑤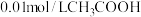 溶液与
溶液与 的氨水等体积混合后所得溶液;⑥
的氨水等体积混合后所得溶液;⑥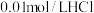 溶液与
溶液与 的
的 溶液等体积混合所得溶液。
溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_______ (选填序号,下同)
(2)若将②、③混合后所得溶液 ,则消耗溶液的体积:②
,则消耗溶液的体积:②_______ ③(选填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)若将①、④溶液按体积比为 ∶
∶ 混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:
混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:_______ 。
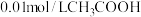 溶液;②
溶液;②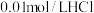 溶液;③
溶液;③ 的氨水;④
的氨水;④ 的
的 溶液;⑤
溶液;⑤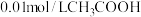 溶液与
溶液与 的氨水等体积混合后所得溶液;⑥
的氨水等体积混合后所得溶液;⑥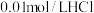 溶液与
溶液与 的
的 溶液等体积混合所得溶液。
溶液等体积混合所得溶液。(1)其中水的电离程度最大的是
(2)若将②、③混合后所得溶液
 ,则消耗溶液的体积:②
,则消耗溶液的体积:② ”、“
”、“ ”或“
”或“ ”)。
”)。(3)若将①、④溶液按体积比为
 ∶
∶ 混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:
混合后,所得溶液中除水分子外的各微粒的浓度由大到小的顺序为:
您最近一年使用:0次



