1 . 高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
【资料】K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
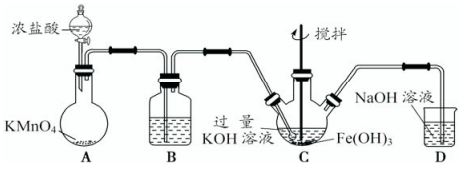
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________ 。
②除杂装置B中的试剂为___________ 。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________ 。
④D为尾气处理装置,发生反应的离子方程式为___________ 。
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
①由方案I中溶液变红可知a中含有___________ 。该离子的产生___________ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________ 。方案Ⅱ得出氧化性:Cl2___________ FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________ 。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________ 。(计算结果保留到0.1%)
【资料】K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。

①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为
②除杂装置B中的试剂为
③C为制备K2FeO4装置,KOH溶液过量的原因是
④D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ用KOH溶液洗涤的目的是
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)
您最近一年使用:0次
2019-02-05更新
|
1427次组卷
|
3卷引用:2019年高考总复习巅峰冲刺-专题08 常见无机物及其应用应试策略
(已下线)2019年高考总复习巅峰冲刺-专题08 常见无机物及其应用应试策略2020届二轮复习 氧化还原反应 专题卷(全国通用)【市级联考】福建省南平市2019届高三上学期第一次质量检查理科综合化学试题
名校
2 . 由下列实验、现象以及由现象推出的结论均正确的是
| 选项 | 实验方法 | 现象 | 结论 |
| A | 向碘水中加入等体积CCl4,振荡后静置。 | 下层接近无色,上层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2晶体是否已氧化变质 |
| C | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,观察到沉淀由白色变为红褐色 | 验证Fe(OH)3的溶解度小于Mg(OH)2 |
| D | 用碎瓷片做催化剂,给石蜡油加热分解,产生的气体通过酸性高锰酸钾溶液 | 酸性高锰酸钾溶液逐渐褪色 | 石蜡油裂解一定生成乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-02-04更新
|
740次组卷
|
3卷引用:2019年秋高三化学复习强化练习—— 难溶电解质的沉淀溶解平衡
名校
3 . Na2SO3是一种重要的化工原料,但较易变质。
(1)实验室中欲检验Na2SO3固体样品是否已经变质,最简单的方法为_________________ 。
(2)某小组同学欲在实验室测定某Na2SO3样品的纯度。
方案一:通过测定生成SO2的质量,可计算mg Na2SO3固体样品的纯度。利用下列装置进行实验。
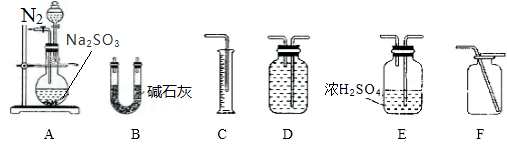
①选择装置A和B进行实验时,为使结果更精确还应选择装置_________________ ,装置A中反应前后通入N2的目的是_________________ 。
②实验结束后,若测得B装置增重了m1 g,则该Na2SO3固体样品的纯度为__________ 。
方案二:利用高锰酸钾溶液滴定亚硫酸钠溶液,实现定量测定。称取a g样品,置于烧杯中;加入适量蒸馏水,使样品溶解,然后配制成250 mL溶液;准确量取25.00 mL溶液置于锥形瓶中;用0. 1 000mol/L的酸性KMnO4溶液进行滴定,经多次滴定,达到滴定终点时,平均消耗20.00 mL溶液。
③反应原理为(用离子方程式表示)_________________ 。
④滴定时,通常不需要加入指示剂,理由是_________________ ;达到滴定终点读取数据时,若俯视液面,则测定结果_________________ (填“偏高”、“偏低”、“无影响”)。
(1)实验室中欲检验Na2SO3固体样品是否已经变质,最简单的方法为
(2)某小组同学欲在实验室测定某Na2SO3样品的纯度。
方案一:通过测定生成SO2的质量,可计算mg Na2SO3固体样品的纯度。利用下列装置进行实验。

①选择装置A和B进行实验时,为使结果更精确还应选择装置
②实验结束后,若测得B装置增重了m1 g,则该Na2SO3固体样品的纯度为
方案二:利用高锰酸钾溶液滴定亚硫酸钠溶液,实现定量测定。称取a g样品,置于烧杯中;加入适量蒸馏水,使样品溶解,然后配制成250 mL溶液;准确量取25.00 mL溶液置于锥形瓶中;用0. 1 000mol/L的酸性KMnO4溶液进行滴定,经多次滴定,达到滴定终点时,平均消耗20.00 mL溶液。
③反应原理为(用离子方程式表示)
④滴定时,通常不需要加入指示剂,理由是
您最近一年使用:0次
4 . 小苏打长期放置在空气中会变质(部分转变为Na2CO3),某研究小组欲测定某小苏打样品中NaHCO3的质量分数,设计如下实验方案:
Ⅰ、加热分解法
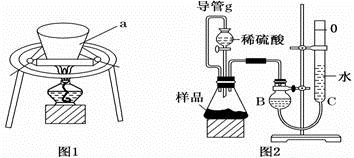
利用图1装置,充分加热小苏打样品。
(1)仪器a的名称为___________________ 。
(2)在实验过程中,需要测量的实验数据有:
①仪器a的质量W1g;
②加热前,仪器a和样品的总质量W2g;
③加热冷却后,仪器a和残留物的总质量W3g。
(3)列出小苏打样品中NaHCO3的质量分数的计算式____________________
Ⅱ、测量气体体积法
利用图2装置,测定反应生成气体的体积。
(1)组装好仪器后,首先进行的操作为_________________________________________ 。
(2)导管g的作用为_________________________________________________________ 。
(3)为了减小实验误差,B、C中最好用________________ 溶液代替水。
(4)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:
①读数时应上下移动C管,使B、C两管液面相平;
②视线与液面最低处相平。
(5)若所取样品的质量为m g,反应前滴定管C的读数为V1 mL,反应结束后滴定管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为_______________ (气体体积均已换算为标准状况下的体积)。
Ⅰ、加热分解法
利用图1装置,充分加热小苏打样品。
(1)仪器a的名称为
(2)在实验过程中,需要测量的实验数据有:
①仪器a的质量W1g;
②加热前,仪器a和样品的总质量W2g;
③加热冷却后,仪器a和残留物的总质量W3g。
(3)列出小苏打样品中NaHCO3的质量分数的计算式
Ⅱ、测量气体体积法
利用图2装置,测定反应生成气体的体积。
(1)组装好仪器后,首先进行的操作为
(2)导管g的作用为
(3)为了减小实验误差,B、C中最好用
(4)待反应结束,气体冷却至室温后,利用图示装置读取气体体积时,应注意的事项有:
①读数时应上下移动C管,使B、C两管液面相平;
②视线与液面最低处相平。
(5)若所取样品的质量为m g,反应前滴定管C的读数为V1 mL,反应结束后滴定管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为
您最近一年使用:0次
真题
5 . 下列实验方案中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
2611次组卷
|
5卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(四川卷)(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (教学案)山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题2015-2016学年浙江省温州中学高一下期末化学试卷
名校
6 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
I.制备碳酸亚铁:装置如图所示。
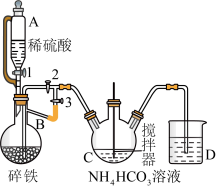
(1)仪器B的名称是____________ 。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:_________ ,然后关闭活塞1,接下来的操作是:_________________ 。C中发生反应的离子方程式为_______________________________ 。
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应方程式为_______________________________________ 。为防止乳酸亚铁变质,在上述体系中还应加入______________________ 。反应结束后,将所得溶液隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥得乳酸亚铁晶体。该晶体存放时应注意_______ 。
III.乳酸亚铁晶体纯度的测量:
(4)两位同学分别用不同方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是________________________________ 。
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+还原为Ce3+),称取6.00g样品配制成250.00mL溶液,取25.00mL用0.10mol·L-1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为__________ (以质量分数表示)。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应方程式为
III.乳酸亚铁晶体纯度的测量:
(4)两位同学分别用不同方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+还原为Ce3+),称取6.00g样品配制成250.00mL溶液,取25.00mL用0.10mol·L-1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
名校
7 . 由下列实验及现象不能推出相应结论的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
| B | 将SO2气体通入到Ba(NO3)2溶液中 | 生成白色沉淀 | 此沉淀是BaSO3 |
| C | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
| D | 燃烧的钠粒放入CO2中 | 燃烧且有白色和黑色颗粒产生 | 黑色颗粒是炭,白色颗粒可能是Na2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-12-23更新
|
324次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——化学综合实验的设计与评价方案
名校
解题方法
8 . 下列各项中操作或现象能达到预期实验目的的是
| 实验目的 | 操作或现象 | |
| A | 分离Fe2O3、Al2O3 | 将混合物置于足量NaOH溶液中,然后依次进行过滤、洗涤、蒸发、灼烧四项操作 |
| B | 确定KCl中是否含有NaCl | 做焰色反应实验,观察焰色是否显黄色 |
| C | 确定FeCl2是否完全变质 | 取少量的FeCl2样品于试管中,逐滴加入酸性高锰酸钾溶液 |
| D | 除去Fe粉中的I2 | 加热使I2升华 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-01-11更新
|
310次组卷
|
4卷引用:河南省商丘市第一高级中学2017-2018学年高一上学期第二次月考化学试题
名校
9 . 下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
(1).A处的化学反应方程式为__________________ ,仪器F的名称为___________________________ 。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________ ,E:______________ 。_____ %(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________ 。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________ 。

(1).A处的化学反应方程式为
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:
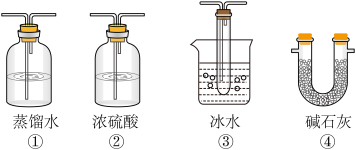
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是
您最近一年使用:0次
2018-03-27更新
|
651次组卷
|
4卷引用:上海市静安区七一中学2018届高考一模化学试题
10 . 研究钠及其化合物有重要意义。
(1)实验室配制0.1mol•L-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是_________ 。
②实验中需用托盘天平(带砝码)称量碳酸钠固体_______________ g。
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有___________ 。
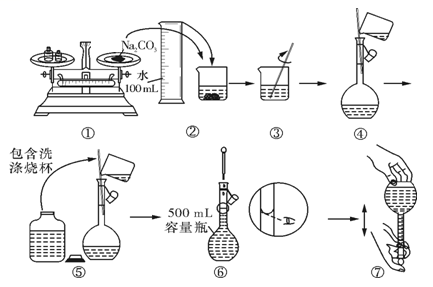
A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是___________ 。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:_________________ (说明操作、现象和结论)。
(1)实验室配制0.1mol•L-1的碳酸钠溶液480mL,根据配制溶液的过程,回答问题:
①实验中除需要托盘天平(带砝码)、药匙、烧杯和玻璃棒外,还需要的其他玻璃仪器是
②实验中需用托盘天平(带砝码)称量碳酸钠固体
③某同学配制 Na2CO3溶液的过程如图所示。你认为该同学的错误有

A.①⑥ B.②④⑦ C.①⑤⑥ D.⑤⑥⑦
④下列实验操作会使配得的溶液浓度偏小的是
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.容量瓶使用前没有经过干燥,瓶中有少量的水
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
(2)过氧化钠保存不当容易变质生成Na2CO3。某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液和水,证明过氧化钠已经部分变质:
您最近一年使用:0次
2017-12-25更新
|
614次组卷
|
4卷引用:黄金30题系列 高一化学 大题易丢分



