名校
解题方法
1 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
【氯化铁】熔点为 ,沸点
,沸点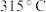 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向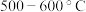 的铁粉中通入氧气来生产无水氯化铁
的铁粉中通入氧气来生产无水氯化铁
【氯化亚铁】熔点为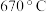 ,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
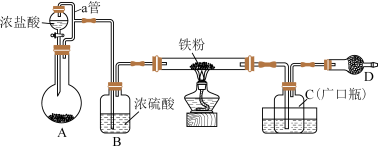
(1)仪器D的名称是___________ ;D中装的药品是碱石灰,其作用是________________ 。
(2)定性分析。取C中的少量产物溶于稀盐酸中配成稀溶液待用。若产物中混有 可用下列试剂中的
可用下列试剂中的_________ (只能选取一种试剂,填序号)进行检测,实验现象是____________________ 。
① 溶液 ②
溶液 ②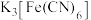 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液 ⑤
溶液 ⑤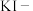 淀粉溶液
淀粉溶液
(3)定量分析。取装置C中的产物,按以下步骤进行测定:①称取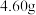 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。则该样品中铁元素的质量分数为
。则该样品中铁元素的质量分数为___________  (结果精确到小数点后两位)。
(结果精确到小数点后两位)。
(4)由(3)定量分析数据得出结论,并提出改进措施:
①用题目所给的装置制得的产物中,铁元素含量_________ (填“相等”、“偏高”或“偏低”),原因是____________________ 。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________________ ,目的是___________________ 。
(5)该活动小组将纯净的无水氯化铁配成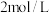 的
的 溶液,现在实验室需要
溶液,现在实验室需要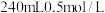 的
的 溶液用于实验,则配制该溶液需要量取
溶液用于实验,则配制该溶液需要量取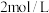 的
的 溶液的体积是
溶液的体积是__________ 。
【氯化铁】熔点为
 ,沸点
,沸点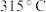 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向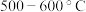 的铁粉中通入氧气来生产无水氯化铁
的铁粉中通入氧气来生产无水氯化铁【氯化亚铁】熔点为
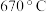 ,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)仪器D的名称是
(2)定性分析。取C中的少量产物溶于稀盐酸中配成稀溶液待用。若产物中混有
 可用下列试剂中的
可用下列试剂中的①
 溶液 ②
溶液 ②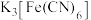 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液 ⑤
溶液 ⑤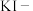 淀粉溶液
淀粉溶液(3)定量分析。取装置C中的产物,按以下步骤进行测定:①称取
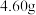 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。则该样品中铁元素的质量分数为
。则该样品中铁元素的质量分数为 (结果精确到小数点后两位)。
(结果精确到小数点后两位)。(4)由(3)定量分析数据得出结论,并提出改进措施:
①用题目所给的装置制得的产物中,铁元素含量
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是
(5)该活动小组将纯净的无水氯化铁配成
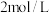 的
的 溶液,现在实验室需要
溶液,现在实验室需要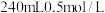 的
的 溶液用于实验,则配制该溶液需要量取
溶液用于实验,则配制该溶液需要量取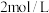 的
的 溶液的体积是
溶液的体积是
您最近一年使用:0次
名校
解题方法
2 . 草酸亚铁晶体( ,
,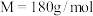 )呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
气体产物成分的探究。小组成员采用如图装置进行实验:
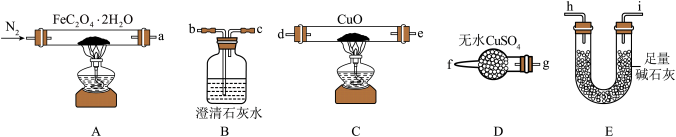
(1)按照气流从左到右的方向,上述装置的接口顺序为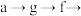
___________ →尾气处理装置(仪器可重复使用)。
(2)检查装置气密性后,先通入一段时间 ,其目的为
,其目的为___________ 。
(3)实验证明了气体产物中含有CO,依据的实验现象为___________ 。
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为___________ 。
(5)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为 ,现以
,现以 溶液为显色剂,该显色物质化学式为
溶液为显色剂,该显色物质化学式为___________ ,其颜色为___________ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀 中,配成250mL溶液;
中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 ,再用
,再用 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。
(6)步骤2中滴定终点的现象为___________ ;步骤3中加入锌粉的目的为___________ 。
(7)草酸亚铁晶体样品的纯度为___________ 。
 ,
,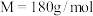 )呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。Ⅰ.纯净草酸亚铁晶体热分解产物的探究
气体产物成分的探究。小组成员采用如图装置进行实验:

(1)按照气流从左到右的方向,上述装置的接口顺序为
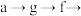
(2)检查装置气密性后,先通入一段时间
 ,其目的为
,其目的为(3)实验证明了气体产物中含有CO,依据的实验现象为
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(5)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为
 ,现以
,现以 溶液为显色剂,该显色物质化学式为
溶液为显色剂,该显色物质化学式为Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有
 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:步骤1:称取mg草酸亚铁晶体样品并溶于稀
 中,配成250mL溶液;
中,配成250mL溶液;步骤2:取上述溶液25.00mL,用
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀
 ,再用
,再用 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。(6)步骤2中滴定终点的现象为
(7)草酸亚铁晶体样品的纯度为
您最近一年使用:0次
3 . 化学上常用燃烧法确定有机物的组成,如下图所示装置是用燃烧法确定烃或烃的含氧衍生物Y分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
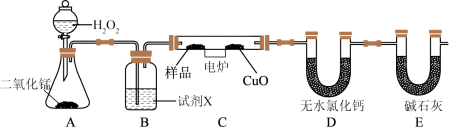
完成下列问题:
(1)A中发生反应的化学方程式为_______ ;
(2)B装置的作用是_______ ;
(3)准确称取1.8g烃的含氧衍生物Y的样品,经充分燃烧后,D管质量增加1.08g,E管质量增加2.64g,则该有机物的实验式是_______ ;
(4)实验测得Y的蒸气密度是同温同压下氢气密度的45倍,则Y的分子式为_______ ;
(5)1molY分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,Y的核磁共振氢谱如下(峰面积之比为1:1:1:3),则Y的结构简式为_______ ;

(6)本实验在测定时存在误差,某同学认为需要再增加一个干燥管,该干燥管应该连接在装置_______ 后面(填写A、B、C、D、E),其作用为_______ 。

完成下列问题:
(1)A中发生反应的化学方程式为
(2)B装置的作用是
(3)准确称取1.8g烃的含氧衍生物Y的样品,经充分燃烧后,D管质量增加1.08g,E管质量增加2.64g,则该有机物的实验式是
(4)实验测得Y的蒸气密度是同温同压下氢气密度的45倍,则Y的分子式为
(5)1molY分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,Y的核磁共振氢谱如下(峰面积之比为1:1:1:3),则Y的结构简式为

(6)本实验在测定时存在误差,某同学认为需要再增加一个干燥管,该干燥管应该连接在装置
您最近一年使用:0次
名校
4 . 某兴趣小组设计如图所示实验装置,验证 与
与 能否发生反应。已知
能否发生反应。已知 能被CO还原得到黑色的金属Pd。请回答下列问题:
能被CO还原得到黑色的金属Pd。请回答下列问题:

(1)猜想: 与
与 能发生反应。理论依据是
能发生反应。理论依据是___________ 。
(2)装置B中的试剂是___________ ,作用是___________ 。
(3)将样品装入硬质玻璃管中,再按如下顺序进行实验操作。
①打开 和
和 ,通入
,通入 待E中出现
待E中出现___________ 时,再点燃酒精灯,此操作的目的是___________ ;②熄灭酒精灯;③冷却到室温;④关闭 和
和 。
。
(4)加热D装置中硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体产生。
③F中试管内壁有黑色沉淀产生。
产生上述现象②中黑色固体的原因是___________ 。
(5)探究硬质玻璃管中固体产物中钠元素的存在形式
假设一:白色固体是 ;假设二:白色固体是
;假设二:白色固体是 ;假设三:白色固体是
;假设三:白色固体是 和
和 的混合物。请完成下列实验设计,验证上述假设;
的混合物。请完成下列实验设计,验证上述假设;
步骤1:将硬质玻璃管中的固体产物溶于水后,过滤;
步骤2:往步骤1所得滤液中加入足量的___________ 溶液产生白色沉淀,过滤;
步骤3:往步骤2所得滤液中滴加几滴酚酞试液,滤液不变红色。
结论:假设一成立。
 与
与 能否发生反应。已知
能否发生反应。已知 能被CO还原得到黑色的金属Pd。请回答下列问题:
能被CO还原得到黑色的金属Pd。请回答下列问题:
(1)猜想:
 与
与 能发生反应。理论依据是
能发生反应。理论依据是(2)装置B中的试剂是
(3)将样品装入硬质玻璃管中,再按如下顺序进行实验操作。
①打开
 和
和 ,通入
,通入 待E中出现
待E中出现 和
和 。
。(4)加热D装置中硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠燃烧产生黄色火焰,硬质玻璃管中有大量黑色和白色固体产生。
③F中试管内壁有黑色沉淀产生。
产生上述现象②中黑色固体的原因是
(5)探究硬质玻璃管中固体产物中钠元素的存在形式
假设一:白色固体是
 ;假设二:白色固体是
;假设二:白色固体是 ;假设三:白色固体是
;假设三:白色固体是 和
和 的混合物。请完成下列实验设计,验证上述假设;
的混合物。请完成下列实验设计,验证上述假设;步骤1:将硬质玻璃管中的固体产物溶于水后,过滤;
步骤2:往步骤1所得滤液中加入足量的
步骤3:往步骤2所得滤液中滴加几滴酚酞试液,滤液不变红色。
结论:假设一成立。
您最近一年使用:0次
2023-05-15更新
|
592次组卷
|
2卷引用:广东省广州中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
5 . 某化学小组为测定样品有机物G 的组成和结构,设计如图实验装置:
① 搭建装置,检测装置的气密性;
② 准确称取4.3g样品有机物G放于电炉中;
③ 打开K1;关闭K2,让A装置反应一段时间后,再关闭K1打开K2;
④ 电炉通电,充分燃烧后产物只有水和二氧化碳,且被充分吸收;
⑤ 样品完全燃烧后,电炉断电,继续让A装置反应一段时间后再停止;
⑥ 测定装置D质量增加2.7g,U形管E质量增加8.8g;
⑦ 拿样品G去相关机构做质谱、红外光谱和核磁共振氢谱,谱图如下所示。
(1)装双氧水的仪器的名称是______ 。装置F 中碱石灰的作用是______ 。
(2)有机物G的分子式为______ ,结构简式为 _______ 。
(3)有机物G的一些同分异构体能与碳酸氢钠溶液发生反应有气体生成,写出符合条件的G的所有同分异构体的结构简式(不考虑立体异构)______ 。
(4)下列说法正确的是

① 搭建装置,检测装置的气密性;
② 准确称取4.3g样品有机物G放于电炉中;
③ 打开K1;关闭K2,让A装置反应一段时间后,再关闭K1打开K2;
④ 电炉通电,充分燃烧后产物只有水和二氧化碳,且被充分吸收;
⑤ 样品完全燃烧后,电炉断电,继续让A装置反应一段时间后再停止;
⑥ 测定装置D质量增加2.7g,U形管E质量增加8.8g;
⑦ 拿样品G去相关机构做质谱、红外光谱和核磁共振氢谱,谱图如下所示。

(1)装双氧水的仪器的名称是
(2)有机物G的分子式为
(3)有机物G的一些同分异构体能与碳酸氢钠溶液发生反应有气体生成,写出符合条件的G的所有同分异构体的结构简式(不考虑立体异构)
(4)下列说法正确的是
| A.若删除装置A,改成通空气,对分子式测定实验结果无影响 |
| B.装置B和D 都可以用装有碱石灰的装置E 替代 |
| C.如果没有CuO,可能导致装置E所测物质的质量偏低 |
| D.如果没有步骤⑤,导致测量的分子式中氧元素含量偏高 |
您最近一年使用:0次
2023-04-19更新
|
364次组卷
|
2卷引用:广东省广州市三校(广附、铁一、广外)2022-2023学年高二下学期期末考试化学试题
2010·广东·一模
6 . 钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式___________________________ 。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是__________ 。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含___________ ;
假设2:该漂白粉全部变质,只含___________ ;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
②设计实验方案,进行实验。
请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)_____________________________
(1)请写出工业上用电解方法制取钠的化学方程式
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含
假设2:该漂白粉全部变质,只含
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
②设计实验方案,进行实验。
请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中, | |
| ② | ||
| ③ | ||
您最近一年使用:0次
7 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃。回答下列问题:
(1)导气管b的作用___________ 。
(2)装置A中发生的化学反应的化学方程式为___________ 。
(3)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得___________ ,然后将滤液___________ 、过滤、洗涤、干燥可得另一产物。

(4)产品中可能混有少量 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是___________ ,检验产品中含有 的实验方法:取少量样品于试管中,加入适量水溶解
的实验方法:取少量样品于试管中,加入适量水溶解___________ 。【可选试剂:稀硝酸、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、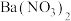 溶液】
溶液】
 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)导气管b的作用
(2)装置A中发生的化学反应的化学方程式为
(3)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得

(4)产品中可能混有少量
 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是 的实验方法:取少量样品于试管中,加入适量水溶解
的实验方法:取少量样品于试管中,加入适量水溶解 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、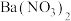 溶液】
溶液】
您最近一年使用:0次
解题方法
8 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定硫酸铜晶体中结晶水的含量 | 加热盛有硫酸铜晶体的坩埚,待固体全部呈白色后将坩埚放置在铁架台上冷却,再称重 |
| B | 检验Fe(NO3)2中是否混有Fe(NO3)3 | 取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液 |
| C | 验证石蜡油分解的产物不仅是烷烃 | 将热分解的气体产物通入溴的四氯化碳溶液 |
| D | 制备无水氯化铝 | 在硬质玻璃管中灼烧AlCl3·6H2O,同时通入干燥空气气流保护 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-20更新
|
641次组卷
|
2卷引用:广东省四校2024届高三第一次联考化学试题
9 . 铁有两种氯化物, 都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为 306℃,沸点为 315℃;易吸收空气中的水分而潮解。工业上采用向 500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁: 熔点为 670℃ ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)装置 A 中,用 KMnO4与浓盐酸反应制取氯气, 写出反应的离子方程式_______
(2)装置中导管 a 的作用是_______ 。C 放置在盛冷水的水槽中, 冷水浴的作用是_______ 。
(3)仪器 D 中装的药品可以是_______ (填序号)。
(4)定性分析。取装置 C 中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_______ 进行检测。(填序号,试剂不组合使用)
(5)定量分析。取装置 C 中的产物,按以下步骤进行测定: ①称取 4.60 g 产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量 NaOH 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。写出加入足量H2O2 溶液中发生反应的离子方程式_______ ,计算该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论, 并提出改进措施。
①对比氯化铁中铁元素的质量分数为 34.46%,说明含有FeCl2 杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是_______ 。
氯化铁:熔点为 306℃,沸点为 315℃;易吸收空气中的水分而潮解。工业上采用向 500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁: 熔点为 670℃ ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)装置 A 中,用 KMnO4与浓盐酸反应制取氯气, 写出反应的离子方程式
(2)装置中导管 a 的作用是
(3)仪器 D 中装的药品可以是
| A.P2 O5 | B.碱石灰 | C.CaCl2 | D.NaOH |
| A.KSCN 溶液 | B.酸性KMnO4溶液 | C.H2 O2溶液 | D.KI-淀粉溶液 |
(6)由(5)定量分析数据得出结论, 并提出改进措施。
①对比氯化铁中铁元素的质量分数为 34.46%,说明含有FeCl2 杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是
您最近一年使用:0次
10 . 如图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题。

(1)试管①中发生反应的化学方程式为_______ 。
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有_______ 、SO2具有_______ 、漂白性。⑥中反应的离子方程式为_______ 。
(3)下列说法正确的是_______ (填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是_______ (填字母)。
a.HCl b.Fe2O3 c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为_______ 。
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为_______ g·L-1(假设尾气中其他气体不与酸性KMnO4溶液反应)。

(1)试管①中发生反应的化学方程式为
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有
(3)下列说法正确的是
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是
a.HCl b.Fe2O3 c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为
您最近一年使用:0次



