1 . 实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:

Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___ ,消膜泡的作用是__ 。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__ 。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__ 。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I- I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___ 、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____ (写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____ (填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___ 。

Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-
 I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值
您最近一年使用:0次
2020-05-27更新
|
635次组卷
|
7卷引用:广东省执信中学2020届高三2月月考理科综合化学试题
广东省执信中学2020届高三2月月考理科综合化学试题安徽省合肥市2020届高三下学期“停课不停学”线上考试化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编四川省成都市树德中学2021届高三上学期10月阶段性测理综化学试题四川省眉山市仁寿第二中学2021届高三上学期第四次诊断化学试题(已下线)专题10 化学实验基础——备战2021年高考化学纠错笔记河北省武邑中学2021届高三二模化学试题
2 . 苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4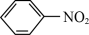 +9Fe+4H2O
+9Fe+4H2O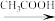 4
4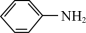 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
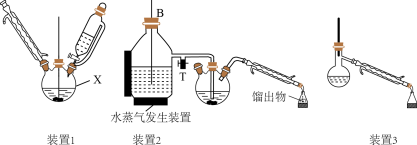
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__ 。
(2)仪器X的名称是__ ;加入硝基苯时,“逐滴加入”的目的是__ 。
(3)分离提纯过程中加入NaCl固体的作用是__ 。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__ ;装置2中长导管B的作用是__ 。
(5)萃取分液操作过程中要远离明火和热源,原因是__ 。
(6)温度T的范围为__ ,实验结束得到6.0mL产物,则苯胺的产率为__ (保留三位有效数字)。
4
 +9Fe+4H2O
+9Fe+4H2O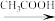 4
4 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
| 名称 | 密度(g•mL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
| 硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
| 苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
| 乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为
(2)仪器X的名称是
(3)分离提纯过程中加入NaCl固体的作用是
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是
(5)萃取分液操作过程中要远离明火和热源,原因是
(6)温度T的范围为
您最近一年使用:0次
2020-02-03更新
|
573次组卷
|
2卷引用:广东省2020届高三调研考试理科综合化学试卷(一)
名校
3 . 我国科学家屠呦呦因成功从黄花蒿中提取抗疟药物青蒿素而获得2015年诺贝尔奖。某实验小组对青蒿素的提取和组成进行了探究。
【查阅资料】
①青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,温度达60℃以上易分解。
②乙醇的沸点为78℃,乙醚的沸点为34.5℃。
③青蒿素的结构如图所示 .提取青蒿素
.提取青蒿素
从黄花蒿中提取青蒿素的流程如图所示: 需要用到的玻璃仪器有:
需要用到的玻璃仪器有:___________ 、烧杯、玻璃棒。
(2)操作 中用水浴加热而不用酒精灯直接加热的原因是
中用水浴加热而不用酒精灯直接加热的原因是___________ 。
(3)操作 的分离提纯方法名称是
的分离提纯方法名称是___________ 。
(4)提取过程温度不能超过60℃,否则青蒿素会失去药效,推测___________ (填官能团结构式)被破坏。
 .燃烧法测定分子组成
.燃烧法测定分子组成
实验室用如图所示装置测定青蒿素的分子组成。这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。 的电子式为
的电子式为___________ , 是
是___________ 分子(填“极性”或“非极性”)。
②装置D中所盛固体可以是___________ (用对应符号填空)。
a.无水 b.浓硫酸 c.胆矾 d.碱石灰
b.浓硫酸 c.胆矾 d.碱石灰
③F的作用是___________ 。
(6)将28.2g青蒿素样品放在电炉中,缓缓通入氧气数分钟后,再充分燃烧,精确测定装置D和E实验前后的质量。测得的数据如表所示,通过质谱仪测得青蒿素的相对分子质量是282,结合以下数据计算,得出青蒿素的分子式为___________ 。
【查阅资料】
①青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,温度达60℃以上易分解。
②乙醇的沸点为78℃,乙醚的沸点为34.5℃。
③青蒿素的结构如图所示

 .提取青蒿素
.提取青蒿素从黄花蒿中提取青蒿素的流程如图所示:

 需要用到的玻璃仪器有:
需要用到的玻璃仪器有:(2)操作
 中用水浴加热而不用酒精灯直接加热的原因是
中用水浴加热而不用酒精灯直接加热的原因是(3)操作
 的分离提纯方法名称是
的分离提纯方法名称是(4)提取过程温度不能超过60℃,否则青蒿素会失去药效,推测
 .燃烧法测定分子组成
.燃烧法测定分子组成实验室用如图所示装置测定青蒿素的分子组成。这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。

 的电子式为
的电子式为 是
是②装置D中所盛固体可以是
a.无水
 b.浓硫酸 c.胆矾 d.碱石灰
b.浓硫酸 c.胆矾 d.碱石灰③F的作用是
(6)将28.2g青蒿素样品放在电炉中,缓缓通入氧气数分钟后,再充分燃烧,精确测定装置D和E实验前后的质量。测得的数据如表所示,通过质谱仪测得青蒿素的相对分子质量是282,结合以下数据计算,得出青蒿素的分子式为
| 装置 | 实验前/g | 实验后/g |
| D | 42.6 | 62.4 |
| E | 100.2 | 166.2 |
您最近一年使用:0次
4 . Ⅰ.碳酸锰(MnCO3)作为一种重要的化工原料,主要用于制备软磁铁氧体、锰硅合金等。科研人员利用含锰废水(主要含Mn2+,以及少量Fe2+、Fe3+、Ni2+、Cu2+等)制备MnCO3,设计流程图如下:
(1)从氧化还原反应角度,分析选用H2O2的优点___________ 。
(2)除杂1时调节溶液pH为5.2,则滤渣1的成分为Fe(OH)3、___________ 。若两步即可从滤渣1中回收得到铁红,则所需试剂为___________ 。
A. NaOH溶液﹑B.氨水C.稀盐酸D.二氧化碳
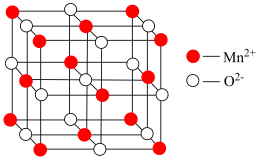
(3)将MnCO3受热分解,其固体产物的晶胞(立方体结构)如下图所示。则该固体产物的化学式为___________ 。
(4)经测定,该晶胞中最近两个Mn2+的距离为xcm。则该固体产物的密度为___________ g/cm3。(设NA为阿伏加德罗常数,用含x和NA的代数式表示) + 4
+ 4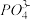 +2H+=2[Mn(PO4)2]3-+
+2H+=2[Mn(PO4)2]3-+ +H2C、[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-
+H2C、[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-
(5)N-苯代邻氨基苯甲酸及其酸根与Fe形成的配合物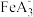 ,如下图所示。
,如下图所示。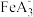 中Fe2+的配位数为
中Fe2+的配位数为___________ 。上述滴定终点的现象为___________ 。
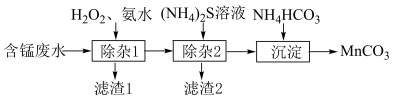
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Ni(OH)2 | Mn(OH)2 |
| 沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.2 | 9.8 |
(1)从氧化还原反应角度,分析选用H2O2的优点
(2)除杂1时调节溶液pH为5.2,则滤渣1的成分为Fe(OH)3、
A. NaOH溶液﹑B.氨水C.稀盐酸D.二氧化碳
(3)将MnCO3受热分解,其固体产物的晶胞(立方体结构)如下图所示。则该固体产物的化学式为
(4)经测定,该晶胞中最近两个Mn2+的距离为xcm。则该固体产物的密度为
 + 4
+ 4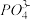 +2H+=2[Mn(PO4)2]3-+
+2H+=2[Mn(PO4)2]3-+ +H2C、[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-
+H2C、[Mn(PO4)2]3-+Fe2+=Mn2++[Fe(PO4)2]3-(5)N-苯代邻氨基苯甲酸及其酸根与Fe形成的配合物
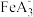 ,如下图所示。
,如下图所示。
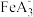 中Fe2+的配位数为
中Fe2+的配位数为
您最近一年使用:0次
名校
解题方法
5 . 金属钴( )在国防工业中有着重要应用。某矿石中含钴的氧化物(
)在国防工业中有着重要应用。某矿石中含钴的氧化物( 、
、 )研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:
)研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:
钴 为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括
为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括 、
、 和
和 。+3价的钴盐通常不稳定,
。+3价的钴盐通常不稳定, 可以将
可以将 氧化,致使其在水溶液中不能稳定存在。
氧化,致使其在水溶液中不能稳定存在。
(1) 不能在水溶液中稳定存在的原因是
不能在水溶液中稳定存在的原因是 具有
具有___________ 性,在该反应中得到的氧化产物是___________ 。
(2)酸浸时某矿石(含 、
、 )会发生如下反应,请将反应方程式补充完整:
)会发生如下反应,请将反应方程式补充完整:
反应Ⅰ:___________ 
反应Ⅱ:___________ 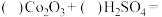
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
①本实验研究了哪些因素对钴元素浸出率的影响___________ ;
②根据上表数据,其他条件不变,温度升高,钻元素的浸出率___________ (填“增大”、“减小”或“不变”);
③酸浸时,加入 固体的作用是
固体的作用是___________
(4)酸浸后的溶液经沉钴得到草酸钴晶体 (相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:
(相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:
阶段Ⅱ生成的固体氧化物仅有一种,该固体氧化物的化学式___________ (填化学式)。
 )在国防工业中有着重要应用。某矿石中含钴的氧化物(
)在国防工业中有着重要应用。某矿石中含钴的氧化物( 、
、 )研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:
)研究人员在实验室用硫酸酸没的方法提取钴元素,制备高纯度的钴的氧化物。研究人员查阅资料如下:钴
 为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括
为灰色金属,有强磁性。钴元素化合物中常见价态有+2、+3价。钴元素能与氧元素组成化合物,包括 、
、 和
和 。+3价的钴盐通常不稳定,
。+3价的钴盐通常不稳定, 可以将
可以将 氧化,致使其在水溶液中不能稳定存在。
氧化,致使其在水溶液中不能稳定存在。(1)
 不能在水溶液中稳定存在的原因是
不能在水溶液中稳定存在的原因是 具有
具有(2)酸浸时某矿石(含
 、
、 )会发生如下反应,请将反应方程式补充完整:
)会发生如下反应,请将反应方程式补充完整:反应Ⅰ:

反应Ⅱ:
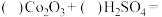
(3)为探究最佳提取条件,将矿石在一定条件下酸浸4小时,测量钴元素的浸出率部分数据如下:
| 编号 | 矿石用量/g | 硫酸用量/g |  用量/g 用量/g | 温度/℃ | 钴元素浸出率/% |
| 1 | 85.71 | 12.62 | 0 | 85 | 56.39 |
| 2 | 85.71 | 6.31 | 0 | 85 | 49.98 |
| 3 | 85.71 | 6.31 | 0 | 65 | 43.33 |
| 4 | 85.71 | 6.31 | 0.43 | 65 | 73.95 |
| 5 | 85.71 | 6.31 | 0.86 | 65 | 74.77 |
②根据上表数据,其他条件不变,温度升高,钻元素的浸出率
③酸浸时,加入
 固体的作用是
固体的作用是(4)酸浸后的溶液经沉钴得到草酸钴晶体
 (相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:
(相对分子质量为183),煅烧草酸钴晶体可以得到高纯度钴的氧化物,其分解过程分为三个阶段,对应温度和失重率(失重率=对应温度下样品失重的质量÷初始样品的质量×100%)如下表所示:| 热分解阶段 | Ⅰ | Ⅱ | Ⅲ |
| 热分解温度/℃ | 150-210 | 290-320 | 890-920 |
| 失重率/% | 19.67 | 36.43 | 2.91 |
您最近一年使用:0次
解题方法
6 . 下列操作可以达到实验目的的是
| A.将Fe(OH) 2露置在空气中加热灼烧可以得到FeO |
| B.为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉 |
| C.要证明某溶液中不含Fe3+而可能含Fe2+,先加氯水,再加少量的KSCN溶液 |
| D.将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水可检验气体产物中的CO2 |
您最近一年使用:0次
2016-12-09更新
|
209次组卷
|
2卷引用:2014-2015广东省揭阳市第一中学高一上学期期末考试化学试卷
10-11高三上·广东梅州·阶段练习
7 . 钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式___________________________ 。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是__________ 。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含___________ ;
假设2:该漂白粉全部变质,只含___________ ;
假设3:该漂白粉部分变质,_____________________ 。
②设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
(1)请写出工业上用电解方法制取钠的化学方程式
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含
假设2:该漂白粉全部变质,只含
假设3:该漂白粉部分变质,
②设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中, | |
| ② | ||
| ③ | ||
您最近一年使用:0次
名校
解题方法
8 . 无水FeCl3是常用的芳香烃取代反应的催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水FeCl3的实验装置如图所示:

E和G用来收集产物。回答下列问题:
(1)写出实验室制备氯气的离子方程式:___________ 。
(2)在E、G处收集产物是利用了FeCl3___________ 的性质。盛有P2O5固体C仪器名称___________ 。
(3)实验过程中若F处出现堵塞,则在盛有氢氧化钠溶液B处可观察到的现象是___________ 。可通过___________ (填简单操作),使实验能继续进行。
(4)I中反应的离子方程式为___________ 。
(5)某同学用5.60 g干燥铁粉制得无水FeCl3样品14.30 g,该次实验的产率是___________ 。
(6)实验室中还常用SOCl2与FeCl3·6H2O晶体共热制备无水FeCl3,其化学反应方程式为___________ 。检验水合氯化铁原料中存在FeCl2的试剂和现象分别是___________ 、___________ 。

E和G用来收集产物。回答下列问题:
(1)写出实验室制备氯气的离子方程式:
(2)在E、G处收集产物是利用了FeCl3
(3)实验过程中若F处出现堵塞,则在盛有氢氧化钠溶液B处可观察到的现象是
(4)I中反应的离子方程式为
(5)某同学用5.60 g干燥铁粉制得无水FeCl3样品14.30 g,该次实验的产率是
(6)实验室中还常用SOCl2与FeCl3·6H2O晶体共热制备无水FeCl3,其化学反应方程式为
您最近一年使用:0次
9 . 高铁酸钾(K2FeO4)是一种高效无毒的新型绿色消毒剂,制备流程如下:
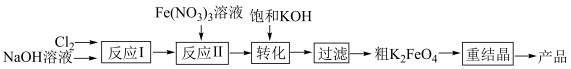
资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ. 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定
(1)K2FeO4具有强氧化性,其中铁元素的化合价为_____ 价。
(2)反应I目的是制备NaClO,请写出其反应化学方程式___________ 。
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为________ (写化学式),生产1mol Na2FeO4转移的电子数为___ NA。
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式_______ 。
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用_______ (选“乙醇”或“水”)洗涤、干燥,可得纯度较高的K2FeO4。
(6)K2FeO4与稀硫酸反应:4 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
_______ (列出计算式即可)。 (物质的纯度
(物质的纯度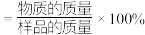 )
)

资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ.
 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定(1)K2FeO4具有强氧化性,其中铁元素的化合价为
(2)反应I目的是制备NaClO,请写出其反应化学方程式
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用
(6)K2FeO4与稀硫酸反应:4
 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
 (物质的纯度
(物质的纯度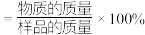 )
)
您最近一年使用:0次
名校
解题方法
10 . ClO2气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将ClO2制备成NaClO2固体以便运输和贮存,具体流程如图:
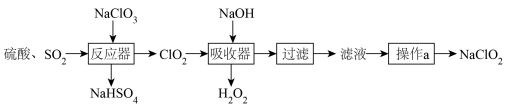
(1)反应器中,SO2的作用是________ (填“氧化剂”或“还原剂”)。
(2)吸收器中反应时有使带火星的木条复燃的气体产生,该反应的化学方程式是_______ 。
(3)已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2。操作a具体步骤:________ ,干燥,得到NaClO2固体。(可选用的试剂:无水乙醇)
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和H2SO4溶液发生如下反应:NaClO2+4KI+2H2SO4=2H2O+2I2+NaCl+2K2SO4,杂质不与KI反应。
③以淀粉作指示剂,再加入0.2000mol•L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为40.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
计算该样品中NaClO2的纯度________ 。
(5)以NaClO2和稀盐酸为原料制备ClO2进行水处理,其原理如下:NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,但在上述过程中会发生副反应NaClO2+4HCl=NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因:________ 。

(1)反应器中,SO2的作用是
(2)吸收器中反应时有使带火星的木条复燃的气体产生,该反应的化学方程式是
(3)已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2。操作a具体步骤:
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和H2SO4溶液发生如下反应:NaClO2+4KI+2H2SO4=2H2O+2I2+NaCl+2K2SO4,杂质不与KI反应。
③以淀粉作指示剂,再加入0.2000mol•L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为40.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
计算该样品中NaClO2的纯度
(5)以NaClO2和稀盐酸为原料制备ClO2进行水处理,其原理如下:NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,但在上述过程中会发生副反应NaClO2+4HCl=NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因:
您最近一年使用:0次
2023-10-24更新
|
188次组卷
|
2卷引用:广东省广州市第七中学2023-2024学年高一上学期11月期中考试化学试题



