1 . 生活中离不开化学,家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分:
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面( );⑤小苏打(
);⑤小苏打( );⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
);⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
回答下列问题:
(1)明矾的化学式为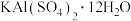 ,属于
,属于______ (填“纯净物”或“混合物”)。
(2)小苏打的主要成分 ,在水溶液的电离方程式:
,在水溶液的电离方程式:______ 。
(3)厨卫用品的主要成分(括号内的物质)是电解质的有______ (填序号,下同),是非电解质的有______ ,能够导电的有______ 。
(4)⑥和⑦不能混用,原理为______ (用化学反应方程式表示)。
(5)已知 和碱反应生成
和碱反应生成 ,故
,故 为酸性氧化物,
为酸性氧化物, 与酸反应生成
与酸反应生成 ,故
,故 为碱性氧化物.
为碱性氧化物. 可以形成两种盐:
可以形成两种盐: 、
、 (微溶物),则
(微溶物),则 属于
属于______ 氧化物(填“酸性”或“碱性”、“两性”、“不成盐”).写出 与浓NaOH溶液反应的化学反应方程式:
与浓NaOH溶液反应的化学反应方程式:______ 。
①食盐(NaCl);②料酒(乙醇);③食醋(乙酸);④碱面(
 );⑤小苏打(
);⑤小苏打( );⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)
);⑥84消毒液(NaClO);⑦洁厕灵(HCl);⑧净水剂(明矾);⑨铁锅(Fe)回答下列问题:
(1)明矾的化学式为
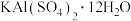 ,属于
,属于(2)小苏打的主要成分
 ,在水溶液的电离方程式:
,在水溶液的电离方程式:(3)厨卫用品的主要成分(括号内的物质)是电解质的有
(4)⑥和⑦不能混用,原理为
(5)已知
 和碱反应生成
和碱反应生成 ,故
,故 为酸性氧化物,
为酸性氧化物, 与酸反应生成
与酸反应生成 ,故
,故 为碱性氧化物.
为碱性氧化物. 可以形成两种盐:
可以形成两种盐: 、
、 (微溶物),则
(微溶物),则 属于
属于 与浓NaOH溶液反应的化学反应方程式:
与浓NaOH溶液反应的化学反应方程式:
您最近一年使用:0次
解题方法
2 . “五步产盐法”起源于山西运城,其生产工艺主要以集卤蒸发为主,盐池的浓卤水经过箩、调配、储卤、结晶、铲出五个步骤即可得到纯度高且颗粒大的食盐.《天工开物》中也有类似描述,“凡引水种盐,春间即为之,久则水成赤色.待夏秋之交,南风大起,则一宵结成.……但成盐时日,与不借南风则大异也”.已知:
运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量 和
和 ,将其溶解后依次加入
,将其溶解后依次加入_________ 、 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.
(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是___________________ (填操作名称,下同),“冬产硝”(主要成分为 )的原理是
)的原理是_______________ .“五步产盐法”最独特的妙处之一是在出盐前于卤水中浇洒适量淡水,由此得到的食盐晶体“质坚、粒大”且纯度较高,此法得到的食盐晶体粒大、质坚的原因是__________________________________________________ .
(3)经提纯得到的 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为________________________________ .
(4) 与
与 混合溶液中通入
混合溶液中通入 即可制得
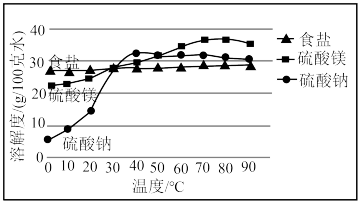
即可制得 ,装置如图所示:
,装置如图所示:
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
①仪器A的名称是____________ .
②锥形瓶内的反应大致可分为三步进行:
第一步:
第二步:
第三步:生成 反应的化学方程式为
反应的化学方程式为_________________ ,该实验过程中 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是_________________________ .

运城盐池卤水中三种主要成分溶解度随温度变化示意图
回答下列问题:
(1)为除去食盐中可能含有的少量
 和
和 ,将其溶解后依次加入
,将其溶解后依次加入 溶液后过滤,再加入适量的盐酸,蒸发结晶.
溶液后过滤,再加入适量的盐酸,蒸发结晶.(2)运城盐池素有“夏产盐冬产硝”的说法,“夏产盐”的原理是
 )的原理是
)的原理是(3)经提纯得到的
 与煤粉(主要成分为C)高温还原可制取一种重要的化工原料
与煤粉(主要成分为C)高温还原可制取一种重要的化工原料 ,同时生成无污染气体,该反应的化学方程式为
,同时生成无污染气体,该反应的化学方程式为(4)
 与
与 混合溶液中通入
混合溶液中通入 即可制得
即可制得 ,装置如图所示:
,装置如图所示:
实验过程如下:打开分液漏斗活塞慢慢滴入70%的硫酸溶液,使产生的气体均匀通入
 与
与 混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.
混合溶液,随着气体的通入逐渐有大量硫单质析出.继续通入气体,反应约一小时,溶液pH约等于7时(注意不要小于7),停止通气.①仪器A的名称是
②锥形瓶内的反应大致可分为三步进行:
第一步:

第二步:

第三步:生成
 反应的化学方程式为
反应的化学方程式为 的比例太低会导致产率过低的原因是
的比例太低会导致产率过低的原因是
您最近一年使用:0次
3 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
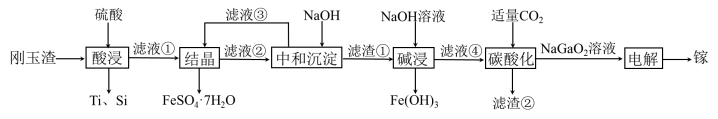
回答下列问题:
(1)镓原子结构示意图为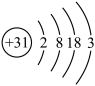 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
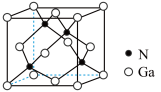
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为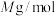 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为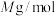 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
4 . 铅(Pb)元素的主要化合价有+2价和+4价,溶液中铅为+2价(Pb2+或 ,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
(1)Pb3O4 俗名红丹,在涂料工业中用作防锈颜料,Pb3O4中+2价铅和+4价铅的原子个数之比为
(2)Pb、PbO2可用于制造铅蓄电池,铅蓄电池工作时的反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中还原产物为
(3)工业上利用铅渣(主要成分是PbO、Pb,以及少量不溶于硝酸的杂质)生产PbSO4的流程如图:
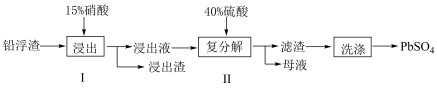
已知步骤1有NO产生,试写出Pb与硝酸反应的化学方程式
(4)血铅是指血液中铅元素的含量。血铅超标会引起机体的神经系统、血液系统、消化系统的一系列异常表现。某人血液中铅的浓度为0.4μg/mL,若转化为物质的量浓度为
您最近一年使用:0次
名校
解题方法
5 . 以硫铁矿(主要成分为 )为原料制备硫酸亚铁晶体(
)为原料制备硫酸亚铁晶体( )的工艺流程如下:
)的工艺流程如下:

回答下列问题:
(1)焙烧后得到的固体主要成分为 ,其中铁元素化合价为
,其中铁元素化合价为______ ;写出焙烧过程主要反应的化学方程式________________________
(2)试剂 是
是______ (写化学式)
(3)“过滤”操作中需要使用的玻璃仪器有玻璃棒、____________ 和烧杯
(4)从还原得到的溶液中获得硫酸亚铁晶体( )的操作是
)的操作是____________ ,____________ ,过滤和洗涤等
(5)可以用标准浓度的酸性 溶液来测定产品中
溶液来测定产品中 的纯度,反应中
的纯度,反应中 被还原成
被还原成 。该反应中氧化剂与氧化产物的物质的量之比为
。该反应中氧化剂与氧化产物的物质的量之比为____________
 )为原料制备硫酸亚铁晶体(
)为原料制备硫酸亚铁晶体( )的工艺流程如下:
)的工艺流程如下:
回答下列问题:
(1)焙烧后得到的固体主要成分为
 ,其中铁元素化合价为
,其中铁元素化合价为(2)试剂
 是
是(3)“过滤”操作中需要使用的玻璃仪器有玻璃棒、
(4)从还原得到的溶液中获得硫酸亚铁晶体(
 )的操作是
)的操作是(5)可以用标准浓度的酸性
 溶液来测定产品中
溶液来测定产品中 的纯度,反应中
的纯度,反应中 被还原成
被还原成 。该反应中氧化剂与氧化产物的物质的量之比为
。该反应中氧化剂与氧化产物的物质的量之比为
您最近一年使用:0次
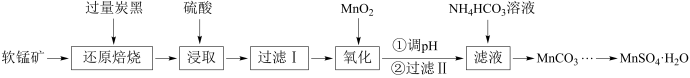
6 . 以软锰矿(主要成分是MnO2,还含有Fe2O3、SiO2、CuO、CaO等少量杂质)为主要原料制备硫酸锰晶体的工艺流程如图:
已知:①还原焙烧的主反应为 ;
;
②Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化;
③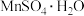 溶于1份冷水、0.6份沸水,不溶于乙醇。
溶于1份冷水、0.6份沸水,不溶于乙醇。
回答下列问题:
(1)还原焙烧时软锰矿要粉碎,其目的是___________ 。过滤I得到的滤渣主要成分的化学式是___________ 。
(2)“氧化”时发生反应的离子方程式为___________ 。
(3)调溶液pH时,可使用的物质是___________ (填一种即可,写化学式)。
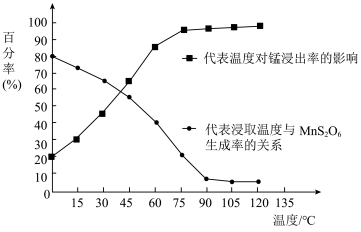
(4)“浸取”时,反应中往往有副产物MnS2O6生成,温度对浸取反应的影响如图所示,为减少MnS2O6的生成,“浸取”的适宜温度是___________ ;过滤Ⅱ所得的滤液中加入NH4HCO3溶液时,温度不宜太高的原因是___________ 。
(5)向滤液中加入NH4HCO3溶液生成MnCO3的同时会产生一种无色无味的气体,写出其离子方程式___________ 。
(6)获得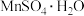 后常用乙醇洗涤,主要目的是
后常用乙醇洗涤,主要目的是___________ ;洗涤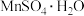 的操作为
的操作为___________ 。

已知:①还原焙烧的主反应为
 ;
;②Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化;
③
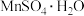 溶于1份冷水、0.6份沸水,不溶于乙醇。
溶于1份冷水、0.6份沸水,不溶于乙醇。回答下列问题:
(1)还原焙烧时软锰矿要粉碎,其目的是
(2)“氧化”时发生反应的离子方程式为
(3)调溶液pH时,可使用的物质是
(4)“浸取”时,反应中往往有副产物MnS2O6生成,温度对浸取反应的影响如图所示,为减少MnS2O6的生成,“浸取”的适宜温度是

(5)向滤液中加入NH4HCO3溶液生成MnCO3的同时会产生一种无色无味的气体,写出其离子方程式
(6)获得
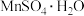 后常用乙醇洗涤,主要目的是
后常用乙醇洗涤,主要目的是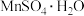 的操作为
的操作为
您最近一年使用:0次
名校
解题方法
7 . 采用废铁屑还原软锰矿(软锰矿主要成分是 ,还含少量
,还含少量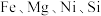 等元素的氧化物杂质)来制备
等元素的氧化物杂质)来制备 的工艺流程如图所示:
的工艺流程如图所示: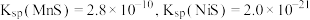 ;
;
②假设溶液中某离子浓度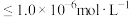 时,该离子沉淀完全;
时,该离子沉淀完全;
③室温时生成氢氧化物的 见下表。
见下表。
回答下列问题:
(1)“酸浸”时,为提高浸取效率,可采取的措施有_____ (任写一点)。
(2)在“浸出液”中加入 时发生反应的离子方程式为
时发生反应的离子方程式为_____ 。
(3)“除杂”过程中有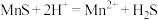 反应发生,其平衡常数
反应发生,其平衡常数 与
与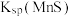 、
、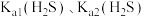 的代数关系式为
的代数关系式为
_____ 。加入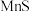 “除杂”后的滤渣为
“除杂”后的滤渣为_____ (填化学式),“除杂”后的滤液中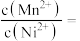
_____ 。
(4)“沉锰”过程中温度和 对
对 和
和 沉淀率的影响如图所示。则“沉锰”的合适条件是
沉淀率的影响如图所示。则“沉锰”的合适条件是_____ 。“沉锰”时发生反应的离子方程式为_____ 。
 ,还含少量
,还含少量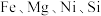 等元素的氧化物杂质)来制备
等元素的氧化物杂质)来制备 的工艺流程如图所示:
的工艺流程如图所示: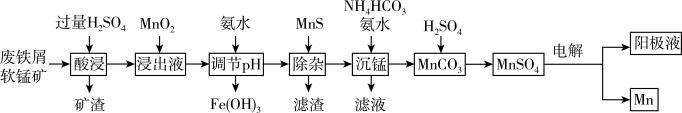
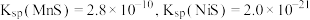 ;
;②假设溶液中某离子浓度
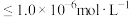 时,该离子沉淀完全;
时,该离子沉淀完全;③室温时生成氢氧化物的
 见下表。
见下表。| 离子 |  |  |  |  |  |
开始沉淀的 | 7.5 | 1.8 | 8.1 | 7.7 | 8.3 |
完全沉淀的 | 9.7 | 3 | 9.4 | 8.4 | 9.8 |
(1)“酸浸”时,为提高浸取效率,可采取的措施有
(2)在“浸出液”中加入
 时发生反应的离子方程式为
时发生反应的离子方程式为(3)“除杂”过程中有
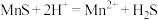 反应发生,其平衡常数
反应发生,其平衡常数 与
与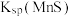 、
、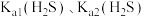 的代数关系式为
的代数关系式为
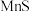 “除杂”后的滤渣为
“除杂”后的滤渣为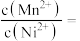
(4)“沉锰”过程中温度和
 对
对 和
和 沉淀率的影响如图所示。则“沉锰”的合适条件是
沉淀率的影响如图所示。则“沉锰”的合适条件是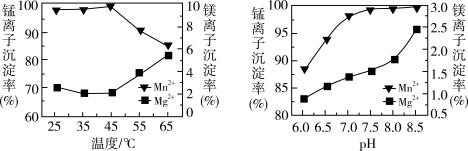
您最近一年使用:0次
2024-03-11更新
|
147次组卷
|
3卷引用:广东省佛山市顺德区勒流中学、均安中学、龙江中学等十五校2023-2024学年高二上学期12月联考化学试题
名校
解题方法
8 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
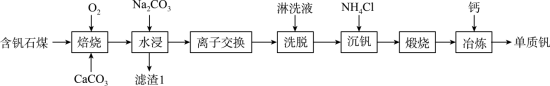
已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
②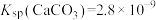 ,
,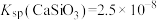 ,
,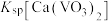 远大于
远大于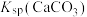 。
。
回答下列问题:
(1)基态Fe3+的价电子排布式为___________ 。
(2)为了提高“焙烧”效率,可采取的措施有___________ 、___________ 。
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)3,写出V2O4转化为Ca(VO3)3的化学方程式:___________ 。
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有___________ ;“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是___________ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)
(5)“离子交换”与“洗脱”可表示为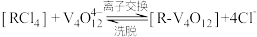 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,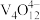 为VO
为VO 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用___________ 。
(6)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是___________ 。
(7)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
| 金属离子 | Fe3+ | Mg2+ | Al3+ | Mn2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
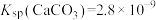 ,
,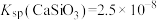 ,
,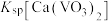 远大于
远大于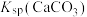 。
。回答下列问题:
(1)基态Fe3+的价电子排布式为
(2)为了提高“焙烧”效率,可采取的措施有
(3)“焙烧”时,V2O3、V2O4都转化为Ca(VO3)3,写出V2O4转化为Ca(VO3)3的化学方程式:
(4)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
(5)“离子交换”与“洗脱”可表示为
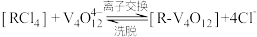 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,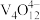 为VO
为VO 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(6)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是
(7)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
解题方法
9 . Co2O3主要用作颜料、釉料及磁性材料,一种利用含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO,Fe2O3、CaO、SiO2)制备氧化钴(Co2O3)的工艺流程如图所示。
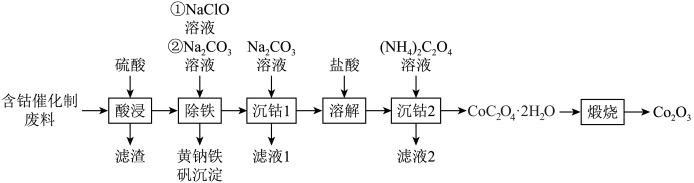
已知:ⅰ.黄钠铁矾的化学式为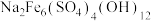 ;
;
ⅱ.金属钴与铁具有相似的化学性质;
ⅲ.氧化性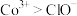 。
。
回答下列问题:
(1)钴元素基态原子的电子排布式为_______ 。
(2)“酸浸”时滤渣的主要成分为_______ (填化学式)。
(3)“除铁”时先加入NaClO溶液,主要发生反应的离子方程式为_______ ,再加入 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
(4)常温下,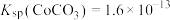 ,
,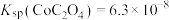 ,向
,向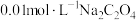 溶液中加入足量
溶液中加入足量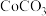 固体,能否生成
固体,能否生成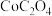 沉淀?
沉淀?_______ (通过计算说明)。
(5)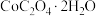 在空气中加热煅烧得到
在空气中加热煅烧得到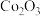 的化学方程式为
的化学方程式为_______ 。
(6)(a)钴被称为无机配合物之王,配合物 的中心离子的配位数为
的中心离子的配位数为_______ 。
(b)钴的一种化合物的晶胞结构如图所示。
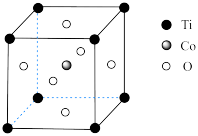
①晶体中一个Ti周围与其最近的O的个数为_______ 。
②在该晶胞中氧、钴、钛的粒子个数比为_______ 。

已知:ⅰ.黄钠铁矾的化学式为
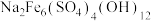 ;
;ⅱ.金属钴与铁具有相似的化学性质;
ⅲ.氧化性
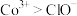 。
。回答下列问题:
(1)钴元素基态原子的电子排布式为
(2)“酸浸”时滤渣的主要成分为
(3)“除铁”时先加入NaClO溶液,主要发生反应的离子方程式为
 溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。(4)常温下,
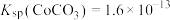 ,
,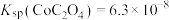 ,向
,向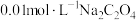 溶液中加入足量
溶液中加入足量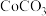 固体,能否生成
固体,能否生成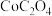 沉淀?
沉淀?(5)
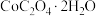 在空气中加热煅烧得到
在空气中加热煅烧得到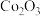 的化学方程式为
的化学方程式为(6)(a)钴被称为无机配合物之王,配合物
 的中心离子的配位数为
的中心离子的配位数为(b)钴的一种化合物的晶胞结构如图所示。

①晶体中一个Ti周围与其最近的O的个数为
②在该晶胞中氧、钴、钛的粒子个数比为
您最近一年使用:0次
10 . 某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
【查阅资料】i. 在酸性条件下发生反应:
在酸性条件下发生反应: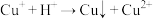 (未配平);
(未配平);
ii.氧化性: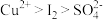 ;
;
iii.部分含铜物质的性质如下表:
【实验准备】用亚硫酸钠固体配制 溶液:
溶液:
(1)实验用到的玻璃仪器有烧杯、量筒、玻璃棒、___________ (填仪器名称),检验亚硫酸钠溶液在空气中是否变质所需的试剂为___________ 。
【合理预测】
(2)上表“预测1”中的实验现象为_______ 。“预测2”中反应的离子方程式为________ 。
【实验探究】
实验1:

经合理分析推测实验1中沉淀的组成:
(3)探究该橙黄色沉淀的组成:
①利用控制变量法测定其组成需要消除溶液中 的影响,应使用溶液(填化学式)代替实验1中
的影响,应使用溶液(填化学式)代替实验1中 溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
某小组同学为验证橙黄色沉淀的组成,分别进行以下实验:
②取洗涤干净后的橙黄色沉淀用稀硫酸溶解,若观察到___________ 的实验现象,可推出橙黄色沉淀中一定含有+1价的铜元素。
③
该实验现象___________ (填“能”或“不能”)证明橙黄色沉淀中含有 和
和 。
。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。【查阅资料】i.
 在酸性条件下发生反应:
在酸性条件下发生反应: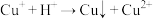 (未配平);
(未配平);ii.氧化性:
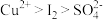 ;
;iii.部分含铜物质的性质如下表:
| 物质 | 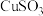 | 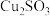 |  | 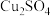 |
| 难溶于水的固体 | 可溶于水的固体 | |||
| 颜色 | 绿色 | 红色 | 白色 | 灰色 |
 溶液:
溶液:(1)实验用到的玻璃仪器有烧杯、量筒、玻璃棒、
【合理预测】
| 实验现象(不需要填写溶液颜色变化) | 反应类型 | |
| 预测1 | ___________ | 复分解反应 |
| 预测2 | 生成红色沉淀 | 氧化还原反应 |
| 预测3 | 生成白色沉淀 |
(2)上表“预测1”中的实验现象为
【实验探究】
实验1:

经合理分析推测实验1中沉淀的组成:
| 白色沉淀 | 橙黄色沉淀 |
 | 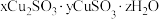 |
(3)探究该橙黄色沉淀的组成:
①利用控制变量法测定其组成需要消除溶液中
 的影响,应使用溶液(填化学式)代替实验1中
的影响,应使用溶液(填化学式)代替实验1中 溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。某小组同学为验证橙黄色沉淀的组成,分别进行以下实验:
②取洗涤干净后的橙黄色沉淀用稀硫酸溶解,若观察到
③

该实验现象
 和
和 。
。
您最近一年使用:0次



