1 . 氧化亚铁固体可溶于足量稀硝酸,其中稀硝酸所体现的作用是
| A.氧化性和酸性 | B.还原性和酸性 | C.只有氧化性 | D.只有酸性 |
您最近一年使用:0次
2 . 高锰酸钾在不同的条件下发生的反应如下:
①MnO4-+5e-+8H+=Mn2++4H2O ②MnO4-+3e-+2H2O=MnO2↓+4OH-
(1)从上述两个反应中可以看出高锰酸根离子被还原的产物受溶液的__________ 影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为________ →__________ 。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法不正确的是___________ 。
A.氧化性,PbO2>KMnO4B.还原性:PbO2>KMnO4C.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比 为3 : 2,完成下列化学方程式(横线上填系数,括号内填物质):
①_____ KMnO4+_____ K2S+ ______ ( ) =____ K2MnO4+_____ K2SO4+____ S↓+_________ ( ) 。
②若生成6.4g单质硫,反应过程中转移电子的物质的量为____________ 。
①MnO4-+5e-+8H+=Mn2++4H2O ②MnO4-+3e-+2H2O=MnO2↓+4OH-
(1)从上述两个反应中可以看出高锰酸根离子被还原的产物受溶液的
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法不正确的是
A.氧化性,PbO2>KMnO4B.还原性:PbO2>KMnO4C.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比 为3 : 2,完成下列化学方程式(横线上填系数,括号内填物质):
①
②若生成6.4g单质硫,反应过程中转移电子的物质的量为
您最近一年使用:0次
2016-12-09更新
|
252次组卷
|
6卷引用:2015-2016学年吉林省实验中学高二下期末化学试卷
2015-2016学年吉林省实验中学高二下期末化学试卷2015-2016学年河南省五岳八校高二下期末联考化学试卷2016-2017学年河北省冀州中学高一上11月月考化学卷云南省河口县第一中学2019届高三上学期期中考试理科综合化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)云南省麻栗坡民族中学2019-2020学年高三上学期期末考试化学试题
解题方法
3 . 硫代硫酸钠 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。
资料:i.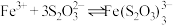 (紫黑色)
(紫黑色) 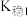 ;
;
ii. 为白色沉淀,
为白色沉淀,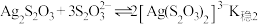 ;
;
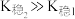 。
。
回答下列问题:
探究一
(1)根据实验①的现象,初步判断最终 被
被 还原为
还原为 ,通过
,通过_____ (填操作、试剂和现象),进一步证实生成了 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为_____ 。
(2)氧化性: (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是_____ 。
探究二
(3)实验③中黑色沉淀可能为 或
或 。通过
。通过_____ (填操作、试剂和现象),进一步证实生成了 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为_____ 。
(4)将 溶液逐滴滴入
溶液逐滴滴入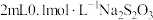 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为_____ 。
 是重要的化工原料,易溶于水。实验室中探究
是重要的化工原料,易溶于水。实验室中探究 与某些金属阳离子的氧化还原反应情况。
与某些金属阳离子的氧化还原反应情况。资料:i.
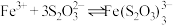 (紫黑色)
(紫黑色) 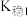 ;
;ii.
 为白色沉淀,
为白色沉淀,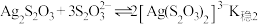 ;
;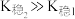 。
。回答下列问题:
探究一
| 装置 | 编号 | 试剂X | 实验现象 |
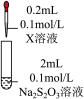 | ① | 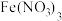 溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 一段时间后,生成白色沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 ,通过
,通过 。进一步实验证明
。进一步实验证明 最终被氧化为
最终被氧化为 ,该过程总反应的化学方程式为
,该过程总反应的化学方程式为(2)氧化性:
 (同浓度)。但实验②中
(同浓度)。但实验②中 未发生氧化还原反应的原因是
未发生氧化还原反应的原因是探究二
| 装置 | 编号 | 试剂X | 实验现象 |
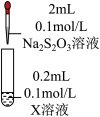 | ③ |  溶液 溶液 | 立即生成白色絮状沉淀,沉淀很快变为黑色沉淀。 |
 或
或 。通过
。通过 。白色絮状沉淀变为黑色沉淀的化学方程式为
。白色絮状沉淀变为黑色沉淀的化学方程式为(4)将
 溶液逐滴滴入
溶液逐滴滴入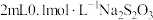 溶液中至过量,该过程可观察到的实验现象为
溶液中至过量,该过程可观察到的实验现象为
您最近一年使用:0次
名校
解题方法
4 . 镓(Ga)被誉为“电子工业脊梁”,高纯GaAs(砷化)可用于芯片制造,以砷化镓废料(含80%GaAs、8%Fe2O3、7%Al2O3和5%CaCO3)制备高纯GaAs的流程如下:
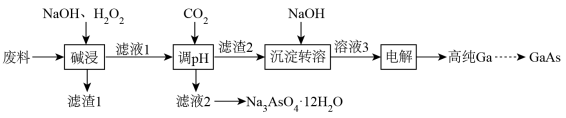
已知:常温下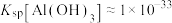

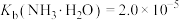

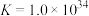
回答下列问题:
(1)Ga与Al同族,位于元素周期表的________ 区。写出Ga的核外电子排布式________ 。
(2)滤渣1的主要成分有___________ 。
(3)通入CO2调节pH的目的是___________ 。
(4)为探究“沉淀转溶”中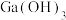 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应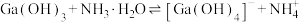 的平衡常数
的平衡常数
___________ 。
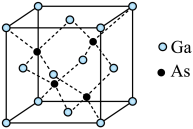
(5)产物纯度分析:将得到的产物进行X射线衍射测试。通过X射线衍射得到的数据与已知晶胞的边长进行对照,可以测定制备的GaAs是否纯净。GaAs的立方晶胞如图所示,其中Ga的配位数为___________ ;该晶体密度为 ,设
,设 为阿伏加德罗常数的值,晶胞边长为
为阿伏加德罗常数的值,晶胞边长为___________ pm。
(6)芯片制造中的一种刻蚀过程如图所示,其中致密保护膜可阻止H2O2刻蚀液与下层GaAs反应。
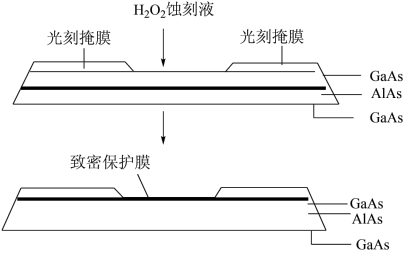
①刻蚀后AlAs层会形成砷酸(H3AsO4)和一种常见的致密氧化物保护膜。写出反应的化学方程式是___________ 。
②有研究人员提出可以用过硫酸钾K2S2O8代替H2O2做刻蚀液, 的结构如图:
的结构如图:
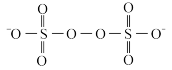
推测氧化性:
___________ H2O2 (填“>”“<”或“=”)。
资料:O-O键越易断裂,过氧化物的氧化性越强。

已知:常温下
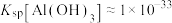


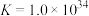
回答下列问题:
(1)Ga与Al同族,位于元素周期表的
(2)滤渣1的主要成分有
(3)通入CO2调节pH的目的是
(4)为探究“沉淀转溶”中
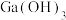 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应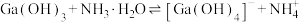 的平衡常数
的平衡常数
(5)产物纯度分析:将得到的产物进行X射线衍射测试。通过X射线衍射得到的数据与已知晶胞的边长进行对照,可以测定制备的GaAs是否纯净。GaAs的立方晶胞如图所示,其中Ga的配位数为
 ,设
,设 为阿伏加德罗常数的值,晶胞边长为
为阿伏加德罗常数的值,晶胞边长为
(6)芯片制造中的一种刻蚀过程如图所示,其中致密保护膜可阻止H2O2刻蚀液与下层GaAs反应。

①刻蚀后AlAs层会形成砷酸(H3AsO4)和一种常见的致密氧化物保护膜。写出反应的化学方程式是
②有研究人员提出可以用过硫酸钾K2S2O8代替H2O2做刻蚀液,
 的结构如图:
的结构如图:
推测氧化性:

资料:O-O键越易断裂,过氧化物的氧化性越强。
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.为比较 和
和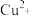 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察___________ 的快慢,定性比较得出结论;
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是___________ 。
(3)查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: 和
和___________ 。
Ⅱ.某化学实验小组利用酸性 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
(4)实验中反应的离子方程式为___________ 。
(5)
___________ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是___________ 。
(6)2号实验中,用 表示的反应速率为
表示的反应速率为___________ (反应后溶液的总体积变化忽略不计)。
 和
和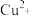 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的
 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从 和
和Ⅱ.某化学实验小组利用酸性
 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | x |
  溶液/mL 溶液/mL | 5 | 10 | 10 | 5 |
  溶液/mL 溶液/mL | 5 | 5 | 10 | 10 |
| 时间/s | 20 | 10 | 5 | ― |
(5)

(6)2号实验中,用
 表示的反应速率为
表示的反应速率为
您最近一年使用:0次
名校
解题方法
6 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:
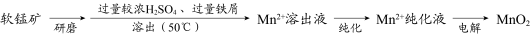
资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示。
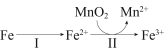
i、II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii、若Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2,后加入NH3·H2O,调溶液pH≈5。说明试剂加入顺序及调节pH的原因:___________ 。
(3)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,加热至充分反应,再用c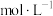 KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为dL。(已知:MnO2及MnO
KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为dL。(已知:MnO2及MnO 均被还原为Mn2+。相对分子质量:MnO286.94;Na2C2O4134.0)
均被还原为Mn2+。相对分子质量:MnO286.94;Na2C2O4134.0)
产品纯度为___________ (用质量分数表示)。
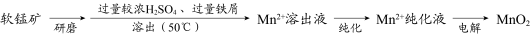
资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH
| Fe3+ | Al3+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨。目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示。
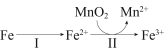
i、II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii、若Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2,后加入NH3·H2O,调溶液pH≈5。说明试剂加入顺序及调节pH的原因:
(3)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,加热至充分反应,再用c
 KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为dL。(已知:MnO2及MnO
KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为dL。(已知:MnO2及MnO 均被还原为Mn2+。相对分子质量:MnO286.94;Na2C2O4134.0)
均被还原为Mn2+。相对分子质量:MnO286.94;Na2C2O4134.0)产品纯度为
您最近一年使用:0次
7 . Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。
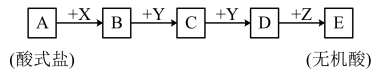
(1)当X是盐酸时则A中的阴离子的电子式_______ 。
(2)当X是氢氧化钠溶液时,C的化学式_______ 。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______ 。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______ (填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下:
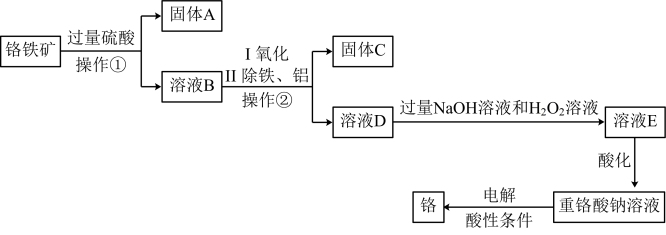
查阅资料得知:在碱性条件下,某些氧化剂能将 氧化为
氧化为 。
。
①“操作②”是_______ 。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______ 。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______ 。

(1)当X是盐酸时则A中的阴离子的电子式
(2)当X是氢氧化钠溶液时,C的化学式
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和
 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下:
查阅资料得知:在碱性条件下,某些氧化剂能将
 氧化为
氧化为 。
。①“操作②”是
②工业上可用固体A制取粗硅,写出反应的化学方程式:
③写出溶液D转化为溶液E过程中反应的离子方程式:
您最近一年使用:0次
2022-08-14更新
|
380次组卷
|
2卷引用:河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题
名校
解题方法
8 . 工业上利用无隔膜NaCl电解法脱除低温工业废气中 NO,可有效减少对空气的污染。
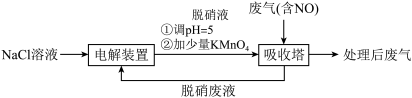
(1)电解NaCl溶液获得脱硝液(含NaClO)分两步进行,第二步反应的离子方程式是___________ 。
(2)脱硝液中含氯微粒的物质的量分数(δ)随pH的分布如图1所示;其他条件相同,NO转化率随脱硝液初始pH(用稀盐酸调节)的变化如图2所示:
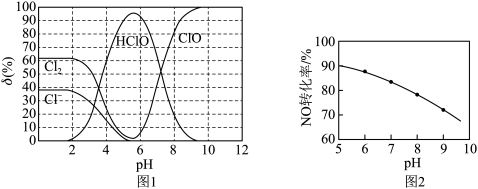
①吸收塔中NO转化为NO 的离子反应方程式是
的离子反应方程式是___________ 。
②脱硝液pH=5时,NO转化率最高,随pH升高,NO转化率会降低,原因是___________ 。
(3)吸收塔中采用气、液逆流(废气从吸收塔底进入,脱硝液从吸收塔顶喷淋)的方式吸收废气,目的是___________ 。
(4)KMnO4可以增加脱硝液的氧化性,显著提高脱硝效率,但脱硝废液电解时无法实现KMnO4的再生,需在脱硝液中及时补充。推测KMnO4无法再生的原因:
Ⅰ. MnO 在阴极直接得到电子被还原;
在阴极直接得到电子被还原;
Ⅱ.脱硝废液中NO 在阴极得电子转化为NO
在阴极得电子转化为NO ,NO
,NO 还原MnO
还原MnO 。
。
进行实验验证:
资料: MnO 为紫红色,MnO
为紫红色,MnO 为墨绿色,MnO
为墨绿色,MnO 与MnO
与MnO 混合溶液颜色会变暗。
混合溶液颜色会变暗。
①实验1中阴极颜色变暗,阴极电极反应式是___________ 。
②根据实验1和2可得到的结论是___________ 。

(1)电解NaCl溶液获得脱硝液(含NaClO)分两步进行,第二步反应的离子方程式是
(2)脱硝液中含氯微粒的物质的量分数(δ)随pH的分布如图1所示;其他条件相同,NO转化率随脱硝液初始pH(用稀盐酸调节)的变化如图2所示:

①吸收塔中NO转化为NO
 的离子反应方程式是
的离子反应方程式是②脱硝液pH=5时,NO转化率最高,随pH升高,NO转化率会降低,原因是
(3)吸收塔中采用气、液逆流(废气从吸收塔底进入,脱硝液从吸收塔顶喷淋)的方式吸收废气,目的是
(4)KMnO4可以增加脱硝液的氧化性,显著提高脱硝效率,但脱硝废液电解时无法实现KMnO4的再生,需在脱硝液中及时补充。推测KMnO4无法再生的原因:
Ⅰ. MnO
 在阴极直接得到电子被还原;
在阴极直接得到电子被还原;Ⅱ.脱硝废液中NO
 在阴极得电子转化为NO
在阴极得电子转化为NO ,NO
,NO 还原MnO
还原MnO 。
。进行实验验证:
| 装置 | 实验 | 复合电解液 | 实验现象 |
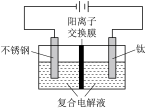 | 1 | 0.66mmol/LKMnO4+ 0.8547mol/LNaCl混合电解液( pH=7) | 阳极溶液颜色基本不变; 阴极溶液颜色逐渐变暗; 25min电解液未呈现墨绿色, pH=12.1 |
| 2 | 0.66mmol/L KMnO4+0.8547mol/L NaCl 、NaNO3混合电解液( pH=7) | 阳极溶液颜色基本不变; 阴极溶液颜色逐渐变暗;25 min电解液呈现墨绿色, pH=12.4 |
 为紫红色,MnO
为紫红色,MnO 为墨绿色,MnO
为墨绿色,MnO 与MnO
与MnO 混合溶液颜色会变暗。
混合溶液颜色会变暗。①实验1中阴极颜色变暗,阴极电极反应式是
②根据实验1和2可得到的结论是
您最近一年使用:0次
2022-04-16更新
|
455次组卷
|
5卷引用:湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题
名校
9 . 肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________ L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________ 。
②实验中加热煮沸的目的是___________ 。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
⑴生产1000 g质量分数为25.6%的肼溶液最少需要
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(
 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点( 被还原为Cr3+),消耗该溶液20.00 mL。
被还原为Cr3+),消耗该溶液20.00 mL。①用H2O2与次氯酸钠反应的离子方程式为
②实验中加热煮沸的目的是
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。
您最近一年使用:0次
2017-04-16更新
|
615次组卷
|
4卷引用:江苏省淮阴中学2019-2020学年高二下学期期末考试化学试题
名校
10 . 锡、钨、锦和稀土并称为中国的四大战略资源,工业上主要以锡石(主要成分为 ,还含有
,还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
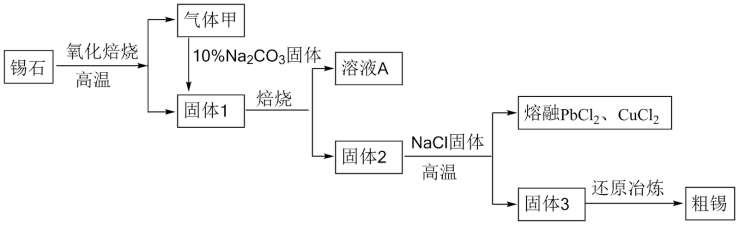
查阅资料可知:钨酸钙( )难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
)难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
回答下列问题:
(1)氧化焙烧时加快反应速率的方法有___________ (任填一种),气体甲的主要成分是___________ (填化学式)。
(2)在固体1中加入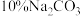 溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是
溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是___________ (填化学式);固体2中Pb元素的化合价为___________ 。
(3)固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为___________ 。
(4) 具有强还原性,在酸性条件易被空气中的
具有强还原性,在酸性条件易被空气中的 氧化,其反应的离子方程式为
氧化,其反应的离子方程式为___________ 。
(5)通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到 溶液,再加入过量的
溶液,再加入过量的 溶液转化为
溶液转化为 ,然后用已知浓度的
,然后用已知浓度的 溶液去滴定生成的
溶液去滴定生成的 。现有粗锡样品0.613g,经上述各步反应后,共用去
。现有粗锡样品0.613g,经上述各步反应后,共用去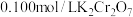 溶液16.0mL,则该粗锡样品中锡的质量分数为
溶液16.0mL,则该粗锡样品中锡的质量分数为___________ (假设杂质不参与反应)。
 ,还含有
,还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
查阅资料可知:钨酸钙(
 )难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
)难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。回答下列问题:
(1)氧化焙烧时加快反应速率的方法有
(2)在固体1中加入
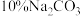 溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是
溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(3)固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为
(4)
 具有强还原性,在酸性条件易被空气中的
具有强还原性,在酸性条件易被空气中的 氧化,其反应的离子方程式为
氧化,其反应的离子方程式为(5)通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到
 溶液,再加入过量的
溶液,再加入过量的 溶液转化为
溶液转化为 ,然后用已知浓度的
,然后用已知浓度的 溶液去滴定生成的
溶液去滴定生成的 。现有粗锡样品0.613g,经上述各步反应后,共用去
。现有粗锡样品0.613g,经上述各步反应后,共用去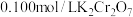 溶液16.0mL,则该粗锡样品中锡的质量分数为
溶液16.0mL,则该粗锡样品中锡的质量分数为
您最近一年使用:0次
2021-07-22更新
|
172次组卷
|
2卷引用:江西省新余市第四中学2021-2022学年高二上学期开学考试化学试题



