名校
解题方法
1 . 我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2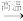 Si3N4+CO;
Si3N4+CO;
(1)N2分子的结构式为___________ 。
(2)配平上述反应的化学方程式___________ 。
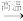 Si3N4+CO;
Si3N4+CO;(1)N2分子的结构式为
(2)配平上述反应的化学方程式
您最近半年使用:0次
名校
解题方法
2 . 炼铁的原理是利用CO还原铁的氧化物。以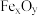 代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:___________ 。
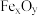 代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
代表铁的氧化物,写出高温下CO冶炼铁的化学方程式:
您最近半年使用:0次
名校
3 . 含氮化合物在工农业生产中有着十分重要的作用。铵盐、硝酸盐、尿素等可作植物生长的“食物”。但含氮化合物在生产和使用过程中产生的氮氧化物易造成光化学污染和硝酸型酸雨。所以氮氧化物需无害化处理,目前根据氮氧化物的来源处理的主流方法如下:
(1)方法一:工业废气(含 、
、 )利用石灰乳吸收,既能净化尾气,又能获得应用广泛的
)利用石灰乳吸收,既能净化尾气,又能获得应用广泛的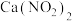 。
。
①写出该反应的方程式:___________ 。
②工业处理废气时,采用吸收塔,将废气从吸收塔底部通入,石灰乳从吸收塔顶部喷淋。这样操作的优点是:___________ 。
(2)方法二:“三元催化”是安装在汽车排气系统中最重要的机外净化装置。其工作原理是利用加装催化剂铑( )将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下:
)将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下:___________ 过程(填“吸热”或“放热”),还原产物为___________ ,当生成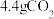 时,转移电子
时,转移电子___________  。
。
②请用文字描述过程I和过程II___________ 。
(1)方法一:工业废气(含
 、
、 )利用石灰乳吸收,既能净化尾气,又能获得应用广泛的
)利用石灰乳吸收,既能净化尾气,又能获得应用广泛的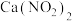 。
。①写出该反应的方程式:
②工业处理废气时,采用吸收塔,将废气从吸收塔底部通入,石灰乳从吸收塔顶部喷淋。这样操作的优点是:
(2)方法二:“三元催化”是安装在汽车排气系统中最重要的机外净化装置。其工作原理是利用加装催化剂铑(
 )将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下:
)将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下: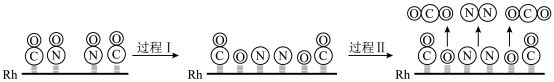
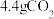 时,转移电子
时,转移电子 。
。②请用文字描述过程I和过程II
您最近半年使用:0次
4 . 请按照要求填写:
(1)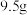 某二价金属氯化物
某二价金属氯化物 中含有
中含有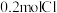 ,则
,则 的摩尔质量是
的摩尔质量是___________ 。
(2)除去镁粉中的铝粉,所选试剂为___________ ,相关的离子反应方程式为___________ 。
(3)配平离子方程式:___________ 。
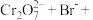 ___________=___________
___________=___________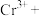 ___________
___________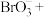 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂 的一种制备方法如下。
的一种制备方法如下。___________ ;
② 的结构式是
的结构式是___________ ;
③反应Ⅰ的离子方程式是___________ 。
(1)
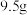 某二价金属氯化物
某二价金属氯化物 中含有
中含有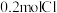 ,则
,则 的摩尔质量是
的摩尔质量是(2)除去镁粉中的铝粉,所选试剂为
(3)配平离子方程式:
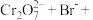 ___________=___________
___________=___________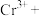 ___________
___________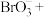 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂
 的一种制备方法如下。
的一种制备方法如下。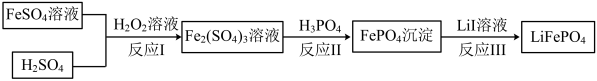
②
 的结构式是
的结构式是③反应Ⅰ的离子方程式是
您最近半年使用:0次
5 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为Cl-除去。
转化为Cl-除去。
①关于二氧化氯的说法不正确的是_______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为_______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性_______ H2O2的氧化性(填“大于”或“小于”)。
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应: +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为_______ 。(写出计算过程)
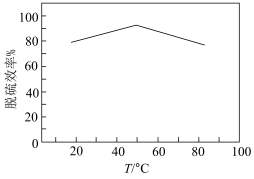
③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是_______ 。测得脱硫效率(即SO2的吸收率)随温度变化的曲线如下图所示。_______ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的
 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为Cl-除去。
转化为Cl-除去。①关于二氧化氯的说法不正确的是
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:
 +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是
您最近半年使用:0次
解题方法
6 . 空气质量日报中涉及的污染物主要是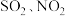 和可吸入颗粒物。
和可吸入颗粒物。
Ⅰ.汽车尾气是城市大气氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使 和
和 反应生成可参与大气生态环境循环的无毒气体。
反应生成可参与大气生态环境循环的无毒气体。
(1)以 为例写出反应的化学方程式:
为例写出反应的化学方程式:_________ 。
Ⅱ.SO2的排放是造成酸雨的主要因素,形成酸雨的原理之一可简单表示为:
______________ (填“>”“<”或“=”)5.6。
(3)反应 的化学方程式为
的化学方程式为______________ 。
(4)用足量的氨水吸收 ,其离子方程式为
,其离子方程式为________ 。
(5) 溶液可以吸收含
溶液可以吸收含 的烟气,若
的烟气,若 溶液与
溶液与 恰好反应完全,检验反应后的溶液中是否含有
恰好反应完全,检验反应后的溶液中是否含有 的方法为
的方法为_____________ 。
Ⅲ.利用溶液吸收尾气(主要含 及少量
及少量 )中的氮氧化物,实验装置如图所示.已知:
)中的氮氧化物,实验装置如图所示.已知: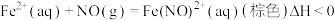
______ 时,说明 中
中 溶液需要更换。
溶液需要更换。
(7)若尾气体积为 (标准状况),用
(标准状况),用 溶液滴定a中溶液,消耗
溶液滴定a中溶液,消耗 溶液体积为
溶液体积为 ,尾气中
,尾气中 的体积分数为
的体积分数为_________ 。
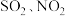 和可吸入颗粒物。
和可吸入颗粒物。Ⅰ.汽车尾气是城市大气氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使
 和
和 反应生成可参与大气生态环境循环的无毒气体。
反应生成可参与大气生态环境循环的无毒气体。(1)以
 为例写出反应的化学方程式:
为例写出反应的化学方程式:Ⅱ.SO2的排放是造成酸雨的主要因素,形成酸雨的原理之一可简单表示为:


(3)反应
 的化学方程式为
的化学方程式为(4)用足量的氨水吸收
 ,其离子方程式为
,其离子方程式为(5)
 溶液可以吸收含
溶液可以吸收含 的烟气,若
的烟气,若 溶液与
溶液与 恰好反应完全,检验反应后的溶液中是否含有
恰好反应完全,检验反应后的溶液中是否含有 的方法为
的方法为Ⅲ.利用溶液吸收尾气(主要含
 及少量
及少量 )中的氮氧化物,实验装置如图所示.已知:
)中的氮氧化物,实验装置如图所示.已知: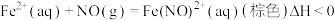

 中
中 溶液需要更换。
溶液需要更换。(7)若尾气体积为
 (标准状况),用
(标准状况),用 溶液滴定a中溶液,消耗
溶液滴定a中溶液,消耗 溶液体积为
溶液体积为 ,尾气中
,尾气中 的体积分数为
的体积分数为
您最近半年使用:0次
解题方法
7 . Ⅰ.过氧化氢是用途很广的绿色氧化剂,常用于消毒、杀菌、漂白等.试回答下列问题:
(1)写出酸性高锰酸钾溶液和 反应的离子方程式:
反应的离子方程式:______________ 。
(2)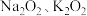 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是______________ 。
Ⅱ.某工厂废水中含 ,其浓度为
,其浓度为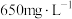 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):
(3)反应 中被氧化的元素是
中被氧化的元素是______________ 。
(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:_____________ 。
(1)写出酸性高锰酸钾溶液和
 反应的离子方程式:
反应的离子方程式:(2)
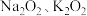 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是Ⅱ.某工厂废水中含
 ,其浓度为
,其浓度为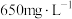 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):(3)反应
 中被氧化的元素是
中被氧化的元素是(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:

您最近半年使用:0次
名校
解题方法
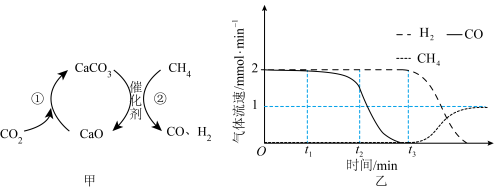
8 . 一种捕获 并实现资源利用的反应原理如图甲所示。反应①完成之后,以
并实现资源利用的反应原理如图甲所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了制反应(反应③):
,在催化剂上有积碳,推测发生了制反应(反应③): 。
。___________ 。
2. 时间段内,反应②速率减小至0的原因是
时间段内,反应②速率减小至0的原因是___________ 。
3. 时刻,生成
时刻,生成 的速率反应②___________反应③。
的速率反应②___________反应③。
 并实现资源利用的反应原理如图甲所示。反应①完成之后,以
并实现资源利用的反应原理如图甲所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到
混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图乙所示。反应过程中始终未检测到 ,在催化剂上有积碳,推测发生了制反应(反应③):
,在催化剂上有积碳,推测发生了制反应(反应③): 。
。
2.
 时间段内,反应②速率减小至0的原因是
时间段内,反应②速率减小至0的原因是3.
 时刻,生成
时刻,生成 的速率反应②___________反应③。
的速率反应②___________反应③。A. | B. | C. | D.无法确定 |
您最近半年使用:0次
解题方法
9 . 高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为________________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将 、NO、
、NO、 转化为
转化为 。烟气中含有的
。烟气中含有的 会使钒氧化物催化剂中毒。
会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为_______________ (填化学式)。
②研究发现砷中毒机理主要是 分子破坏了催化剂的Lewis酸位点,使
分子破坏了催化剂的Lewis酸位点,使 数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构
数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构__________ 。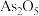 不易使催化剂中毒。但与
不易使催化剂中毒。但与 相比,
相比,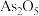 更不利于脱硝反应的进行,其原因是
更不利于脱硝反应的进行,其原因是_______________ 。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量( 或铵盐)会影响水泥的性能。
或铵盐)会影响水泥的性能。
①取50.00 g粉煤灰加入NaOH蒸出 ,用20 mL 0.1000 mol⋅L
,用20 mL 0.1000 mol⋅L 的
的 溶液吸收
溶液吸收 ,用0.2000mol⋅L
,用0.2000mol⋅L NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以 计的氨含量
计的氨含量___________ (用mg⋅g 表示,写出计算过程)。
表示,写出计算过程)。
②相同烟气所得脱硝粉煤灰(经过SCR脱硝后获得)与未脱硝粉煤灰(直接沉降获得)加水后溶解后,所得浆液pH随时间的变化如图所示。脱硝粉煤灰pH始终比未脱硝粉煤灰低的原因是___________ 。
 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成
 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将
 、NO、
、NO、 转化为
转化为 。烟气中含有的
。烟气中含有的 会使钒氧化物催化剂中毒。
会使钒氧化物催化剂中毒。①在SCR脱硝的反应中还原剂为
②研究发现砷中毒机理主要是
 分子破坏了催化剂的Lewis酸位点,使
分子破坏了催化剂的Lewis酸位点,使 数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构
数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构
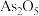 不易使催化剂中毒。但与
不易使催化剂中毒。但与 相比,
相比,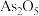 更不利于脱硝反应的进行,其原因是
更不利于脱硝反应的进行,其原因是(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(
 或铵盐)会影响水泥的性能。
或铵盐)会影响水泥的性能。①取50.00 g粉煤灰加入NaOH蒸出
 ,用20 mL 0.1000 mol⋅L
,用20 mL 0.1000 mol⋅L 的
的 溶液吸收
溶液吸收 ,用0.2000mol⋅L
,用0.2000mol⋅L NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以 计的氨含量
计的氨含量 表示,写出计算过程)。
表示,写出计算过程)。②相同烟气所得脱硝粉煤灰(经过SCR脱硝后获得)与未脱硝粉煤灰(直接沉降获得)加水后溶解后,所得浆液pH随时间的变化如图所示。脱硝粉煤灰pH始终比未脱硝粉煤灰低的原因是

您最近半年使用:0次
2024-04-23更新
|
526次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三一模考试化学试题
名校
10 . 许多含氮物质会造成环境污染,硝酸工业的尾气(含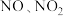 )会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮(
)会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮( 和
和 )会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。
)会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。
(1)废气中氮氧化物的吸收。
①在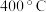 左右且有催化剂存在的情况下,
左右且有催化剂存在的情况下, 能把
能把 还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为
还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为___________ 。
②碱液吸收法。该工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),得到的滤渣可循环使用,该滤渣的主要成分是___________ (填化学式)。工艺需控制 和
和 的物质的量之比接近
的物质的量之比接近___________ ,若小于这个比值,则会导致___________ 。
 溶液也可以吸收氮氧化物,写出
溶液也可以吸收氮氧化物,写出 溶液吸收
溶液吸收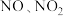 混合气体得到亚硝酸钠的化学方程式
混合气体得到亚硝酸钠的化学方程式___________ 。
(2)废水中过量的氨氮(如 和
和 )处理,科研小组用
)处理,科研小组用 氧化法处理氨氮废水。
氧化法处理氨氮废水。
已知:
A. 的氧化性比
的氧化性比 强;
强;
B. 比
比 更易被氧化;
更易被氧化;
C.国家标准要求经处理过的氨氨废水 要控制在
要控制在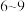 。
。
进水 对氨氨去除率的影响如下图所示。
对氨氨去除率的影响如下图所示。 为
为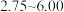 范围内,氨氮去除率随
范围内,氨氮去除率随 升高而上升的原因是
升高而上升的原因是___________ 。
写出酸性条件下 氧化
氧化 的离子方程式:
的离子方程式:___________ 。
已知:a. 的氧化性比
的氧化性比 弱;b.
弱;b. 氧化氨氮的速率比
氧化氨氮的速率比 小。
小。
在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率___________ (填“显著变大”“显著变小”或“几乎不变”)。
(3)微生物脱氮氯法: 。
。
写出酸性条件下步骤a的离子方程式:___________ 。
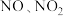 )会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮(
)会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮( 和
和 )会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。
)会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。(1)废气中氮氧化物的吸收。
①在
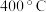 左右且有催化剂存在的情况下,
左右且有催化剂存在的情况下, 能把
能把 还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为
还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为②碱液吸收法。该工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),得到的滤渣可循环使用,该滤渣的主要成分是
 和
和 的物质的量之比接近
的物质的量之比接近 溶液也可以吸收氮氧化物,写出
溶液也可以吸收氮氧化物,写出 溶液吸收
溶液吸收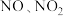 混合气体得到亚硝酸钠的化学方程式
混合气体得到亚硝酸钠的化学方程式(2)废水中过量的氨氮(如
 和
和 )处理,科研小组用
)处理,科研小组用 氧化法处理氨氮废水。
氧化法处理氨氮废水。已知:
A.
 的氧化性比
的氧化性比 强;
强;B.
 比
比 更易被氧化;
更易被氧化;C.国家标准要求经处理过的氨氨废水
 要控制在
要控制在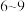 。
。进水
 对氨氨去除率的影响如下图所示。
对氨氨去除率的影响如下图所示。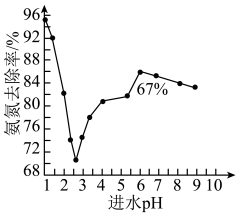
 为
为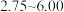 范围内,氨氮去除率随
范围内,氨氮去除率随 升高而上升的原因是
升高而上升的原因是写出酸性条件下
 氧化
氧化 的离子方程式:
的离子方程式:已知:a.
 的氧化性比
的氧化性比 弱;b.
弱;b. 氧化氨氮的速率比
氧化氨氮的速率比 小。
小。在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率
(3)微生物脱氮氯法:
 。
。写出酸性条件下步骤a的离子方程式:
您最近半年使用:0次



