名校
解题方法
1 . 钠、铝等金属及其材料在人类文明进步和社会发展中发挥了重要的作用。
(1)请用一个离子方程式说明钠与铝的金属性强弱___________ 。
(2)叠氮化钠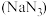 是一种无色结晶,其固体中正负离子的个数比为
是一种无色结晶,其固体中正负离子的个数比为 ,则该固体中含有的化学键是
,则该固体中含有的化学键是___________ (填化学键名称)。叠氮化钠受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标准状况下)氮气,至少需要叠氮化钠___________ g。
(3)在含0.1molNaOH的溶液中不断地通入 ,得到溶质的质量为8.35g,则烧杯中生产的溶质是
,得到溶质的质量为8.35g,则烧杯中生产的溶质是___________ 。溶质的物质的量是___________ 。
(4)高锰酸根离子 水对人体危害极大,可用过碳酸钠
水对人体危害极大,可用过碳酸钠 改性赤泥进行处理,反应如下:
改性赤泥进行处理,反应如下:
___________ ___________
___________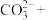 ___________
___________ ___________
___________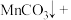 ___________
___________ ___________
___________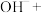 ___________H2O
___________H2O
补全并配平上述化学反应过程式___________ ;反应中,过碳酸钠起沉淀剂和___________ 剂作用;若将1L含Mn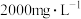 的含高锰酸根离子的废水处理至含Mn
的含高锰酸根离子的废水处理至含Mn ,则转移电子数为
,则转移电子数为___________ mol(保留2位小数)。
(1)请用一个离子方程式说明钠与铝的金属性强弱
(2)叠氮化钠
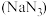 是一种无色结晶,其固体中正负离子的个数比为
是一种无色结晶,其固体中正负离子的个数比为 ,则该固体中含有的化学键是
,则该固体中含有的化学键是(3)在含0.1molNaOH的溶液中不断地通入
 ,得到溶质的质量为8.35g,则烧杯中生产的溶质是
,得到溶质的质量为8.35g,则烧杯中生产的溶质是(4)高锰酸根离子
 水对人体危害极大,可用过碳酸钠
水对人体危害极大,可用过碳酸钠 改性赤泥进行处理,反应如下:
改性赤泥进行处理,反应如下:___________
 ___________
___________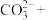 ___________
___________ ___________
___________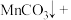 ___________
___________ ___________
___________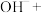 ___________H2O
___________H2O补全并配平上述化学反应过程式
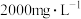 的含高锰酸根离子的废水处理至含Mn
的含高锰酸根离子的废水处理至含Mn ,则转移电子数为
,则转移电子数为
您最近半年使用:0次
名校
解题方法
2 . 氮循环是自然界中一种重要的物质循环方式:
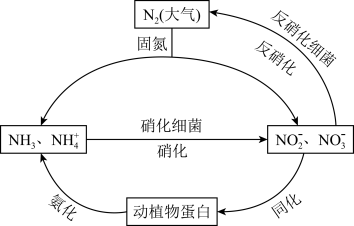
(1)化学与生产、生活和科技都密切相关。下列有关说法不正确的是___________ 。
A.硝化过程无需氧化剂参与
B.含有新冠病毒的飞沫分散在空气中形成的分散系为气溶胶
C.固氮过程中, 只做氧化剂
只做氧化剂
D.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
E.反硝化过程有助于弥补人工固氮对氮循环造成的影响
F.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
(2)写出氮循环中 的电子式
的电子式___________ ,其空间构型是___________ 。写出 的检验方法
的检验方法___________ 。
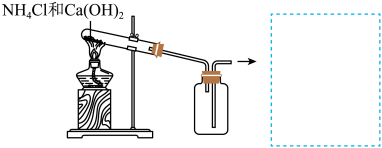
(3)实验室用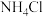 与
与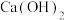 反应来制备
反应来制备 ,原理:
,原理:___________ (化学反应方程式)。在图中补上尾气处理装置(注明所用的化学物质的化学式)。___________
(4)通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有3种途径。如上① 称为
称为___________ ,②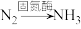 称为生物固氮,还有1种是工业固氮,其反应的化学方程式是
称为生物固氮,还有1种是工业固氮,其反应的化学方程式是___________ 。
(5)反硝化过程中, (C化合价:
(C化合价: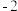 )可作为反应的还原剂。请将该反应的离子方程式补充完整:
)可作为反应的还原剂。请将该反应的离子方程式补充完整:___________ 。
___________ ___________
___________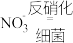 ___________
___________ ___________
___________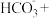 ___________
___________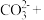 ___________。
___________。

(1)化学与生产、生活和科技都密切相关。下列有关说法不正确的是
A.硝化过程无需氧化剂参与
B.含有新冠病毒的飞沫分散在空气中形成的分散系为气溶胶
C.固氮过程中,
 只做氧化剂
只做氧化剂D.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
E.反硝化过程有助于弥补人工固氮对氮循环造成的影响
F.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
(2)写出氮循环中
 的电子式
的电子式 的检验方法
的检验方法(3)实验室用
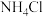 与
与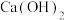 反应来制备
反应来制备 ,原理:
,原理:
(4)通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有3种途径。如上①
 称为
称为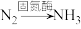 称为生物固氮,还有1种是工业固氮,其反应的化学方程式是
称为生物固氮,还有1种是工业固氮,其反应的化学方程式是(5)反硝化过程中,
 (C化合价:
(C化合价: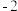 )可作为反应的还原剂。请将该反应的离子方程式补充完整:
)可作为反应的还原剂。请将该反应的离子方程式补充完整:___________
 ___________
___________ ___________
___________ ___________
___________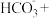 ___________
___________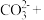 ___________。
___________。
您最近半年使用:0次
解题方法
3 . 回答下列问题。
(1)今有11种物质:①铝线;②石墨;③氯气;④BaSO4晶体;⑤纯硫酸;⑥金刚石;⑦石灰水;⑧乙醇;⑨熔融的KNO3;⑩NH3;⑪盐酸。其中:
ⅰ.能导电的是(填序号,下同)___________ ;
ⅱ.属于电解质的是___________ ;
ⅲ.属于非电解质的是___________ ;
ⅳ.既不是电解质又不是非电解质的是___________ 。
(2)ⅰ.配平下列离子方程式:___________ 。___________ 。
_____Fe(NO3)3+_______NaOH+______Cl2=____Na2FeO4+_____NaNO3+____NaCl+_____H2O
反应中___________ 元素被氧化,氧化剂与氧化产物的个数比为___________ 。
(1)今有11种物质:①铝线;②石墨;③氯气;④BaSO4晶体;⑤纯硫酸;⑥金刚石;⑦石灰水;⑧乙醇;⑨熔融的KNO3;⑩NH3;⑪盐酸。其中:
ⅰ.能导电的是(填序号,下同)
ⅱ.属于电解质的是
ⅲ.属于非电解质的是
ⅳ.既不是电解质又不是非电解质的是
(2)ⅰ.配平下列离子方程式:
______MnO +_____H++______Cl-=_____Mn2++_____Cl2↑+_____H2O
+_____H++______Cl-=_____Mn2++_____Cl2↑+_____H2O
_____Fe(NO3)3+_______NaOH+______Cl2=____Na2FeO4+_____NaNO3+____NaCl+_____H2O
反应中
您最近半年使用:0次
4 . 化学与生活、生产息息相关。请回答下列问题:
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有_______ (填序号,下同),属于非电解质的有_______ 。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为_______ 。
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为_______ 。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式_______ :
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为
您最近半年使用:0次
名校
5 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的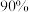 。
。
(1)水晶和玛瑙的主要成分均为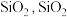 为
为___________ (填“酸性”、“碱性”或“两性”)氧化物,写出 与氢氧化钠溶液反应的化学方程式:
与氢氧化钠溶液反应的化学方程式:___________ 。
(2)用 水溶液浸泡过的棉花不易燃烧,说明
水溶液浸泡过的棉花不易燃烧,说明 可用作
可用作___________ 。
(3)工业上制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥 气体在300℃反应制得
气体在300℃反应制得 和
和 ;
;
③ 与过量
与过量 在1000~1100℃反应制得纯硅。
在1000~1100℃反应制得纯硅。
Ⅰ.第②步制备 反应的化学方程式为:
反应的化学方程式为:___________ ,步骤①②③中属于氧化还原反应的是___________ (填序号)。
Ⅱ.整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成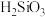 、
、 和另一种物质,写出该反应的化学方程式:
和另一种物质,写出该反应的化学方程式:___________ 。
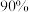 。
。(1)水晶和玛瑙的主要成分均为
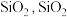 为
为 与氢氧化钠溶液反应的化学方程式:
与氢氧化钠溶液反应的化学方程式:(2)用
 水溶液浸泡过的棉花不易燃烧,说明
水溶液浸泡过的棉花不易燃烧,说明 可用作
可用作(3)工业上制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥
 气体在300℃反应制得
气体在300℃反应制得 和
和 ;
;③
 与过量
与过量 在1000~1100℃反应制得纯硅。
在1000~1100℃反应制得纯硅。Ⅰ.第②步制备
 反应的化学方程式为:
反应的化学方程式为:Ⅱ.整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成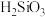 、
、 和另一种物质,写出该反应的化学方程式:
和另一种物质,写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
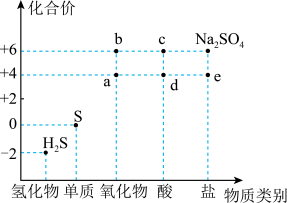
6 . 如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:_____ ,体现了c的_____ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是_____ (填化学式)。
(3)将 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为_____ 。
(4)配平下列反应:_____ 。
_____
(5)为防止多余的a气体污染环境,应将尾气通入_____ 溶液中;
(6)将足量的 溶液中,下列说法正确的是
溶液中,下列说法正确的是_____ (填字母)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀

(7)将 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为_____ 。 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:_____ 。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质是
(3)将
 混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为
混合可生成淡黄色沉淀,该反应中氧化产物与还原产物的物质的量之比为(4)配平下列反应:
_____

(5)为防止多余的a气体污染环境,应将尾气通入
(6)将足量的
 溶液中,下列说法正确的是
溶液中,下列说法正确的是A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入
 ,则溶液中均会出现白色沉淀
,则溶液中均会出现白色沉淀
(7)将
 片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时,
片浸在不同质量分数的c溶液中,经4小时腐蚀后的质量损失情况如图所示,当c的浓度大于63%时, 被腐蚀的速率逐渐降低的可能原因为
被腐蚀的速率逐渐降低的可能原因为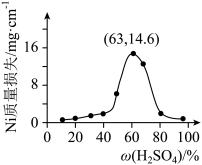
 的污染并变废为宝,我国正在探索在一定条件下,用
的污染并变废为宝,我国正在探索在一定条件下,用 还原,
还原, 得到单质硫的方法来除去
得到单质硫的方法来除去 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近半年使用:0次
解题方法
7 . 高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。
(1)电解法。以铁为阳极,石墨为阴极,在通电条件下,发生反应: ,物质X的化学式为
,物质X的化学式为___________ 。
(2)高温熔融氧化法。将过氧化钠与硫酸亚铁加热至700℃,发生反应: ,其中,氧化产物是
,其中,氧化产物是___________ ,用生成1mol氧气所转移的电子数为___________ 。
(3)次氯酸钠氧化法___________ 。
②副产品的成分为___________ 。
(1)电解法。以铁为阳极,石墨为阴极,在通电条件下,发生反应:
 ,物质X的化学式为
,物质X的化学式为(2)高温熔融氧化法。将过氧化钠与硫酸亚铁加热至700℃,发生反应:
 ,其中,氧化产物是
,其中,氧化产物是(3)次氯酸钠氧化法
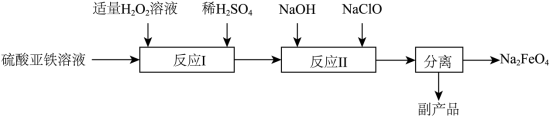
②副产品的成分为
您最近半年使用:0次
解题方法
8 . 叠氮化钠(NaN3)可用于汽车安全气囊的产气药。一种由氨基化钠(NaNH2)制备NaN3的工艺流程如图。
①钠元素位于周期表第_____ 周期_____ 族。
②NaNH2中氮元素的化合价为_____ 。
③用单线桥 标出该反应电子转移的方向和数目_____ 。
(2)NaOH的电子式为_____ ,流程中“反应”的化学方程式为_____ 。
(3)NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积为_____ L。
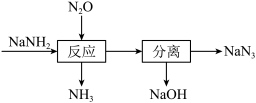
①钠元素位于周期表第
②NaNH2中氮元素的化合价为
③用
(2)NaOH的电子式为
(3)NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积为
您最近半年使用:0次
名校
9 . 氮及其化合物与生产生活及环境息息相关。请回答下列问题:
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:___________ 。
(2)硝酸与金属反应会产生氮氧化物。下列环境问题与氮的氧化物排放无关的是___________ 。
A酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式___________ ,氧化产物与还原产物的物质的量之比为___________ 。
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(HSbF6),称为超强酸。氟锑酸可由SbF5与HF混合得到。制备氟锑酸一般在塑料容器中进行,不在玻璃仪器中进行的原因是___________ (用化学方程式回答)
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:
(2)硝酸与金属反应会产生氮氧化物。下列环境问题与氮的氧化物排放无关的是
A酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染 E.温室效应
(3)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式
(4)氮的同族元素锑(Sb)可形成酸性超过100%硫酸的酸——氟锑酸(HSbF6),称为超强酸。氟锑酸可由SbF5与HF混合得到。制备氟锑酸一般在塑料容器中进行,不在玻璃仪器中进行的原因是
您最近半年使用:0次
名校
10 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为___________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2 +H2O
+H2O
2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2
 +H2O
+H2O2NO2+2OH-=
 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。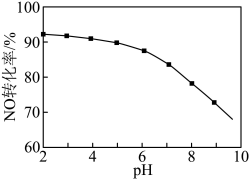
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近半年使用:0次



