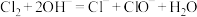名校
解题方法
1 . “新冠”疫情期间,人们广泛使用“84”消毒液(有效成分NaClO).回答下列问题:
(1)用氯气制备“84”消毒液的离子方程式为_______ 。图中是某“84”消毒液的标签,NaClO的物质的量浓度为_______ mol·L-1(保留1位小数)。

(2)资料显示“84”消毒液不能与洁厕灵(含HCl)混合使用,对此某小组开展如图所示的研究。两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为_______ ,NaOH的作用是_______ 。

(3)过氧化钠有强氧化性,也可用作杀菌剂、消毒剂、漂白剂和供氧剂等。若Na2O2作供氧剂与H2O完全反应时,若转移0.3 mol电子,则生成标准状况下的O2_______ L。
(1)用氯气制备“84”消毒液的离子方程式为

(2)资料显示“84”消毒液不能与洁厕灵(含HCl)混合使用,对此某小组开展如图所示的研究。两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为

(3)过氧化钠有强氧化性,也可用作杀菌剂、消毒剂、漂白剂和供氧剂等。若Na2O2作供氧剂与H2O完全反应时,若转移0.3 mol电子,则生成标准状况下的O2
您最近半年使用:0次
名校
2 . 氯气是一种重要的化工原材料,常用于制备盐酸、漂白液、农药和药品等。某小组为了制备源白液(主要成分 ),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“
),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“ 与水的反应是放热反应。在加热条件下
与水的反应是放热反应。在加热条件下 与碱液发生:
与碱液发生: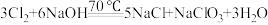
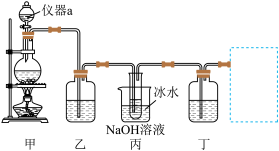
(1)仪器a的名称是___________ ,写出装置甲中发生的化学反应方程式___________ 。
(2)装置乙的作用是提纯 ,装有的试剂是
,装有的试剂是___________ ,装置乙不能省去,原因是___________ 。
(3)丙中冰水浴的作用是___________ 。
(4)欲验证 与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是
与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是___________ ,现象是___________ 。
(5)在虚线框中可以使用下列的装置是___________
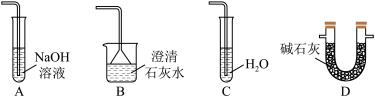
(6)常温下,在 溶液中滴加浓盐酸,也可以制备
溶液中滴加浓盐酸,也可以制备 ,该氧化还原反应中包含下列几种微粒:
,该氧化还原反应中包含下列几种微粒: ,写出上述的化学反应方程式并配平
,写出上述的化学反应方程式并配平___________ 。在该反应中,表现酸性和还原性的 质量比是
质量比是___________ 。
 ),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“
),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“ 与水的反应是放热反应。在加热条件下
与水的反应是放热反应。在加热条件下 与碱液发生:
与碱液发生: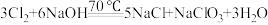

(1)仪器a的名称是
(2)装置乙的作用是提纯
 ,装有的试剂是
,装有的试剂是(3)丙中冰水浴的作用是
(4)欲验证
 与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是
与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是(5)在虚线框中可以使用下列的装置是

(6)常温下,在
 溶液中滴加浓盐酸,也可以制备
溶液中滴加浓盐酸,也可以制备 ,该氧化还原反应中包含下列几种微粒:
,该氧化还原反应中包含下列几种微粒: ,写出上述的化学反应方程式并配平
,写出上述的化学反应方程式并配平 质量比是
质量比是
您最近半年使用:0次
3 . 用浓盐酸与氯酸钾固体反应制氯气时,发现所得气体颜色偏深,经分析该气体主要含有Cl2和ClO2两种气体,某学习小组拟用如图所示装置分离制得的混合气体,并测定两种气体的物质的量之比。
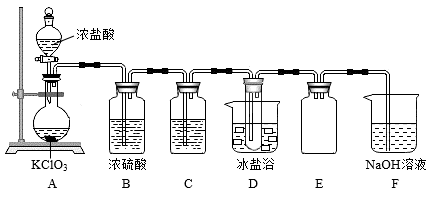
Ⅰ.查阅资料:
ClO2是一种黄色气体,能凝聚成红色液体,熔点-59℃,沸点11℃;能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性;能与NaOH溶液反应生成等物质的量的两种盐,其中一种为NaClO3。
Ⅱ.制备与分离:
(1)实验前应进行的实验操作为_ 。
(2)装置C中盛装的试剂为__ ,装置E的作用是__ 。
(3)F中ClO2与NaOH溶液反应的离子方程式为__ 。
Ⅲ.测量与计算:
反应结束后,测得B、C装置分别增重2.0g和14.2g,将D中的液体溶于水,配成2L溶液,取20.00mL该溶液,调节试样pH<2.0,加入足量KI晶体,振荡后静置片刻;加入指示剂X,用0.200mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00mL。(已知:ClO2+H++I-→I2+Cl-+H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
(4)应选用的指示剂X为__ 。
(5)原装置收集到的ClO2的物质的量为__ (忽略F中吸收的尾气)。
Ⅳ.结论:
(6)浓盐酸与氯酸钾固体反应的化学方程式为__ 。

Ⅰ.查阅资料:
ClO2是一种黄色气体,能凝聚成红色液体,熔点-59℃,沸点11℃;能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性;能与NaOH溶液反应生成等物质的量的两种盐,其中一种为NaClO3。
Ⅱ.制备与分离:
(1)实验前应进行的实验操作为
(2)装置C中盛装的试剂为
(3)F中ClO2与NaOH溶液反应的离子方程式为
Ⅲ.测量与计算:
反应结束后,测得B、C装置分别增重2.0g和14.2g,将D中的液体溶于水,配成2L溶液,取20.00mL该溶液,调节试样pH<2.0,加入足量KI晶体,振荡后静置片刻;加入指示剂X,用0.200mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00mL。(已知:ClO2+H++I-→I2+Cl-+H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
(4)应选用的指示剂X为
(5)原装置收集到的ClO2的物质的量为
Ⅳ.结论:
(6)浓盐酸与氯酸钾固体反应的化学方程式为
您最近半年使用:0次
2020-12-23更新
|
250次组卷
|
3卷引用:重庆市西南大学附属中学校高2021届高三第二次月考化学试题
21-22高一·全国·课时练习
4 . 某化学小组同学发现“84”消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用如图装置制取Cl2.装置中仪器a的名称为_______ 。
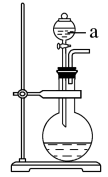
(2)甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,观察有无色气泡产生。乙同学认为不合理,理由是_______ 。
(3)某实验小组对氯水成分和性质进行研究,实验如图:
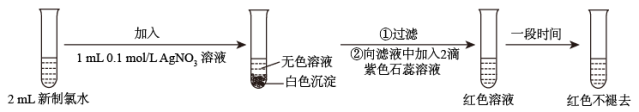
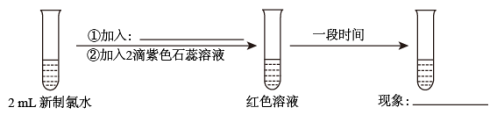
甲同学认为,“红色不褪去”不是因为氯水被稀释所致。乙同学持反对意见。为了证明甲同学错误,乙同学继续以下实验,请在横线上补充所加入的试剂和观察到的现象。
加入:_______ ,现象:_______ 。
(4)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图装置制备无水FeCl3。
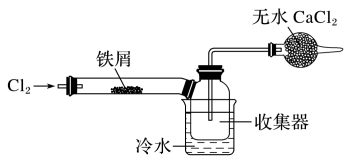
①下列操作步骤的正确排序为_______ (填字母)
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是_______ 。
(1)若用次氯酸钙、浓盐酸为原料,利用如图装置制取Cl2.装置中仪器a的名称为

(2)甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,观察有无色气泡产生。乙同学认为不合理,理由是
(3)某实验小组对氯水成分和性质进行研究,实验如图:

甲同学认为,“红色不褪去”不是因为氯水被稀释所致。乙同学持反对意见。为了证明甲同学错误,乙同学继续以下实验,请在横线上补充所加入的试剂和观察到的现象。
加入:

(4)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如图装置制备无水FeCl3。

①下列操作步骤的正确排序为
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是
您最近半年使用:0次
解题方法
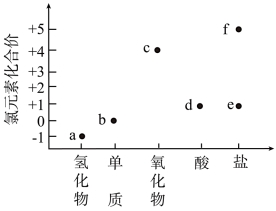
5 . 氮及其化合物在生产、生活中广泛应用。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是__________ (写化学式)。写出一个能够生成B的化学方程式__________ 。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是__________ 。
(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式__________ 。
Ⅱ.下图为实验室模拟尿素法制备水合肼( )的流程图:
)的流程图:
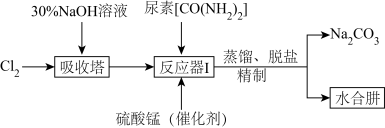
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为__________ 。
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为__________ 。
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是__________ 。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
Ⅱ.下图为实验室模拟尿素法制备水合肼(
 )的流程图:
)的流程图:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是
您最近半年使用:0次
名校
解题方法
6 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I- I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
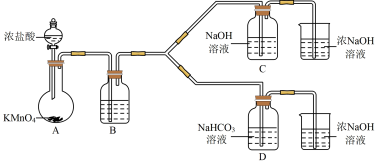
(1)制备NaClO消毒液的装置是__________ (填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用___________________ 。
(3)结合资料i,写出D中反应的化学方程式______________________ 。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________ 。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________ 。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________ 。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。Ⅰ.制备消毒液(夹持装置略)

(1)制备NaClO消毒液的装置是
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用
(3)结合资料i,写出D中反应的化学方程式
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近半年使用:0次
2020-05-07更新
|
447次组卷
|
4卷引用:北京市石景山区2020届高三第一次模拟化学试题
北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京首都师范大学附属中学2022届高三下学期三模化学试题北京市第八十中学2024届高三上学期10月月考化学试题
7 . 某化学小组用“84消毒液”(主要成分是NaClO)制备氯气并探究其性质,进行如图所示的实验(a~d中均为浸有相应试液的棉花,夹持装置省略)。下列说法正确的是
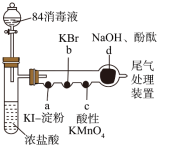
| A.a处变为蓝色,b处变为橙色,说明氧化性:Cl2>Br2>I2 |
| B.c处褪色,体现浓盐酸的挥发性和还原性 |
| C.d处褪色,一定是因酚酞被氧化而引起 |
| D.为防止尾气污染空气,应使用饱和食盐水吸收尾气 |
您最近半年使用:0次
名校
8 . Ca(ClO)2、NaClO、FeCl3、Al2O3、Fe2O3、Mn2O7等都是重要的化合物。回答下列问题:
(1)属于酸性氧化物的是______ (填化学式),其相应的钾盐具有_____ (填“强氧化性”或“强还原性”),FeSO4溶液能使该钾盐的酸性溶液褪色,其原因为________ (用离子方程式解释)。
(2)属于“84"消毒液成分的是______ (填化学式),其在空气中易变质,产物之一为碳酸氢钠,写出发生该反应的离子方程式:_______ 。
(3)用覆铜板制作印刷电路板的原理是_______ (用离子方程式表示),检验“腐蚀液”中有无Fe3+的试剂为______ (填化学式)。
(4)将氯气通入冷的_____ (填物质名称)中可制得以Ca(ClO)2为有效成分的漂白粉,该过程中转移2mol电子时,消耗氧化剂与还原剂的质量之比为________ 。
(1)属于酸性氧化物的是
(2)属于“84"消毒液成分的是
(3)用覆铜板制作印刷电路板的原理是
(4)将氯气通入冷的
您最近半年使用:0次
名校
解题方法
9 . 按要求回答下列问题:
(1)对含有K2CO3的样品进行焰色试验,需要准备的仪器和试剂有:铂丝、酒精灯、___________ 和___________ 。
(2)高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: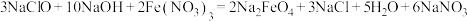 。回答下列问题:
。回答下列问题:
①用氯气制备 的反应原理为
的反应原理为___________ (化学方程式)
②制备高铁酸钠的反应中 体现了
体现了___________ (填“还原性”、“氧化性”或“氧化性和还原性”)
(3)加热13.7g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1g,所得固体与足量盐酸充分反应(假设CO2完全逸出)。计算:
①混合物中Na2CO3和NaHCO3的物质的量之比为___________ 。
②加入足量盐酸充分反应后产生的CO2在标准状况下的体积为___________ L。
(1)对含有K2CO3的样品进行焰色试验,需要准备的仪器和试剂有:铂丝、酒精灯、
(2)高铁酸钠
 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: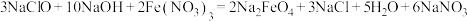 。回答下列问题:
。回答下列问题:①用氯气制备
 的反应原理为
的反应原理为②制备高铁酸钠的反应中
 体现了
体现了(3)加热13.7g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少了3.1g,所得固体与足量盐酸充分反应(假设CO2完全逸出)。计算:
①混合物中Na2CO3和NaHCO3的物质的量之比为
②加入足量盐酸充分反应后产生的CO2在标准状况下的体积为
您最近半年使用:0次