名校
1 . 高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: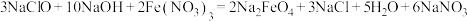 。回答下列问题:
。回答下列问题:
(1)用氯气制备 的反应原理为
的反应原理为___________ (化学方程式)
(2)制备高铁酸钠的反应中 体现了
体现了___________ (填“还原性”、“氧化性”或“氧化性和还原性”)
(3)该反应的离子方程式为___________ 。
(4) 中Fe的价态为
中Fe的价态为___________ 价, 可用于自来水杀菌消毒的原因是
可用于自来水杀菌消毒的原因是___________ 。
(5)该反应中,每消耗 ,生成
,生成 的物质的量
的物质的量___________ mol,转移的电子数目为___________ (用 表示阿伏伽德罗常数的值)
表示阿伏伽德罗常数的值)
 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: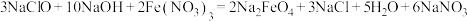 。回答下列问题:
。回答下列问题:(1)用氯气制备
 的反应原理为
的反应原理为(2)制备高铁酸钠的反应中
 体现了
体现了(3)该反应的离子方程式为
(4)
 中Fe的价态为
中Fe的价态为 可用于自来水杀菌消毒的原因是
可用于自来水杀菌消毒的原因是(5)该反应中,每消耗
 ,生成
,生成 的物质的量
的物质的量 表示阿伏伽德罗常数的值)
表示阿伏伽德罗常数的值)
您最近半年使用:0次
名校
解题方法
2 . I.氯水具有多种性质,该小组同学用足量氯水分别与Na2CO3溶液,AgNO3溶液和FeBr2溶液反应。完成下列问题:
已知:常温下发生反应:i.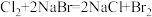 ;ii:
;ii: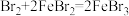
(1)证明氯水中含有盐酸,可选择的试剂是___________ 溶液(选填“Na2CO3”或“AgNO3”)。
(2)氯水与FeBr2溶液反应能证明氯水具有氧化性。请补充完整足量氯水与FeBr2溶液反应的离子方程式 :_____ 。
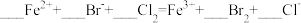 。
。
(3)久置氯水的主要成分是H2O、___________ (填化学式),用化学方程式解释分别为Cl2+H2O HCl+HClO、
HCl+HClO、___________ 。
Ⅱ.该小组同学在实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。

已知:i.氯气与碱反应时,温度不同产物不同
ii.CCl4难溶于水且密度比水大,I2在CCl4中显紫色。请回答下列问题:
(4)写出装置①中制取氯气的化学方程式,并用双线桥标出电子转移情况:___________ 。
(5)装置②盛装的试剂是___________ ,其作用是___________ 。
(6)装置③中反应化学方程式为___________ ,反应结束后,取出③中试管,经冷却结晶,过滤,少量(冷)水洗涤,干燥,得到KClO3晶体。
(7)装置④中采用冰水浴冷却的目的是___________ ,反应的离子方程 式为___________ 。
(8)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI浴液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。根据上述实验,以下结论正确的是___________。
已知:常温下发生反应:i.
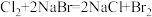 ;ii:
;ii: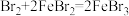
(1)证明氯水中含有盐酸,可选择的试剂是
(2)氯水与FeBr2溶液反应能证明氯水具有氧化性。请补充完整足量氯水与FeBr2溶液反应的
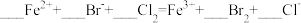 。
。(3)久置氯水的主要成分是H2O、
 HCl+HClO、
HCl+HClO、Ⅱ.该小组同学在实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。

已知:i.氯气与碱反应时,温度不同产物不同
ii.CCl4难溶于水且密度比水大,I2在CCl4中显紫色。请回答下列问题:
(4)写出装置①中制取氯气的化学方程式,并用双线桥标出电子转移情况:
(5)装置②盛装的试剂是
(6)装置③中反应化学方程式为
(7)装置④中采用冰水浴冷却的目的是
(8)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI浴液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。根据上述实验,以下结论正确的是___________。
A.氧化性: | B.氧化性: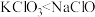 |
C.还原性: | D.还原性: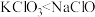 |
您最近半年使用:0次
3 . 实验室用如下装置制取氯气,并进行氯气性质实验。回答下列问题:

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有 。加热时B中的化学方程式为
。加热时B中的化学方程式为___________ 。
(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为___________ (用化学式表示)。
(3)D中盛放的试剂为___________ 。
(4)对比E和F中现象的差异可得出的结论是___________ 。
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入___________ 溶液,溶液未出现红色,证明猜测1和猜测3不正确;
②再加入___________ (填试剂和现象)证明猜测2正确。
由此得出离子的还原性Fe2+___________ I-(填“大于”,“等于”,“小于”)。
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是___________ (填化学式)。

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有
 。加热时B中的化学方程式为
。加热时B中的化学方程式为(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为
(3)D中盛放的试剂为
(4)对比E和F中现象的差异可得出的结论是
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入
②再加入
由此得出离子的还原性Fe2+
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是
您最近半年使用:0次
名校
解题方法
4 . 氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制备 和
和 ,探究其氧化还原性质,装置如下图所示(部分装置省略)。
,探究其氧化还原性质,装置如下图所示(部分装置省略)。
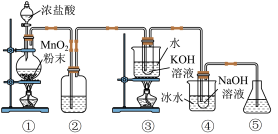
已知:氯气与碱反应时温度不同产物不同,温度较高时生成 ,温度较低时生成
,温度较低时生成 ,请回答下列问题:
,请回答下列问题:
(1)装置①中盛放浓盐酸的仪器名称为_______ 。若反应产生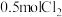 ,反应转移的电子数是
,反应转移的电子数是_______ ,被氧化的盐酸质量为_______ 。装置②的作用是_______ 。如果缺少装置②,对制取 和
和 的影响是
的影响是_______ 。
(2)装置③中反应的化学方程式为_______ ,反应结束后,取出③中试管,经冷却结晶,过滤,少量(冷)水洗涤,干燥,得到 晶体。
晶体。
(3)装置④中采用冰水浴冷却的目的是_______ 。
(4)装置⑤中的试剂下列选项中不可选用的是_______ 。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
(5)取少量 和
和 溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫红色。根据上述实验,以下结论正确的是_______。
层显紫红色。根据上述实验,以下结论正确的是_______。
 和
和 ,探究其氧化还原性质,装置如下图所示(部分装置省略)。
,探究其氧化还原性质,装置如下图所示(部分装置省略)。
已知:氯气与碱反应时温度不同产物不同,温度较高时生成
 ,温度较低时生成
,温度较低时生成 ,请回答下列问题:
,请回答下列问题:(1)装置①中盛放浓盐酸的仪器名称为
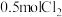 ,反应转移的电子数是
,反应转移的电子数是 和
和 的影响是
的影响是(2)装置③中反应的化学方程式为
 晶体。
晶体。(3)装置④中采用冰水浴冷却的目的是
(4)装置⑤中的试剂下列选项中不可选用的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液(5)取少量
 和
和 溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫红色。根据上述实验,以下结论正确的是_______。
层显紫红色。根据上述实验,以下结论正确的是_______。A.氧化性: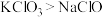 | B.氧化性: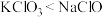 |
C.还原性: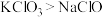 | D.还原性: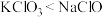 |
您最近半年使用:0次
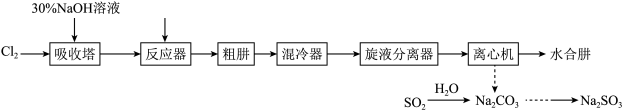
5 . 水合肼(N2H4·H2O)是一种精细化工原料,常用于医药、农药、染料、航天等领域。实验室模拟尿素法制备N2H4·H2O,并进一步制取副产品Na2SO3的流程如图所示。
已知:①N2H4·H2O具有强还原性,易被氧化成N2;
②一定条件下,碱性NaClO溶液与尿素溶液反应生或主要产物中有N2H4·H2O和Na2CO3;
③尿素中氮元素为-3价。
回答下列问题
(1)吸收塔内发生反应的离子方程式为_______________________ 。
(2)为提高吸收塔内NaOH的有效利用率,将二氧化锰和浓盐酸制取的Cl2通入吸收塔前应进行的操作是_________________ ,选用的试剂是______________ 。
(3)反应器内生成水合肼的化学方程式为____________________ 。
(4)制备过程中要控制反应器内NaClO溶液的供给量不能过量,其主要目的是____________________ 。

已知:①N2H4·H2O具有强还原性,易被氧化成N2;
②一定条件下,碱性NaClO溶液与尿素溶液反应生或主要产物中有N2H4·H2O和Na2CO3;
③尿素中氮元素为-3价。
回答下列问题
(1)吸收塔内发生反应的离子方程式为
(2)为提高吸收塔内NaOH的有效利用率,将二氧化锰和浓盐酸制取的Cl2通入吸收塔前应进行的操作是
(3)反应器内生成水合肼的化学方程式为
(4)制备过程中要控制反应器内NaClO溶液的供给量不能过量,其主要目的是
您最近半年使用:0次
6 . “新冠”疫情期间,人们广泛使用“84消毒液”进行环境消毒。某品牌“84消毒液”张贴标签如图所示,请回答下列问题:
(1)从组成的阴离子来看,“84消毒液”的有效成分属于_______ 盐。常温下,可将Cl2通入NaOH溶液来制取“84消毒液”该反应的离子方程式是_______ 。
(2)“84消毒液”进行环境消毒时利用了NaClO的_______ (填“氧化性”或“还原性”)
(3)一瓶该品牌的“84消毒液”中含NaClO_______ g,NaClO的物质的量浓度为_______ mol/L(计算结果保留2位有效数字)。
(4)配制500mL0.10mol/LNaClO溶液。
①转移溶液时用到的玻璃仪器有:500mL容量瓶、_______ 、_______ 。
②配制过程中,下列操作会导致所配溶液浓度偏小的是_______ (填字母标号)。
A.容量瓶内有少量蒸馏水
B.移液时,液体不慎撒到容量瓶外
C.洗涤液未转移至容量瓶中
D.定容时俯视刻度线
| 84消毒液 【有效成分】NaClO 【规格】750mL 【质量分数】25% 【密度】1.2g/cm3 |
(2)“84消毒液”进行环境消毒时利用了NaClO的
(3)一瓶该品牌的“84消毒液”中含NaClO
(4)配制500mL0.10mol/LNaClO溶液。
①转移溶液时用到的玻璃仪器有:500mL容量瓶、
②配制过程中,下列操作会导致所配溶液浓度偏小的是
A.容量瓶内有少量蒸馏水
B.移液时,液体不慎撒到容量瓶外
C.洗涤液未转移至容量瓶中
D.定容时俯视刻度线
您最近半年使用:0次
名校
解题方法
7 . 某实验小组利用微型实验装置进行氯气的制备和性质探究,装置如图所示,下列有关说法错误的是
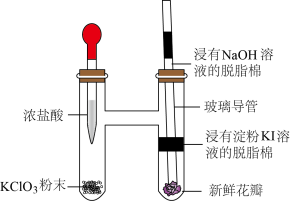
A. 与浓盐酸反应,HCl只体现还原性 与浓盐酸反应,HCl只体现还原性 |
B.浸有淀粉KI溶液的脱脂棉变蓝,说明氧化性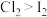 |
| C.新鲜花瓣褪色是因为氯气与水反应生成的HClO有漂白性 |
| D.浸有NaOH溶液的脱脂棉可吸收过量氯气 |
您最近半年使用:0次
2023-04-27更新
|
692次组卷
|
3卷引用:广东省大湾区2023届普通高中毕业班下学期联合模拟考试(二)化学试题
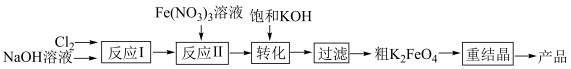
8 . 高铁酸钾(K2FeO4)是一种高效无毒的新型绿色消毒剂,制备流程如下:
资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ. 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定
(1)K2FeO4具有强氧化性,其中铁元素的化合价为_____ 价。
(2)反应I目的是制备NaClO,请写出其反应化学方程式___________ 。
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为________ (写化学式),生产1mol Na2FeO4转移的电子数为___ NA。
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式_______ 。
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用_______ (选“乙醇”或“水”)洗涤、干燥,可得纯度较高的K2FeO4。
(6)K2FeO4与稀硫酸反应:4 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
_______ (列出计算式即可)。 (物质的纯度
(物质的纯度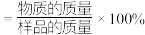 )
)

资料信息:
ⅰ.K2FeO4可溶于水,微溶于KOH溶液,难溶于乙醇,KOH易溶于乙醇
ⅱ.在碱性溶液中的溶解度:K2FeO4 < Na2FeO4
ⅲ.
 在碱性溶液中稳定,中性和酸性溶液中不稳定
在碱性溶液中稳定,中性和酸性溶液中不稳定(1)K2FeO4具有强氧化性,其中铁元素的化合价为
(2)反应I目的是制备NaClO,请写出其反应化学方程式
(3)反应Ⅱ为碱性条件下制备高铁酸钠(Na2FeO4),3NaClO+ 2Fe(NO3)3+ 10NaOH= 2Na2FeO4+ 6NaNO3+ 3NaCl+ 5H2O在该反应中还原产物为
(4)将反应Ⅱ产生的Na2FeO4提取后形成饱和溶液,与饱和KOH进行转化,请写出其反应化学方程式
(5)粗K2FeO4需进行重结晶操作以提纯,将粗产品溶于冷的稀KOH溶液中,过滤取滤液,加入饱和KOH溶液,置于冰水浴中,过滤取沉淀,所得沉淀用
(6)K2FeO4与稀硫酸反应:4
 +20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
+20H+=4Fe3++3O2↑+10H2O,通过测定生成O2的体积,可计算K2FeO4的纯度。取mg K2FeO4产品与稀硫酸反应,测得生成O2的体积为V mL(标准状况)。计算K2FeO4的纯度
 (物质的纯度
(物质的纯度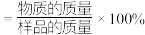 )
)
您最近半年使用:0次
9 . 次氯酸盐具有强氧化性。在碱性条件下,利用 氧化
氧化 生成高铁酸钾
生成高铁酸钾 的工艺流程如下:
的工艺流程如下:
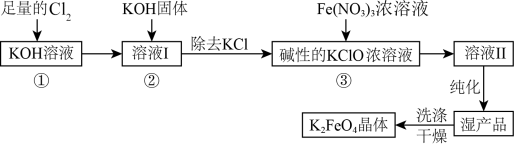
已知:①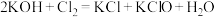 (条件:温度较低);
(条件:温度较低);
②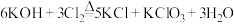 (条件:温度较高)。
(条件:温度较高)。
回答下列问题:
(1)反应①应在
(2)在溶液I中加入
 固体的目的是
固体的目的是(3)从溶液Ⅱ中分离出
 后,还会有副产品
后,还会有副产品 、
、 ,则反应③中发生的离子反应方程式为
,则反应③中发生的离子反应方程式为(4)
 可作饮用水处理剂,该反应的离子方程式:
可作饮用水处理剂,该反应的离子方程式: ,
, 处理水中悬浮颗粒物的原理是
处理水中悬浮颗粒物的原理是(5)目前,人们针对
 的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高
的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高 水溶液稳定性的物质是___________(填字母)。
水溶液稳定性的物质是___________(填字母)。A. | B. | C. | D. |
您最近半年使用:0次
2023-09-21更新
|
345次组卷
|
3卷引用:河南省部分名校2023-2024学年高三上学期核心模拟考试(一)化学试题
名校
10 . 下图为元素周期表的一部分 ,图中所列字母分别代表一种化学元素
(1)元素b、c、e形成的常见稳定单质中最易与H2化合的是_______ (填化学式)。
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为_______ ,其中所含化学键的类型有_______ 。
(3)推测原子序数为35的元素在元素周期表中的位置是_______ 。
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
(5)气体分子(ab)2中各原子最外层都达到8电子结构,该分子的电子式为_______ ,(ab)2称为拟卤素,性质与卤素单质相似,常温下其与NaOH溶液反应的化学方程式为_______ 。
| a | b | c | |||||||||||||||
| d | e | ||||||||||||||||
| …… | f | ||||||||||||||||
(2)元素d、e所形成的某化合物的摩尔质量为110 g·mol-1, 该化合物的化学式为
(3)推测原子序数为35的元素在元素周期表中的位置是
(4)依据元素周期律推测,元素f的单质及其化合物的性质正确的是_______(填字母)。
| A.f的单质常温下呈气态 |
| B.f的单质具有强氧化性 |
| C.fc3属于酸性氧化物 |
| D.fc2既有氧化性又有还原性 |
您最近半年使用:0次



