1 . NH3是一种重要的化工原料,在生产、生活中用途广泛。一定温度下,向恒容的密闭容器中充入 N2和 H2发生反应:N2+3H22NH3,测得各组分浓度随时间变化如图所示。

(1)表示 c(N2)的曲线是___________ 。(填“曲线 A”、“曲线 B”或“曲线 C”)
(2)0~t0时,v(H2)=___________ mol·L-1·min-1。
(3)下列措施不能使该反应速率加快的是___________ 。
a.升高温度 b.降低压强 c.使用催化剂
(4)下列能说明该反应达到平衡的是___________ 。
a.混合气体的压强不再变化 b.2c(H2)= 3c(NH3) c.混合气体的质量不再变化

(1)表示 c(N2)的曲线是
(2)0~t0时,v(H2)=
(3)下列措施不能使该反应速率加快的是
a.升高温度 b.降低压强 c.使用催化剂
(4)下列能说明该反应达到平衡的是
a.混合气体的压强不再变化 b.2c(H2)= 3c(NH3) c.混合气体的质量不再变化
您最近一年使用:0次
名校
解题方法
2 . 氨气是一种重要的化工产品,有广泛用途,工业上可由氢气和氮气合成氨气。回答下列问题:
(1)已知: ,该反应过程中的能量变化如图1所示。
,该反应过程中的能量变化如图1所示。

正反应的活化能 =
=______  ;
;
______________ .
(2)恒温下,将一定量 置于10L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2。则0~10min内的反应速率
置于10L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2。则0~10min内的反应速率
____ 。


(3)用 分别表示
分别表示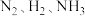 和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:
和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:
①吸附后,能量状态最低的是_______ (填序号)。
②结合上述原理,在固体Fe催化剂表面进行 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析,
的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析, 之前反应速率增加的原因可能是
之前反应速率增加的原因可能是_______ ; 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是_______ 。

(4)研究表明,合成氨的速率与相关物质的浓度的关系为 ,
,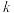 为速率常数。能使合成氨的速率增大的措施有______(填序号)。
为速率常数。能使合成氨的速率增大的措施有______(填序号)。
(1)已知:
 ,该反应过程中的能量变化如图1所示。
,该反应过程中的能量变化如图1所示。
正反应的活化能
 =
= ;
;
(2)恒温下,将一定量
 置于10L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2。则0~10min内的反应速率
置于10L密闭容器中发生上述反应,反应过程中各物质的浓度随时间的变化情况如图2。则0~10min内的反应速率


(3)用
 分别表示
分别表示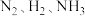 和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:
和固体Fe催化剂,则在固体催化剂表面合成氨的过程如图3所示:①吸附后,能量状态最低的是
②结合上述原理,在固体Fe催化剂表面进行
 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析,
的分解速率与其浓度的关系如图4所示。从吸附和解吸过程分析, 之前反应速率增加的原因可能是
之前反应速率增加的原因可能是 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是
(4)研究表明,合成氨的速率与相关物质的浓度的关系为
 ,
,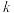 为速率常数。能使合成氨的速率增大的措施有______(填序号)。
为速率常数。能使合成氨的速率增大的措施有______(填序号)。| A.使用更有效的催化剂 | B.总压强一定,增大 的值 的值 |
| C.升高温度 | D.按照原来比值增大反应物的浓度 |
您最近一年使用:0次
2022-02-28更新
|
392次组卷
|
2卷引用:四川省成都外国语学校2021-2022学年高二上学期12月月考化学试题
名校
解题方法
3 . 氨气具有广泛用途,工业上利用反应:N2(g)+3H2(g) 2NH3(g) ΔH<0合成氨。其基本工业流程如图:
2NH3(g) ΔH<0合成氨。其基本工业流程如图:

(1)甲小组为了探究外界条件对反应的影响,在一恒温恒容容器中,以c0mol/LH2参加合成氨反应。在a、b两种条件下分别达到平衡,测得H2浓度与反应时间的关系示意图如图。

①a条件下,0~t0的平均反应速率v(N2)=___ 。
②相对a而言,b可能改变的条件是___ 。
③在a条件下,t1时刻将容器体积压缩至原来的一半,t2时刻重新建立平衡状态。请在图中画出t1~t2时刻c(H2)的变化曲线___ 。
(2)乙小组向一恒温恒压容器中充入9molN2和23molH2模拟合成氨反应,如图为不同温度下平衡混合物中氨气的体积分数φ(NH3)与总压强PT的关系图。

①根据图示信息,将T1、T2、T3按照由大到小的顺序排序:___ 。
②体系在T2、60MPa下达到平衡时,H2的平衡分压为___ MPa。(物质的平衡分压=体系总压×该物质的物质的量分数)
③比较正反应速率:v(A)___ v(C)(选填“>”“<”或“=”);v(B)___ v(D)(选填“>”“<”或“=”)。
④比较体系中气体的平均摩尔质量: (A)
(A)___  (C)(选填“>”“<”或“=”);
(C)(选填“>”“<”或“=”); (B)
(B)___  (D)(选填“>”“<”或“=”)。
(D)(选填“>”“<”或“=”)。
 2NH3(g) ΔH<0合成氨。其基本工业流程如图:
2NH3(g) ΔH<0合成氨。其基本工业流程如图:
(1)甲小组为了探究外界条件对反应的影响,在一恒温恒容容器中,以c0mol/LH2参加合成氨反应。在a、b两种条件下分别达到平衡,测得H2浓度与反应时间的关系示意图如图。

①a条件下,0~t0的平均反应速率v(N2)=
②相对a而言,b可能改变的条件是
③在a条件下,t1时刻将容器体积压缩至原来的一半,t2时刻重新建立平衡状态。请在图中画出t1~t2时刻c(H2)的变化曲线
(2)乙小组向一恒温恒压容器中充入9molN2和23molH2模拟合成氨反应,如图为不同温度下平衡混合物中氨气的体积分数φ(NH3)与总压强PT的关系图。

①根据图示信息,将T1、T2、T3按照由大到小的顺序排序:
②体系在T2、60MPa下达到平衡时,H2的平衡分压为
③比较正反应速率:v(A)
④比较体系中气体的平均摩尔质量:
 (A)
(A) (C)(选填“>”“<”或“=”);
(C)(选填“>”“<”或“=”); (B)
(B) (D)(选填“>”“<”或“=”)。
(D)(选填“>”“<”或“=”)。
您最近一年使用:0次
解题方法
4 . 近年来甲醇用途日益广泛,越来越引起商家的的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g)  CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
(1)下图中表示CH3OH的浓度变化的曲线是___________ (填字母)。
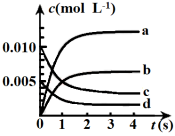
(2)用CH3OH表示从0~2s内该反应的平均速率v(CH3OH)=___________ 。随着反应的进行,该反应的速率在逐渐减慢的原因是___________ 。
(3)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量___________ 形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(4)甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示(质子交换膜可以通过H+):
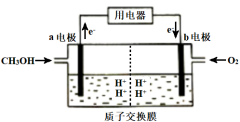
通入甲醇气体的电极为电池的___________ (填“正”或“负")极,电解质溶液中H+向 ___________ (填“a"或“b")电极移动。
 CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)下图中表示CH3OH的浓度变化的曲线是

(2)用CH3OH表示从0~2s内该反应的平均速率v(CH3OH)=
(3)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量
(4)甲醇燃料电池能量转化率高,对环境无污染。该燃料电池的工作原理如图所示(质子交换膜可以通过H+):

通入甲醇气体的电极为电池的
您最近一年使用:0次
名校
解题方法
5 . 生产生活中氨及铵盐有重要用途,而汽车尾气中含NO、NO2则应降低其排放。
(1)已知(活化能单位 ):
):
则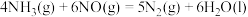 的
的
_______  。
。
(2) 的密闭容器中,按物质的量比
的密闭容器中,按物质的量比 投入氮气和氢气,发生反应
投入氮气和氢气,发生反应 用传感器测得温度为
用传感器测得温度为 时容器中
时容器中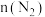 随时间变化如表:
随时间变化如表:
① 时,
时,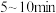 内
内 平均速率为
平均速率为
_______ ;
② 时,该反应平衡常数为
时,该反应平衡常数为_______ (列出计算式);
③x_______ 0.06(填“>”“<”或“=”),原因是_______ 。
④将 与
与 的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是
的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是_______ 。
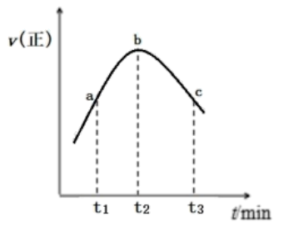
A.反应在b点达到平衡状态
B.从 到
到 逆反应的速率先增大后减小
逆反应的速率先增大后减小
C.a、b、c三点中,c点 的转化率最大
的转化率最大
D.如果将容器改为恒温恒容,其它条件不变,c点 的产率会变小
的产率会变小
(1)已知(活化能单位
 ):
):| 反应 | 正反应活化能 | 逆反应活化能 |
 | 282 | 102 |
 | a | b |
则
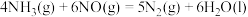 的
的
 。
。(2)
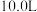 的密闭容器中,按物质的量比
的密闭容器中,按物质的量比 投入氮气和氢气,发生反应
投入氮气和氢气,发生反应 用传感器测得温度为
用传感器测得温度为 时容器中
时容器中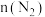 随时间变化如表:
随时间变化如表:物质的量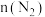 | 0 |  |  |  |  |
 |  | 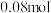 |  | 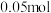 | 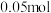 |
 |  | 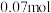 | _______ |  | 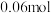 |
①
 时,
时,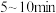 内
内 平均速率为
平均速率为
②
 时,该反应平衡常数为
时,该反应平衡常数为③x
④将
 与
与 的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是
的混合气体置于绝热恒容密闭容器中发生反应,正反应速率随时间变化的趋势如图所示(催化剂活性始终保持不变),下列说法正确的是
A.反应在b点达到平衡状态
B.从
 到
到 逆反应的速率先增大后减小
逆反应的速率先增大后减小C.a、b、c三点中,c点
 的转化率最大
的转化率最大D.如果将容器改为恒温恒容,其它条件不变,c点
 的产率会变小
的产率会变小
您最近一年使用:0次
2021-04-16更新
|
209次组卷
|
2卷引用:湖北省恩施高中、龙泉中学、宜昌一中2020-2021学年高三下学期4月联合考试化学试题
6 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为_______ 。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgI和AgCl都开始沉淀时,溶液中 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g)+I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①该反应的平衡常数K的计算式为:_______ 。(用表中数据表示,不必算出就具体数值)
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为_______ (以K和k正表示)。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgI和AgCl都开始沉淀时,溶液中
 为:
为:(3)已知反应2HI(g)=H2(g)+I2(g)的ΔH=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g)+I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
2021-03-02更新
|
150次组卷
|
2卷引用:江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题
7 . 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
(1)图中表示CH3OH的浓度变化的曲线是_______ (填字母)。
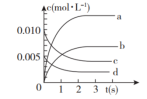
(2)用H2表示从0~2s内该反应的平均速率v(H2)=_______ 。随着反应的进行,该反应的速率逐渐减慢的原因是_______ 。
(3)该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量_______ 形成1mol CH3OH释放的能量(填“<”、“=”或“>”)。
(4)已知在400℃时,反应CO(g)+2H2(g) CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=
CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=_______ kJ。
(5)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O
+6H2O
则电池放电时通入空气的电极为_______ (“正”或“负”)极;从电极反应来看,每消耗1 mol CH3OH转移_______ mol电子。
 CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH)(mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)图中表示CH3OH的浓度变化的曲线是

(2)用H2表示从0~2s内该反应的平均速率v(H2)=
(3)该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量
(4)已知在400℃时,反应CO(g)+2H2(g)
 CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=
CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=(5)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2
 +6H2O
+6H2O则电池放电时通入空气的电极为
您最近一年使用:0次
2021-06-15更新
|
416次组卷
|
2卷引用:山东省临沂市兰陵县2020-2021学年高一下学期期中教学质量检测化学试题
名校
解题方法
8 . 乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):
Ⅰ.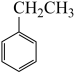 (g)⇌
(g)⇌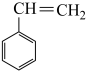 (g)+H2(g) △H=+124kJ·mol-1
(g)+H2(g) △H=+124kJ·mol-1
(1)部分化学键的键能如表所示:
根据反应I的能量变化,计算X=_______ 。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。请用化学平衡理论解释通入水蒸气的原因:_______ 。
(3)已知吉布斯自由能△G=△H-T△S ,当△G < 0时反应可自发进行。由此判断反应I在_______ (填“高温”或“低温”)更易自发进行。
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ. (g)+Cl2(g)⇌
(g)+Cl2(g)⇌ (g)+HCl(g) △H2>0
(g)+HCl(g) △H2>0
(4)T℃时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、 α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
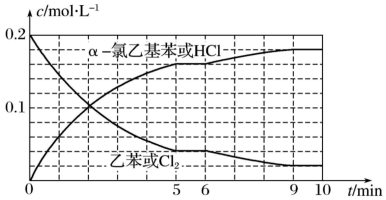
①0-2 min内,以HCl表示的该反应速率v(HCl)=_______ 。
②6 min时,改变的外界条件为_______ ,该条件下的平衡常数K的数值=_______ 。
③10 min时,保持其他条件不变,再向容器中充入1 mol乙苯、1 mol Cl2、1 molα-氯乙基苯和1mol HCl,则此时该反应v正_______ v逆(填“>”、“<”或“=” )。
(一)制备苯乙烯(原理如反应I所示):
Ⅰ.
 (g)⇌
(g)⇌ (g)+H2(g) △H=+124kJ·mol-1
(g)+H2(g) △H=+124kJ·mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | X | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。请用化学平衡理论解释通入水蒸气的原因:
(3)已知吉布斯自由能△G=△H-T△S ,当△G < 0时反应可自发进行。由此判断反应I在
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ.
 (g)+Cl2(g)⇌
(g)+Cl2(g)⇌ (g)+HCl(g) △H2>0
(g)+HCl(g) △H2>0(4)T℃时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、 α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0-2 min内,以HCl表示的该反应速率v(HCl)=
②6 min时,改变的外界条件为
③10 min时,保持其他条件不变,再向容器中充入1 mol乙苯、1 mol Cl2、1 molα-氯乙基苯和1mol HCl,则此时该反应v正
您最近一年使用:0次
解题方法
9 . CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是____ (填标号)。
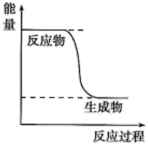
a.化学变化不仅有新物质生成,同时也一定有能量变化
b.H2的生成速率与CH3OH的消耗速率之比为1:2
c.CH3OH转变成H2的过程是一个吸收能量的过程
d.1molH—O键断裂的同时2molC=O键断裂,则反应达到平衡
(2)已知通常状况下3.2g甲醇完全燃烧生成二氧化碳和液态水,放出72.65kJ的热量,写出甲醇燃烧的热化学方程式____ 。
(3)某温度下,将4molCH3OH和2molO2充入2L密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速率v(H2)=___ ,则CH3OH的转化率为____ 。
(4)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是___ (填标号)。
①电池放电时通入空气的电极为负极;
②电池放电时电子由正极流向负极;
③电池放电时每消耗6.4gCH3OH转移1.2mol电子.
(1)已知CH3OH(g)+
 O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)=CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.化学变化不仅有新物质生成,同时也一定有能量变化
b.H2的生成速率与CH3OH的消耗速率之比为1:2
c.CH3OH转变成H2的过程是一个吸收能量的过程
d.1molH—O键断裂的同时2molC=O键断裂,则反应达到平衡
(2)已知通常状况下3.2g甲醇完全燃烧生成二氧化碳和液态水,放出72.65kJ的热量,写出甲醇燃烧的热化学方程式
(3)某温度下,将4molCH3OH和2molO2充入2L密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速率v(H2)=
(4)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO
 +6H2O。则下列说法正确的是
+6H2O。则下列说法正确的是①电池放电时通入空气的电极为负极;
②电池放电时电子由正极流向负极;
③电池放电时每消耗6.4gCH3OH转移1.2mol电子.
您最近一年使用:0次
名校
10 .  具有广泛的用途。
具有广泛的用途。
I.验室常用如图所示装置制取并收集 。
。

(1)实验室用 和
和 制取
制取 的化学方程式为
的化学方程式为_______ 。
(2)干燥 应选用的干燥剂是
应选用的干燥剂是_______ 。
(3)图1中方框内收集 的装置可选用图2中的
的装置可选用图2中的_______ (填序号)。理由是_______ 。
(4)尾气处理装置中使用倒置漏斗的作用是_______ 。
II.合成氨的反应对人类解决粮食问题贡献巨大。
反应为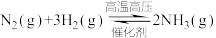 。一定温度下,向恒容的密闭容器中充入一定量的
。一定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。

(5)表示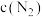 变化的曲线是
变化的曲线是_______ (填“A”“B”或“C”)。
(6)0~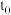 时用
时用 表示的化学反应速率:
表示的化学反应速率:
_______ 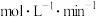 。
。
(7)下列能说明该反应达到平衡状态的是_______ (填序号,可多选)。
a容器中的压强不随时间变化
b.
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键
(8)人们曾认为 化学反应速率小,请写出两条能增大正反应速率的措施
化学反应速率小,请写出两条能增大正反应速率的措施_______ 。
 具有广泛的用途。
具有广泛的用途。I.验室常用如图所示装置制取并收集
 。
。
(1)实验室用
 和
和 制取
制取 的化学方程式为
的化学方程式为(2)干燥
 应选用的干燥剂是
应选用的干燥剂是(3)图1中方框内收集
 的装置可选用图2中的
的装置可选用图2中的(4)尾气处理装置中使用倒置漏斗的作用是
II.合成氨的反应对人类解决粮食问题贡献巨大。
反应为
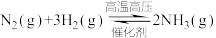 。一定温度下,向恒容的密闭容器中充入一定量的
。一定温度下,向恒容的密闭容器中充入一定量的 和
和 发生反应,测得各组分浓度随时间变化如图所示。
发生反应,测得各组分浓度随时间变化如图所示。
(5)表示
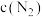 变化的曲线是
变化的曲线是(6)0~
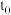 时用
时用 表示的化学反应速率:
表示的化学反应速率:
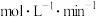 。
。(7)下列能说明该反应达到平衡状态的是
a容器中的压强不随时间变化
b.

c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键
(8)人们曾认为
 化学反应速率小,请写出两条能增大正反应速率的措施
化学反应速率小,请写出两条能增大正反应速率的措施
您最近一年使用:0次
2021-07-22更新
|
353次组卷
|
5卷引用:辽宁省葫芦岛市普通高中2020-2021学年高一下学期期末学业质量监测化学试题



