10-11高三·山东济宁·阶段练习
名校
解题方法
1 . 一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)⇌CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n molCO的同时生成n molH2 |
| D.1mol H-H键断裂的同时断裂2mol H-O键 |
您最近一年使用:0次
2024-01-19更新
|
278次组卷
|
64卷引用:贵州省平塘民族中学2021-2022学年高二上学期第一次月考化学试题
贵州省平塘民族中学2021-2022学年高二上学期第一次月考化学试题贵州省遵义航天高级中学2017-2018学年高二上学期第三次月考理综(理)化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高二上学期期末考试化学试题(已下线)6.2.2 化学反应的限度(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)【浙江新东方】双师155高一下.吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题吉林省长春外国语学校2021-2022学年高二上学期期初考试化学试题安徽省亳州市第二中学2021-2022学年高二上学期第一次月考化学试题辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高二上学期10月阶段性总结化学试题吉林省四平市普通高中2021-2022学年高二上学期期中考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题重庆市青木关中学校2021-2022学年高二上学期期中考试化学试题河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题甘肃省徽县第一中学2021-2022学年高二上学期11月月考化学试题(已下线)2012届山东省济宁市邹城二中高三第二次月考化学试卷(已下线)2011-2012学年湖北武汉部分重点中学高一下学期期末考试化学题(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2015-2016学年辽宁省沈阳市东北育才学校高二上化学试卷2015-2016学年四川省香港马会第五中学高二上10月月考化学试卷2015-2016学年山东省淄博市淄川一中高二上第一次阶段测化学试卷2015-2016学年湖南省株洲十八中高二上学期期末理化学试卷2015-2016学年新疆生产建设兵团二中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷四川省资阳中学2016-2017学年高一下学期期中化学试题福建省师范大学附属中学2016-2017学年高一下学期期末考试化学试题江西省吉安县第三中学2017-2018学年高二1月月考化学试题2017-2018学年高一化学人教版必修2:第二章检测题山东省师范大学附属中学2017-2018学年高一下学期第三次学分认定考试(期中)化学试题山东师范大学附属中学2017-2018学年高一下学期期中考试化学试题【全国市级联考】山东省德州市2017-2018学年高一下学期期末考试化学试题【全国市级联考】广东省潮州市2017-2018学年高一下学期期末考试化学试题(已下线)2018年9月30日 《每日一题》一轮复习-每周一测福建省漳州市东山县第二中学2019届高三上学期第三次月考化学试题步步为赢 高二化学暑假作业:作业九 化学反应速率和化学平衡河北省邢台市第二中学2018-2019学年下学期高一第四次月考化学试题浙江省台州市书生中学2019-2020学年高二年级上学期第一次月考化学试题云南省河口县高级中学2019-2020学年高二上学期期末考试化学试题山西省大同市天镇一中2019-2020学年高二上学期期中考试化学试题6.2.2 化学反应的限度化学反应条件的控制——2020年春高一新人教版第二册化学一课一练湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题2020年春高一化学新人教版第二册课后同步:6.2.2 化学反应的限度化学反应条件的控制山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题黑龙江省大庆中学2019-2020学年高一下学期期中考试化学试题安徽省亳州市涡阳县第九中学2018-2019学年高一下学期第三次月考化学试题吉林省白城市第一中学2019-2020学年高一下学期期末考试化学试题广东省汕头市金山中学2019-2020学年高一下学期期中考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)黑龙江省哈尔滨市第六中学2020-2021学年高二10月月考化学试题安徽省合肥市第一中学2019—2020学年高一下学期期末考试化学试题河北省保定市高碑店市高碑店一中2019---2020学年高一下学期第二次月考化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二上学期10月月考化学试题福建省福州第四中学2021-2022学年高一下学期3月月考化学试题(已下线)6.2.1 化学平衡(第1课时 可逆反应和化学平衡状态)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)浙江省杭州市源清中学2021-2022学年高一下学期期中考试化学试题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题吉林省洮南市第一中学2021-2022学年高一下学期第一次月考化学试题甘肃省天水市秦安县第一中学2022-2023学年高一下学期4月期中化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题上海市民办新虹桥中学2023-2024学年高二上学期期中考试化学试卷 山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期第一次月考化学试题 安徽省淮北市国泰中学2023-2024学年高二上学期期末考试化学试题
解题方法
2 . 一定温度下,在一恒容密闭容器中,发生反应 ,下列叙述中能说明反应达到平衡状态的是
,下列叙述中能说明反应达到平衡状态的是
 ,下列叙述中能说明反应达到平衡状态的是
,下列叙述中能说明反应达到平衡状态的是| A.单位时间内消耗3molM,同时生成2molR | B.混合气体的质量不再变化 |
| C.混合气体的密度不再变化 | D.N的物质的量分数不再变化 |
您最近一年使用:0次
3 . 我国在西昌卫星发射“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
I.有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-543 kJ·mol-1
H2(g)+F2(g)=2HF(g) ΔH2=-538 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-484 kJ·mol-1
则:N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH4=______ 。
II.氧化剂二氧化氮可由NO和O2生成。800°C时,在2 L密闭容器内,0.200 mol NO与0.100 mol O2反应:2NO(g)+O2(g) 2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
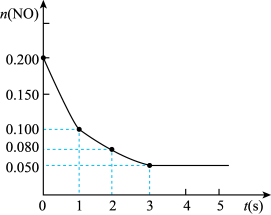
(2)已知:K(800℃)>K(1000℃),则该反应的ΔH______ 0(填“>”或“<”),用NO2表示从0~2 s内该反应的平均速率v(NO2)=______ 。
(3)能说明该反应已达到平衡状态的是______ 。
a.容器内颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(4)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有______ (任写一条)。
I.有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大。
(1)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-543 kJ·mol-1
H2(g)+F2(g)=2HF(g) ΔH2=-538 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-484 kJ·mol-1
则:N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH4=
II.氧化剂二氧化氮可由NO和O2生成。800°C时,在2 L密闭容器内,0.200 mol NO与0.100 mol O2反应:2NO(g)+O2(g)
 2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
2NO2(g) ΔH的体系中,已知n(NO)随时间的变化如图所示:
(2)已知:K(800℃)>K(1000℃),则该反应的ΔH
(3)能说明该反应已达到平衡状态的是
a.容器内颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(4)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有
您最近一年使用:0次
名校
解题方法
4 . 在恒容的密闭容器中进行下列可逆反应: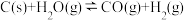 ;
;
现有下列状态:①混合气体的平均相对分子质量不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂 键的速率是断裂
键的速率是断裂 键速率的2倍;其中能表明反应达到平衡状态的是
键速率的2倍;其中能表明反应达到平衡状态的是
 ;
;现有下列状态:①混合气体的平均相对分子质量不再改变;②各气体的浓度相等;③反应体系中温度保持不变(假设为绝热容器);④相同时间内,断裂
 键的速率是断裂
键的速率是断裂 键速率的2倍;其中能表明反应达到平衡状态的是
键速率的2倍;其中能表明反应达到平衡状态的是| A.①②③ | B.②③ | C.②③④ | D.①③④ |
您最近一年使用:0次
5 . 一定温度下,向一容积为 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,发生反应:
,发生反应: 。当反应达到平衡时,容器内压强变为起始时的
。当反应达到平衡时,容器内压强变为起始时的 。请回答下列问题:
。请回答下列问题:
(1)判断该反应达到平衡状态的标志是___________ (填字母)。
 、
、 、
、 三者的浓度之比为
三者的浓度之比为
 .容器内气体的压强不变
.容器内气体的压强不变
 .容器内混合气体的密度保持不变
.容器内混合气体的密度保持不变
 的物质的量不再变化
的物质的量不再变化
 的生成速率和
的生成速率和 的生成速率相等
的生成速率相等
(2)回答下列问题:
① 的转化率为
的转化率为___________ 。
②达到平衡时反应放出的热量为___________ 。
③此温度下该反应的平衡常数
___________ 。
 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,发生反应:
,发生反应: 。当反应达到平衡时,容器内压强变为起始时的
。当反应达到平衡时,容器内压强变为起始时的 。请回答下列问题:
。请回答下列问题:(1)判断该反应达到平衡状态的标志是
 、
、 、
、 三者的浓度之比为
三者的浓度之比为
 .容器内气体的压强不变
.容器内气体的压强不变 .容器内混合气体的密度保持不变
.容器内混合气体的密度保持不变 的物质的量不再变化
的物质的量不再变化 的生成速率和
的生成速率和 的生成速率相等
的生成速率相等(2)回答下列问题:
①
 的转化率为
的转化率为②达到平衡时反应放出的热量为
③此温度下该反应的平衡常数

您最近一年使用:0次
名校
6 . 甲醇是一种重要的化工原料的具有开发和应用的广阔前景。工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)⇌CH3OH(g)△H。
I、在体积可变的密闭容器中投入0.5mol CO和0.75mol H2,不同条件下发生反应:CO(g) +2H2(g)⇌CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

(1)根据图象判断△H_______ 0 (填“<”或“>”);M点H2的转化率为_______ (保留三位有效数字)。
(2)(简M应混合气体的体积为1L,则506K时,该反应平衡常数K=_______ 。
(3)下列叙述能说明上述反应达到化学平衡状态的是_______ (填序号)。
a. v(H2)= 2v( CH3OH) b. CH3OH的体积分数不再改变c.混合气体的密度不再改变
(4)平衡后再加入0. 5mol CO和0.75mol H2后重新到达平衡,则CO的转化率_______ (填“增大”“不变”或“减小”)。
II.下图是甲醇燃料电池原理示意图。请回答下列问题:

(5)电池工作一段时间后电解质溶液PH_______ (填“增大”“减小”或“不变)
(6)该燃料电池的正极反应式为_______ 。
I、在体积可变的密闭容器中投入0.5mol CO和0.75mol H2,不同条件下发生反应:CO(g) +2H2(g)⇌CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

(1)根据图象判断△H
(2)(简M应混合气体的体积为1L,则506K时,该反应平衡常数K=
(3)下列叙述能说明上述反应达到化学平衡状态的是
a. v(H2)= 2v( CH3OH) b. CH3OH的体积分数不再改变c.混合气体的密度不再改变
(4)平衡后再加入0. 5mol CO和0.75mol H2后重新到达平衡,则CO的转化率
II.下图是甲醇燃料电池原理示意图。请回答下列问题:

(5)电池工作一段时间后电解质溶液PH
(6)该燃料电池的正极反应式为
您最近一年使用:0次
解题方法
7 . 为了更好地利用化学反应中物质和能量的变化,在化学研究和工业生产中还需要关注化学反应的快慢和限度。能量、速率与限度是认识和研究化学反应的重要因素。
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为___________ 。
(2)能说明此时反应已达到了平衡状态的是___________ (填标号)。
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
(3)0~50 s内的平均反应速率v(N2)=___________  。
。
(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中___________ (填“吸收”或“放出”)的能量为___________  。
。
(5)为加快反应速率,可采取的措施是___________ (填标号)。
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
Ⅰ.某温度下,在2 L的恒容密闭容器中,A、B、C(均为气体)三种物质的物质的量随时间的变化曲线如图所示。

(1)该反应的化学方程式为
(2)能说明此时反应已达到了平衡状态的是
a.A、B、C三种物质的浓度保持不变
b.气体A的消耗速率等于气体C的生成速率
c.混合气体的密度不变
d.总压强不变
Ⅱ.某温度下,向2.0 L的恒容密闭容器中充入2.0 molN2和2.0 molH2,发生反应,一段时间后反应达到平衡状态,实验数据如下表所示:
 | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
 。
。(4)键能指在标准状况下,将1 mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为
 ,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中
,已知N≡N键的键能为946 kJ/mol,H-H键的键能为436 kJ/mol,N-H键的键能为391 kJ/mol。则生成1 mol NH3的过程中 。
。(5)为加快反应速率,可采取的措施是
a.升高温度 b.增大容器体积 c.恒容时充入He d.加入合适催化剂
您最近一年使用:0次
解题方法
8 . 天然气是正要的燃料和化工原料,其主要成分是CH4,以及C2H6等烃类。
(1)在恒容密闭容器中发生如下反应:C2H6(g) C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:
C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:
①该反应的反应热为___ kJ•mol-1。
②下列能说明该反应已达到平衡状态的是__ 。
A.v(C2H6)=v(H2)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气体的颜色不变
③提高该反应平衡转化率的方法有__ 、___ 。
(2)在2L恒容密闭容器中,投入4molC2H4和4molH2,在一定条件下生成C2H6,测得不同温度下,平衡时C2H6的物质的量数据如表:
①温度T1___ (填“>”“<”或“=”)T3.
②在T2温度下,达到平衡时C2H4的转化率为___ 。
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的电极反应方程式为__ 。
②若消耗11.2LCO2时(标准状况下),转移电子的数目为__ NA。
(1)在恒容密闭容器中发生如下反应:C2H6(g)
 C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:
C2H4(g)+H2(g)∆H,已知相关键能数据如表所示:| 共价键 | H—H | C—H | C—C | C=C |
| E/(kJ•mol-1) | 436 | 413 | 344 | 614 |
②下列能说明该反应已达到平衡状态的是
A.v(C2H6)=v(H2)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气体的颜色不变
③提高该反应平衡转化率的方法有
(2)在2L恒容密闭容器中,投入4molC2H4和4molH2,在一定条件下生成C2H6,测得不同温度下,平衡时C2H6的物质的量数据如表:
| 温度/K | T1 | T2 | T3 | T4 |
| n(C2H6)/mol | 3.2 | 2.8 | 2.4 | 2.0 |
②在T2温度下,达到平衡时C2H4的转化率为
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的电极反应方程式为
②若消耗11.2LCO2时(标准状况下),转移电子的数目为
您最近一年使用:0次
名校
解题方法
9 . 甲醇是一种重要的可再生能源。已知:①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=akJ/mol,②CO(g)+2H2(g)=CH3OH(g) △H=bkJ/mol。
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:__________________ 。
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4 2NO2。
2NO2。
①0~20s内N2O4的平均反应速率为______________ 。
②该反应的平衡常数表达式K=______________ ,在80℃时该反应的平衡常数K值为____ (保留2位小数)。
③下列说法正确的是_____________ 。
A.温度越高,K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等最的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
④写出恒温恒容下,能判断该反应达到平衡状态的依据_____________ 、_____________ 。(写出2条即可)
(1)写出由CH4和O2制取CH3OH(g)的热化学方程式:
(2)在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | c | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4
 2NO2。
2NO2。①0~20s内N2O4的平均反应速率为
②该反应的平衡常数表达式K=
③下列说法正确的是
A.温度越高,K值越大,N2O4的转化率越高
B.加压,平衡逆向移动,气体颜色变浅
C.增大N2O4的浓度,新平衡建立过程中正反应速率不断加快
D.起始条件相同,将等最的N2O4分别在A、B两个相同的容器中反应建立平衡,A保持恒温、恒容;B保持恒温、恒压,达到平衡后,A中的N2O4平衡转化率小于B
④写出恒温恒容下,能判断该反应达到平衡状态的依据
您最近一年使用:0次
2020-08-06更新
|
484次组卷
|
5卷引用:贵州省铜仁市思南中学2020-2021学年高二上学期期末考试化学试题
贵州省铜仁市思南中学2020-2021学年高二上学期期末考试化学试题辽宁省葫芦岛市普通高中2019-2020高二上学期期末质量测试化学试题(已下线)第二章 化学反应速率和化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.3化学平衡常数(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)
解题方法
10 . (1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成原电池。
①H2SO4所含化学键为____________ ;
②若有0.4mole-流过导线,则理论上负极质量减少____________ g;
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是____________ (填“锌极”或“铜极”),原因是____________ (用电极方程式表示);
(2)①T1温度时,在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是
2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是____________
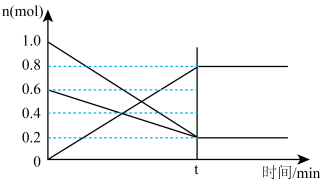
A.反应中NO与O2的物质的量之比为2:1
B.混合气体的总质量不随时间的变化而变化
C.单位时间内每消耗2nmolNO2,同时生成nmolO2
D.2v正(O2)=v逆(NO)
E.混合气体的压强不变
②0~t时间段,反应速率v(NO2)=____________ 。
①H2SO4所含化学键为
②若有0.4mole-流过导线,则理论上负极质量减少
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是
(2)①T1温度时,在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)
 2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是
2NO2(g)。容器中各反应物和生成物的物质的量随时间变化如图所示。下列能判断达到化学平衡的是
A.反应中NO与O2的物质的量之比为2:1
B.混合气体的总质量不随时间的变化而变化
C.单位时间内每消耗2nmolNO2,同时生成nmolO2
D.2v正(O2)=v逆(NO)
E.混合气体的压强不变
②0~t时间段,反应速率v(NO2)=
您最近一年使用:0次
2020-07-14更新
|
106次组卷
|
2卷引用:贵州省铜仁市2020-2021学年高一下学期期末质量监测化学试题



