解题方法
1 . 在2 L容器中500℃时下列关于反应2SO2+O2 2SO3 ΔH<0,叙述中正确的是
2SO3 ΔH<0,叙述中正确的是
 2SO3 ΔH<0,叙述中正确的是
2SO3 ΔH<0,叙述中正确的是| A.当v(SO2)正=2v(O2)逆时达到化学平衡状态 |
| B.当气体密度不变时达到化学平衡状态 |
| C.工业上常用10MPa的条件反应 |
| D.高温可提高SO2的转化率 |
您最近一年使用:0次
名校
解题方法
2 . 一定条件下的密闭容器中,发生可逆反应2SO2+O2 2SO3,能说明该反应一定达到化学平衡的是
2SO3,能说明该反应一定达到化学平衡的是
 2SO3,能说明该反应一定达到化学平衡的是
2SO3,能说明该反应一定达到化学平衡的是| A.SO3的含量保持不变 | B.反应停止 |
| C.v正≠v逆 | D.SO2完全转化成SO3 |
您最近一年使用:0次
2022-05-27更新
|
326次组卷
|
5卷引用:2021年海南省普通高中学业水平合格性考试化学试题
名校
解题方法
3 . 恒温下,在2L定容的密闭容器中进行反应:X2(g)+3Y2(g) 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1.下列说法中正确的是
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1.下列说法中正确的是
 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1.下列说法中正确的是
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1.下列说法中正确的是| A.当反应达到平衡时Y2的浓度有可能为0.6mol·L-1 |
| B.充入惰性气体可以增大化学反应速率 |
| C.若2min时n(X2)=0.15mol,则起始时v正>v逆 |
| D.当气体密度不再变化时,该反应达到平衡状态 |
您最近一年使用:0次
2022-01-07更新
|
93次组卷
|
4卷引用:海南省屯昌县屯昌中学2021-2022学年高二上学期10月月考化学试题
海南省屯昌县屯昌中学2021-2022学年高二上学期10月月考化学试题湖北省重点中学2020-2021学年高一下学期5月联考化学试题重庆市实验中学2021-2022学年上学期高二10月月考化学试题(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题
名校
4 . 在一容积不变密闭容器中发生可逆反应: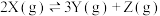
 ,以下说法正确的是
,以下说法正确的是
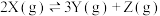
 ,以下说法正确的是
,以下说法正确的是| A.温度升高,平衡向右移动 |
| B.温度降低,平衡常数K增大 |
| C.若混合气体的密度不变,则反应达到平衡状态 |
| D.在容器中充入少量Y,逆反应速率增大,正反应速率减小 |
您最近一年使用:0次
5 . 一定温度下,在固定体积为2L的容器中铁与水蒸气反应可制得氢气:3Fe(S)+4H2O(g)⇌Fe3O4(s)+4H2(g) ∆H=+64.0kJ•mol-1
(1)该反应的平衡常数表达式为___________ ;
(2)该反应平衡后的混合气体的质量随温度的升高而___________ (填“增大”“减小”“不变”);
(3)下列叙述能作为反应达到平衡状态的标志的是___________ ;
A.该反应的∆H不变时 B.铁的质量不变时 C.当v(H2O)=v(H2)时
D.容器的压强不变时 E.混合气体的密度不变时
(4)一定温度下,在固定体积为2L的容器中进行着上述反应,若起始投料铁(s)、H2O(g)均为1mol,反应经过5min达到平衡,平衡混合气体中氢气的体积分数为50%,该反应的平衡常数K=_____ 。
(5)若平衡时,保持容器容积不变,使容器内压强增大,则平衡___________;
(1)该反应的平衡常数表达式为
(2)该反应平衡后的混合气体的质量随温度的升高而
(3)下列叙述能作为反应达到平衡状态的标志的是
A.该反应的∆H不变时 B.铁的质量不变时 C.当v(H2O)=v(H2)时
D.容器的压强不变时 E.混合气体的密度不变时
(4)一定温度下,在固定体积为2L的容器中进行着上述反应,若起始投料铁(s)、H2O(g)均为1mol,反应经过5min达到平衡,平衡混合气体中氢气的体积分数为50%,该反应的平衡常数K=
(5)若平衡时,保持容器容积不变,使容器内压强增大,则平衡___________;
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
您最近一年使用:0次
名校
6 . 对于反应
 ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是A.加入催化剂,改变了反应的途径,反应的 也随之改变 也随之改变 |
B.该反应 , , ,在任何条件下都能自发进行 ,在任何条件下都能自发进行 |
| C.恒温恒容条件下,混合气体密度不变时达到化学平衡状态 |
| D.达到平衡状态后,升高温度,正反应速率减小,逆反应速率增大 |
您最近一年使用:0次
2021-10-19更新
|
509次组卷
|
5卷引用:2021年海南高考化学试题变式题1-10
2021年海南高考化学试题变式题1-10天津市武清区杨村第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)辽宁省渤海大学附属高级中学2021-2022学年高二上学期第二次月考化学试题黑龙江省密山市第四中学2021-2022学年高二上学期期中考试化学(理)试题
解题方法
7 . 某温度下,在一恒容容器中发生反应 ,下列叙述能证明该反应已经达到化学平衡状态的是
,下列叙述能证明该反应已经达到化学平衡状态的是
 ,下列叙述能证明该反应已经达到化学平衡状态的是
,下列叙述能证明该反应已经达到化学平衡状态的是| A.容器内气体密度不再变化 |
| B.Y的体积分数不再变化 |
C. |
D.单位时间内消耗 同时生成 同时生成 |
您最近一年使用:0次
2021-07-14更新
|
227次组卷
|
2卷引用:海南省屯昌县屯昌中学2021-2022学年高二上学期10月月考化学试题
8 . 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
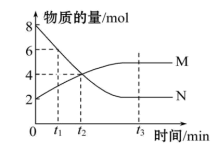
(1)该反应的化学方程式是_______ 。
(2)在图上所示的三个时刻中,___ (填“t1”“t2”或“t3”)时刻处于平衡状态;0~t2时间段内若t2=2min,v(N)=___ 。
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再变”__ (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是____ (选填字母)。
A.升高温度 B.降低压强
C.减小N的浓度 D.将反应容器体积缩小

(1)该反应的化学方程式是
(2)在图上所示的三个时刻中,
(3)已知M、N均为气体,若反应容器的容积不变,则“压强不再变”
(4)已知M、N均为气体,则下列措施能增大反应速率的是
A.升高温度 B.降低压强
C.减小N的浓度 D.将反应容器体积缩小
您最近一年使用:0次
名校
解题方法
9 . 李克强总理在十二届全国人大五次会议上作政府工作报告时强调:坚决打好蓝天保卫战。今年二氧化硫、氮氧化物排放量要分别下降3%,重点地区细颗粒物(PM2.5)浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为___________
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。现向2 L恒容密闭容器中加入2 mol CO2、6 mol H2,在恒温下发生反应。10 s后反应达到平衡,此时容器内CH3OH的浓度为0.5 mol·L-1,请回答以下问题:
(1)前10 s内的平均反应速率v(H2O)=___________ ;平衡时CO2的转化率为___________ 。
(2)下列叙述能说明原反应达到平衡状态的是___________ 。
a.单位时间内消耗n mol CH3OH的同时生成n mol CO2
b.1 mol CO2生成的同时有3 mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2溶解在水中,形成一种稀酸溶液,然后与Ca(OH)2浊液等发生中和反应。
(1)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是___________
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(2)请写出脱硫过程发生的主要化学方程式:___________ 。
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。现向2 L恒容密闭容器中加入2 mol CO2、6 mol H2,在恒温下发生反应。10 s后反应达到平衡,此时容器内CH3OH的浓度为0.5 mol·L-1,请回答以下问题:
(1)前10 s内的平均反应速率v(H2O)=
(2)下列叙述能说明原反应达到平衡状态的是
a.单位时间内消耗n mol CH3OH的同时生成n mol CO2
b.1 mol CO2生成的同时有3 mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2溶解在水中,形成一种稀酸溶液,然后与Ca(OH)2浊液等发生中和反应。
(1)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(2)请写出脱硫过程发生的主要化学方程式:
您最近一年使用:0次
2021-05-19更新
|
971次组卷
|
8卷引用:海南省儋州川绵中学2021-2022学年高二上学期第二次月考化学试题
海南省儋州川绵中学2021-2022学年高二上学期第二次月考化学试题河北省辛集中学2020-2021学年高二下学期期中考试化学试题河北省辛集中学2020-2021学年高一下学期期中考试化学试题江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷B卷化学试题(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题
名校
解题方法
10 . 在一定温度下的定容容器中,当下列物理量不再发生变化时,能说明I2(g)+H2(g)⇌2HI(g)能说明达到平衡状态的是:
①混合气体的压强
②混合气体的密度
③混合气体的总物质的量
④混合气体的平均相对分子质量
⑤混合气体的颜色
⑥各反应物或生成物的浓度之比等于化学计量数之比
⑦某种气体的百分含量
①混合气体的压强
②混合气体的密度
③混合气体的总物质的量
④混合气体的平均相对分子质量
⑤混合气体的颜色
⑥各反应物或生成物的浓度之比等于化学计量数之比
⑦某种气体的百分含量
| A.⑤⑦ | B.①② | C.④⑥⑦ | D.②④⑥⑦ |
您最近一年使用:0次
2020-11-29更新
|
510次组卷
|
6卷引用:海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题



