1 . 汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ•mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为K=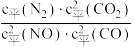 则此反应的热化学方程式为
则此反应的热化学方程式为___________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g)⇌4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1:p0=___________ 。2~5min内用NO2表示的该反应的平均反应速率为___________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___________ 。(填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)查阅资料发现,电解法也可制取高纯KIO3,工作原理如图,阳极电极反应方程式为___________ 。隔膜为___________ 交换膜(填“阳离子”或“阴离子”)。

(4)工业生产中可用间接电解法除NO。其原理如图所示:
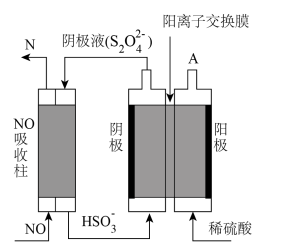
①从A口中出来的物质名称为___________ 。
②写出电解池阴极的电极反应式___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ•mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为K=
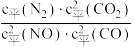 则此反应的热化学方程式为
则此反应的热化学方程式为(2)N2O5在一定条件下可发生分解:2N2O5(g)⇌4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/<mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)查阅资料发现,电解法也可制取高纯KIO3,工作原理如图,阳极电极反应方程式为

(4)工业生产中可用间接电解法除NO。其原理如图所示:

①从A口中出来的物质名称为
②写出电解池阴极的电极反应式
您最近一年使用:0次
名校
解题方法
2 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)已知在水中存在以下平衡: ,
, 。
。
①常温下 溶液的
溶液的
_______ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加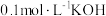 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是_______ 。
A.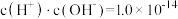 B.
B. 
C. D.
D. 
③已知常温下 的钙盐
的钙盐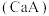 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: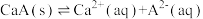
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有_______ 。
A.升高温度 B.降低温度 C.加入 晶体 D.加入
晶体 D.加入 固体
固体
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为_______ 。
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是_______ 。
(3)工业废水中含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

若平衡体系的 ,则溶液显
,则溶液显_______ 色。
②能说明第①步反应达平衡状态的是_______ 。
A. 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变
③第③步生成的 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: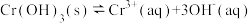 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至_______ 。
(1)已知在水中存在以下平衡:
 ,
, 。
。①常温下
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
②某温度下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加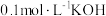 溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是A.
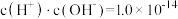 B.
B. 
C.
 D.
D. 
③已知常温下
 的钙盐
的钙盐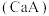 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: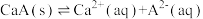
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入
 晶体 D.加入
晶体 D.加入 固体
固体(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:①联氨为二元弱碱,在水中的电离方程式与氨相似,则联氨第一步电离方程式为
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的
 溶液。肼-空气燃料电池放电时:负极的电极反应式是
溶液。肼-空气燃料电池放电时:负极的电极反应式是(3)工业废水中含有一定量的
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
若平衡体系的
 ,则溶液显
,则溶液显②能说明第①步反应达平衡状态的是
A.
 和
和 的浓度相同 b. v(
的浓度相同 b. v( )和v(
)和v( )相等 c.溶液的颜色不变
)相等 c.溶液的颜色不变③第③步生成的
 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: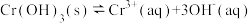 ,常温下,
,常温下, 的溶度积
的溶度积 ,要使
,要使 降至
降至 ,溶液的
,溶液的 应调至
应调至
您最近一年使用:0次
名校
3 . 下列关于化学反应速率和化学平衡的说法正确的是
| A.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加单位体积内活化分子百分数,从而使反应速率增大 |
B.已知反应: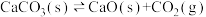 ,在密闭的反应炉内达到平衡后,若其他条件均不改变,将反应炉体积缩小一半,则达到新平衡时 ,在密闭的反应炉内达到平衡后,若其他条件均不改变,将反应炉体积缩小一半,则达到新平衡时 的浓度将升高 的浓度将升高 |
C.在一定温度下,容积一定的密闭容器中的反应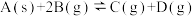 ,当混合气体的压强不变时,则表明该反应已达平衡 ,当混合气体的压强不变时,则表明该反应已达平衡 |
D.在一定条件下,可逆反应  达到平衡后。保持容器温度和容积不变,再通入一定量 达到平衡后。保持容器温度和容积不变,再通入一定量 ,则再次达到平衡时 ,则再次达到平衡时 的百分含量减小 的百分含量减小 |
您最近一年使用:0次
2022-12-09更新
|
685次组卷
|
5卷引用:山东省青岛第二中学2020-2021学年高二上学期期末化学试题
名校
解题方法
4 . H2NCOONH4是工业上由氨合成尿素的中间产物。在一定温度下、容积不变的密闭容器中发生反应H2NCOONH4(s)  2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
①每生成34gNH3的同时消耗44 gCO2
②混合气体的平均相对分子质量不变
③NH3的体积分数保持不变
④混合气体的密度保持不变
⑤c(NH3):c(CO2)=2:1
 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34gNH3的同时消耗44 gCO2
②混合气体的平均相对分子质量不变
③NH3的体积分数保持不变
④混合气体的密度保持不变
⑤c(NH3):c(CO2)=2:1
| A.①③⑤ | B.①④ | C.①②④ | D.①③④ |
您最近一年使用:0次
2022-11-03更新
|
252次组卷
|
6卷引用:山东省济南市商河县第三中学2021-2022学年高二10月月考化学试题
5 . 恒容密闭容器中充入3 mol CH4和6 mol H2S,发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是
CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是

 CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是
CS2(g)+4H2(g),温度变化对平衡时各组分的物质的量分数的影响如图所示。下列说法错误的是
| A.当满足v逆(H2S)=2v正(H2)时,反应达到平衡状态 |
| B.高温、低压条件有利于提高CH4的平衡转化率 |
| C.M点时,保持温度不变,继续充入3 mol CH4和6 mol H2S,达到新平衡时,CH4的物质的量分数小于H2 |
D.图中N点对应温度下,以物质的量分数表示的化学平衡常数Kx= |
您最近一年使用:0次
2020·浙江·模拟预测
6 . 一定温度下,在2 L的恒容密闭容器中发生反应:A(g)+2B(g) 3C(g)反应过程中的部分数据如下表所示:
3C(g)反应过程中的部分数据如下表所示:
下列说法正确的是
 3C(g)反应过程中的部分数据如下表所示:
3C(g)反应过程中的部分数据如下表所示:| 时间(t/min) | 物质的量(n/mol) | ||
| n(A) | n(B) | n(C) | |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 | ||
| A.0~5 min用A表示的平均反应速率为0. 09 mol·L-1·min-1 |
| B.该反应在10 min后才达到平衡 |
| C.平衡状态时,c(C)=0.6 mol·L-1 |
| D.物质B的平衡转化率为20% |
您最近一年使用:0次
2022-09-13更新
|
2762次组卷
|
36卷引用:山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题
山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题山东省滨州渤海中学2020-2021学年高二上学期10月月考化学试题高中化学苏教2019版必修第二册-专题6 第一单元综合拔高练人教版2019必修第二册 第六章 第二节综合拔高练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密09 化学反应速率与平衡(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一5月月考化学试题选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题浙江省东阳中学2019-2020学年高一下学期期中考试化学试题四川省射洪中学校2019-2020学年高一下学期期中考试化学试题河南省洛阳市2019-2020学年高一下学期期末考试化学试题河南省豫南九校2020-2021学年高二上学期第二次联考化学试题青海省海西蒙古族藏族自治州德令哈市海西州高级中学2020-2021学年高二上学期期中考试化学试题浙江省宁波市六校2020-2021学年高二上学期期中联考化学试题(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密09 化学反应速率与化学平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)广东省大联考2021-2022学年高一下学期期中检测化学试题广东省汕头市2021-2022学年高一下学期期末教学质量检测化学试题浙江省湖州中学2021-2022学年高一下学期第一次质量检测化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题(已下线)热点情景汇编-专题七 化学反应速率与平衡广东省广州市天河区第八十九中学2022~2023学年高一下学期期中考试化学选考试题(已下线)题型24 单反应体系中的化学平衡(已下线)专题15 化学反应速率和化学平衡2.2.3化学平衡常数 课后广西河池市八校联考2022-2023学年高一下学期4月月考化学试题黑龙江省鹤岗市第一中学2022-2023学年高一下学期期末考试化学试题
名校
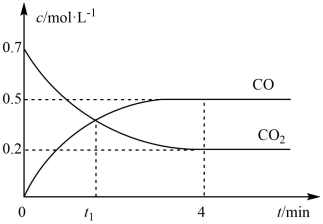
7 . 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(g)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(g)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
回答下列问题:
(1)t1时,CO2的正、逆反应速率的大小关系:v正____ (填“>”“<”或“=”)v逆。
(2)4min内,CO的平均反应速率v(CO)=____ 。
(3)由图可知,达到平衡时,n(CO2):n(CO)=____ 。
(4)下列条件的改变能减慢其反应速率的是____ (填序号)。
①降低温度
②减小铁粉的质量
③保持压强不变,充入He使容器的体积增大
④保持容积不变,充入He使体系压强增大
(5)下列描述能说明上述反应已达到平衡状态的是____ (填序号)。
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
 FeO(g)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(g)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
回答下列问题:
(1)t1时,CO2的正、逆反应速率的大小关系:v正
(2)4min内,CO的平均反应速率v(CO)=
(3)由图可知,达到平衡时,n(CO2):n(CO)=
(4)下列条件的改变能减慢其反应速率的是
①降低温度
②减小铁粉的质量
③保持压强不变,充入He使容器的体积增大
④保持容积不变,充入He使体系压强增大
(5)下列描述能说明上述反应已达到平衡状态的是
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
您最近一年使用:0次
2022-05-16更新
|
305次组卷
|
12卷引用:山东省济南市济南二中2020-2021高一下学期期中考试化学试题
山东省济南市济南二中2020-2021高一下学期期中考试化学试题山东省泰安第一中学2019-2020学年高一下学期期中考试化学试题山东省济宁市实验中学2019-2020学年高一下学期开学检测化学试题山东省日照市莒县第一中学2019-2020学年高一下学期返校调研考试化学试题河南省汤阴县五一中学2019-2020学年高一下学期第四次月考化学试题天津市第二南开学校2019-2020学年高一下学期阶段性检测化学试题河北省沧州市盐山县盐山中学2019-2020学年高一下学期开学考试化学试题甘肃省兰州市第一中学2019-2020学年高一下学期期末考试化学试题河南省兰考县第三高级中学卫星试验部2020-2021学年高二上学期第一次月考化学试题黑龙江省双鸭山市集贤县2021-2022学年高一下学期期中考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题四川省达州市宣汉县土黄中学2021-2022学年高一下学期期中考试化学试题
解题方法
8 . 将一片在空气中久置的铝片投入足量的0.5mol·L-1的硫酸中,产生氢气的速率v(H2)与反应时间t的关系如图所示。下列说法不正确的是


| A.为增大v(H2),可投入一片铜片,并与铝片接触 |
| B.ab段v(H2)增大的原因是该反应放热,使反应体系的温度升高 |
| C.t=b时,反应处于平衡状态 |
| D.oa段反应的离子方程式为:Al2O3+6H+=2Al3++3H2O |
您最近一年使用:0次
名校
9 . 下列说法正确的是
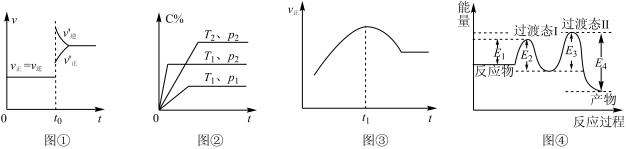

A.图①可表示向达到平衡状态的反应: ,在 ,在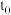 时刻充入了一定量的 时刻充入了一定量的 |
B.由图②可知,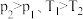 满足反应: 满足反应: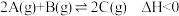 |
C.图③为在绝热恒容密闭容器中通入A和B,发生反应: 时刻体系达到平衡 时刻体系达到平衡 |
D.图④为某反应加入催化剂后相关能量变化,该总反应的活化能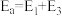 |
您最近一年使用:0次
2022-03-01更新
|
222次组卷
|
3卷引用:山东省菏泽第一中学2021-2022学年上学期高二12月月考化学试题
10 . 以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉,看似科幻的一幕,真实地发生在实验室里。中国科学家首次实现了二氧化碳到淀粉的从头合成,相关成果北京时间9月24日由国际知名学术期刊《科学》在线发表,因此CO2的捕集、利用与封存成为科学家研究的重要课题。已知CO2经催化加氢可以生成多种低碳有机物。
I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+40.9kJ·mol-1
III.CO(g)+2H2(g)=CH3OH(g) ΔH3
回答下列问题:
(1)反应III的ΔH3为_______ 。
(2)一定温度下,在一体积固定的密闭容器中进行反应I,测得CO2的物质的量浓度随反应时间的变化如图所示:
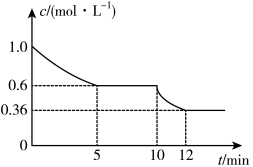
则反应进行的前5分钟内,H2的反应速率v(H2)=_______ ;10min时,改变的外界条件可能是_______ (任写两点)
(3)将CO2和H2按物质的量之比1:1投料发生反应II,下列不能说明反应已达平衡的是_______(填字母)。
(4)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是_______ (填“A”或“B”)。
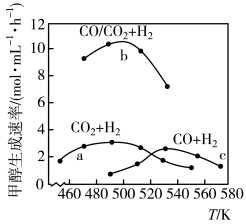
A.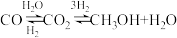
B.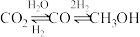
(5)C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH=+430KJ/mol,在四种不同的容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是
4CO(g)+3H2(g) ΔH=+430KJ/mol,在四种不同的容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_______ (填字母)。
a.恒温恒容容器 b.恒容绝热容器 c.恒压绝热容器 d.恒温恒压容器
I.CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+40.9kJ·mol-1
III.CO(g)+2H2(g)=CH3OH(g) ΔH3
回答下列问题:
(1)反应III的ΔH3为
(2)一定温度下,在一体积固定的密闭容器中进行反应I,测得CO2的物质的量浓度随反应时间的变化如图所示:

则反应进行的前5分钟内,H2的反应速率v(H2)=
(3)将CO2和H2按物质的量之比1:1投料发生反应II,下列不能说明反应已达平衡的是_______(填字母)。
| A.CO的浓度保持不变 |
| B.CO2和H2的转化率相等 |
| C.混合气体中CO2的百分含量不再发生变化 |
| D.单位时间内体系中减少1molH2的同时有1molH2O增加 |

A.
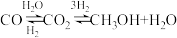
B.
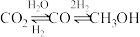
(5)C2H6(g)+2CO2(g)
 4CO(g)+3H2(g) ΔH=+430KJ/mol,在四种不同的容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是
4CO(g)+3H2(g) ΔH=+430KJ/mol,在四种不同的容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是a.恒温恒容容器 b.恒容绝热容器 c.恒压绝热容器 d.恒温恒压容器
您最近一年使用:0次



