1 . T℃时,向甲、乙、丙三个容积均为V L的密闭容器中,通入不同量的气体A和B,发生反应:A(g)+2B(g) 2C(s)+Q (Q>0)。已知该反应的平衡常数K=0.25。tl时刻,测得容器内气体浓度见表:
2C(s)+Q (Q>0)。已知该反应的平衡常数K=0.25。tl时刻,测得容器内气体浓度见表:
以下说法正确的是
 2C(s)+Q (Q>0)。已知该反应的平衡常数K=0.25。tl时刻,测得容器内气体浓度见表:
2C(s)+Q (Q>0)。已知该反应的平衡常数K=0.25。tl时刻,测得容器内气体浓度见表:| 容器 | c(A)(mol·L-1) | c(B)(mol·L-1) |
| 甲 | 4 | 1 |
| 乙 | 3 | 6 |
| 丙 | 1 | 2 |
| A.tl时刻,甲容器内:v正>v逆 |
| B.达到平衡时,乙、丙容积内气体密度不相等 |
| C.其他条件不变,适当升温,可使乙容积内A的平衡浓度为3 mol·L-1 |
| D.其他条件不变,将甲容器和丙容器连通,重新达到平衡时,c(A)>2.5 mol·L-1 |
您最近一年使用:0次
2021-09-25更新
|
522次组卷
|
2卷引用:上海交通大学附属中学2021-2022学年高三上学期摸底测试化学试卷题
名校
解题方法
2 . 在一固定容积的密闭容器中,进行如下反应:C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
(1)若容器体积为2 L,反应10秒后氢气的质量增加0.4 g,则该时间内一氧化碳的反应速率为___ mol/(L•s)。
(2)该反应达到平衡状态的标志是___ (选填编号)。
A.压强不变 B.v正(H2)=v正(H2O)
C.c(CO)不变 D.c(H2O)=c(CO)
(3)若增加炭的量,则正反应速率___ (选填“增大”、“减小”、不变);若增大压强,化学平衡向___ 移动(选填“正向”、“逆向”或“不”)。
(4)若升高温度,平衡向正向移动,则正反应方向为___ 反应。(填“吸热”或“放热”)
 CO(g)+H2(g)。
CO(g)+H2(g)。(1)若容器体积为2 L,反应10秒后氢气的质量增加0.4 g,则该时间内一氧化碳的反应速率为
(2)该反应达到平衡状态的标志是
A.压强不变 B.v正(H2)=v正(H2O)
C.c(CO)不变 D.c(H2O)=c(CO)
(3)若增加炭的量,则正反应速率
(4)若升高温度,平衡向正向移动,则正反应方向为
您最近一年使用:0次
名校
解题方法
3 . 在一密闭容器中,有一可逆反应为A(g) B(g),下列各项中,表示已达到平衡的是
B(g),下列各项中,表示已达到平衡的是
 B(g),下列各项中,表示已达到平衡的是
B(g),下列各项中,表示已达到平衡的是| A.c(A)=c(B) |
| B.压强不再发生变化 |
| C.A的物质的量浓度不再发生变化 |
| D.A的消耗速率等于B的生成速率 |
您最近一年使用:0次
解题方法
4 . 一定温度下,可逆反应A(g)+3B(g) ⇌2C(g),达到平衡状态的标志是
| A.反应物不再转化为生成物 |
| B.正逆反应的速率均为零 |
| C.A,B,C的分子数之比为1:3:2 |
| D.C生成的速率与C的分解速率相等 |
您最近一年使用:0次
解题方法
5 . 一定温度下的容积不变的密闭容器中发生可逆反应2SO2(g)+O2(g)  2SO3(g),不能说明该反应一定达到平衡状态的是
2SO3(g),不能说明该反应一定达到平衡状态的是
 2SO3(g),不能说明该反应一定达到平衡状态的是
2SO3(g),不能说明该反应一定达到平衡状态的是| A.SO3的质量保持不变 | B.SO2的百分含量保持不变 |
| C.总压强不变 | D.SO2、O2、SO3的物质的量之比为2︰1︰2 |
您最近一年使用:0次
解题方法
6 . 一定温度下,固定体积的密闭容器中发生反应M(g)+N(g)  2W(g),能说明该反应一定达到平衡的是
2W(g),能说明该反应一定达到平衡的是
 2W(g),能说明该反应一定达到平衡的是
2W(g),能说明该反应一定达到平衡的是| A.v (W)消耗=2 v (M)消耗 | B.v正=v逆=0 |
| C.容器内压强保持不变 | D.容器中物质的总质量不发生变化 |
您最近一年使用:0次
7 . 在恒容密闭容器中,发生反应M(g)⇌2N(g)  =Q(Q>0),下列说法正确的是( )
=Q(Q>0),下列说法正确的是( )
 =Q(Q>0),下列说法正确的是( )
=Q(Q>0),下列说法正确的是( )| A.反应速率之比始终是v逆=2v正 |
| B.改变条件使平衡正向移动时,转化率均增大 |
| C.混合气体的平均分子质量保持不变可判断该反应达到平衡 |
| D.加压,平衡逆向移动,正反应速率减小,逆反应速率加快 |
您最近一年使用:0次
解题方法
8 . 接触法制硫酸工艺中,其主反应在450℃左右并有催化剂存在下进行:2SO2(g) + O2(g)⇌2SO3(g) +190 kJ
(1)该热化学反应方程式的意义是____ 。该反应的平衡常数表达式K =____ ,该反应450℃时的平衡常数____ 500℃时的平衡常数(填“>”“<”或“=”)。
(2)下列描述能说明上述反应(反应容器体积不变)已达平衡的是______ 。
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2) =_____ mol/(L·min);如果要提高SO2转化率,可以采取哪些措施?请写出两种方法______ 、_____ 。
(4)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。_____ 。
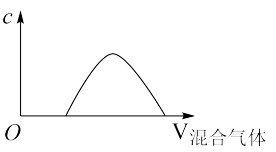
(5)将SO2与SO3的混合气体持续通入一定量的NaOH溶液中,产物中某离子的物质的量浓度与通入气体的体积有如图所示关系,该离子是____ 。
(1)该热化学反应方程式的意义是
(2)下列描述能说明上述反应(反应容器体积不变)已达平衡的是
a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2) =
(4)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。
(5)将SO2与SO3的混合气体持续通入一定量的NaOH溶液中,产物中某离子的物质的量浓度与通入气体的体积有如图所示关系,该离子是

您最近一年使用:0次
9 . 用 生产含氯有机物时会产生HCl。利用反应:
生产含氯有机物时会产生HCl。利用反应: 可实现氯的循环利用。完成下列填空:
可实现氯的循环利用。完成下列填空:
(1)上述反应中所有元素原子半径由大到小的顺序为___________ 。与氯元素同族的短周期元素原子最外层电子的轨道表示式为___________ 。
(2)判断氯、溴非金属性强弱的依据是___________ (选填序号)。
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2
c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(3)若反应在固定体积的密闭容器中发生,能说明反应已达平衡的是___________ (选填序号)。
a.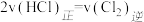 b.体系压强不再改变
b.体系压强不再改变
c.混合气体密度不变 d.
(4)若反应容器容积为2L,4molHCl与1mol 混合气体反应至8min时,恢复至原来温度,测得容器内气体压强减小了10%,则用HCl表示该反应的化学反应速率为
混合气体反应至8min时,恢复至原来温度,测得容器内气体压强减小了10%,则用HCl表示该反应的化学反应速率为___________ 。
(5)如下图是在2种不同投料比[ =1,6 ]下,温度对HCl平衡转化率影响的曲线。
=1,6 ]下,温度对HCl平衡转化率影响的曲线。

①曲线a对应的投料比 =
=___________ 。
②使曲线a达到曲线b相同的HCl平衡转化率,不改变投料比,可采取的措施有___________ ;___________ 。
 生产含氯有机物时会产生HCl。利用反应:
生产含氯有机物时会产生HCl。利用反应: 可实现氯的循环利用。完成下列填空:
可实现氯的循环利用。完成下列填空:(1)上述反应中所有元素原子半径由大到小的顺序为
(2)判断氯、溴非金属性强弱的依据是
a.熔点:Cl2<Br2 b.氧化性:Cl2>Br2
c.热稳定性:HCl>HBr d.酸性:HCl<HBr
(3)若反应在固定体积的密闭容器中发生,能说明反应已达平衡的是
a.
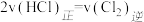 b.体系压强不再改变
b.体系压强不再改变c.混合气体密度不变 d.

(4)若反应容器容积为2L,4molHCl与1mol
 混合气体反应至8min时,恢复至原来温度,测得容器内气体压强减小了10%,则用HCl表示该反应的化学反应速率为
混合气体反应至8min时,恢复至原来温度,测得容器内气体压强减小了10%,则用HCl表示该反应的化学反应速率为(5)如下图是在2种不同投料比[
 =1,6 ]下,温度对HCl平衡转化率影响的曲线。
=1,6 ]下,温度对HCl平衡转化率影响的曲线。
①曲线a对应的投料比
 =
=②使曲线a达到曲线b相同的HCl平衡转化率,不改变投料比,可采取的措施有
您最近一年使用:0次
2020-12-26更新
|
217次组卷
|
2卷引用:上海市松江区2021届高三一模化学试卷
名校
解题方法
10 . 在醋酸溶液中,CH3COOH电离达到平衡的标志是
| A.溶液显电中性 | B.氢离子浓度恒定不变 |
| C.c(H+) = c(CH3COO¯) | D.溶液中检测不出CH3COOH分子存在 |
您最近一年使用:0次
2020-12-20更新
|
698次组卷
|
10卷引用:上海市虹口区2021届高三一模化学试题
上海市虹口区2021届高三一模化学试题甘肃省武威市民勤县第四中学2021届高三上学期期末考试(实验班)化学试题(已下线)第23讲 弱电解质的电离平衡(精讲)-2022年一轮复习讲练测天津市红桥区2020-2021学年高三上学期期末考试化学试题上海市长宁区2022-2023学年高三上学期教学质量调研(一模)化学试题上海市延安中学2022-2023学年高二上学期期末考试(等级)化学试题上海市行知中学2022-2023学年高二下学期2月月考化学试题上海市育才中学2022-2023学年高二下学期第二次教学质量检测(等级考)化学调研卷(已下线)第23讲 弱电解质的电离平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)广东省深圳市翠园中学2022-2023学年高二上学期期中考试化学试题



