1 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 除去锅炉水垢中的CaSO4 | 先用碳酸钠溶液浸泡水垢,然后再用盐酸除去 | 利用Ksp(CaSO4)>Ksp(CaCO3),实现沉淀的转化 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 水溶液中的离子反应与平衡在生活中应用广泛。下列说法不正确的是
A.已知人体体液中存在如下平衡:CO2+H2O H2CO3 H2CO3 H++HCO H++HCO ,当静脉滴注大量生理盐水时,平衡向右移动,体液的pH增大 ,当静脉滴注大量生理盐水时,平衡向右移动,体液的pH增大 |
B.牙齿表面覆盖的牙釉质存在如下平衡:Ca5(PO4)3OH(s) 5Ca2+(ag)+3PO 5Ca2+(ag)+3PO (aq)+OH-(aq),牙齿上残余的糖会发酵产生H+,加快牙釉质的酸蚀 (aq)+OH-(aq),牙齿上残余的糖会发酵产生H+,加快牙釉质的酸蚀 |
| C.用100mL0.01mol/L硫酸洗涤BaSO4沉淀,与用等体积的蒸馏水洗涤相比,BaSO4损失更多 |
| D.人们洗发时所用的洗发液的pH约为7.5,洗净后再使用具有保护头发、调节pH功能的护发素 |
您最近半年使用:0次
3 . 在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一、甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应I CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0
反应II CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0
反应III CO(g) +H2O(g) CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3
(1)已知部分化学键的键能数据如下表:
则ΔH3=___________ ,若反应III的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= ____ kJ·mol-1。
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有___________ 。
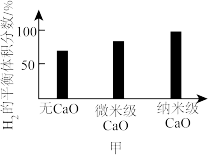
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是___________ 。
③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是___________ (填字母)。
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是___________ ,CH4的平衡转化率随温度升高而增大的原因是___________ 。
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为___________ mol·L-1·min-1,反应III的压强平衡常数Kp=___________ 。(用含m,n,t的代数式表示)
反应I CH4(g) +H2O(g)
 CO(g) +3H2(g) ΔH1>0
CO(g) +3H2(g) ΔH1>0反应II CH4(g) +2H2O(g)
 CO2(g) +4H2(g) ΔH2>0
CO2(g) +4H2(g) ΔH2>0反应III CO(g) +H2O(g)
 CO2(g) +H2(g) ΔH3
CO2(g) +H2(g) ΔH3(1)已知部分化学键的键能数据如下表:
| 化学键 | O-H | H-H | C=O | C≡O( CO) |
| 键能/(kJ·mol -1) | 463 | 436 | 803 | 1075 |
(2)①恒温条件下,在体积不变的密闭容器中充入1 mol CO(g)和2 mol H2O(g),发生反应III,欲使CO的转化率和H2的产率同时提高,可以采取的措施有
②已知比表面积是指单位质量物料所具有的总面积。实验表明,向体系中投入CaO固体可以增大H2的体积分数,选用相同质量、不同粒径的CaO固体进行实验时,结果如图甲所示。投入微米级CaO比纳米级CaO,H2的平衡体积分数低的原因是

③在一恒容绝热容器中以物质的量之比1:2投入CO(g)和H2O(g),发生反应III,下列物理量不再改变能说明该反应到达平衡状态的是
A. H2体积百分含量 B.体系温度
C. CO与H2O的物质的量之比 D.混合气体密度
(3)不同压强下,按照n(CH4):n( H2O) =1:3投料发生上述三个反应,CH4的平衡转化率α(CH4)随温度的变化关系如图乙所示。

压强p1、p2、p3由大到小的顺序是
(4)一定温度下,向2 L容器中充入1 mol CH4(g)和3 mol H2O(g) ,t min后反应达到平衡,容器中CO为mmol,CO2为nmol。则tmin内CH4的消耗速率为
您最近半年使用:0次
4 . 工业上用接触法制备浓硫酸的原理如下:
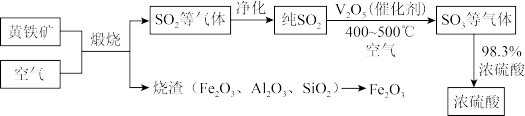
已知:
下列说法错误的是
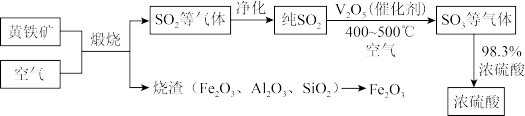
已知:

下列说法错误的是
| A.增大空气浓度可以加快煅烧速率 |
| B.尾气经净化后循环利用可以提高原料利用率 |
C.温度越高,越有利于 催化氧化反应 催化氧化反应 |
D.工业生产中充入适当过量空气能提高 转化率 转化率 |
您最近半年使用:0次
名校
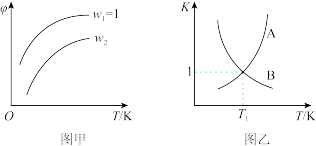
5 . 已知反应:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
 CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
| A.图甲中W2>1 |
| B.图乙中,A线表示逆反应的平衡常数 |
| C.温度为T1,W=2时,Cl2的转化率为50% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大 |
您最近半年使用:0次
2022-05-18更新
|
1093次组卷
|
25卷引用:河南省实验中学2021-2022学年高三上学期期末考试化学试题
河南省实验中学2021-2022学年高三上学期期末考试化学试题湖北省黄冈市2018届高三上学期元月调研考试理综化学试题(已下线)2019年9月27日 《每日一题》2020年高考一轮复习-化学平衡常数和转化率(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》吉林省白城市通榆县第一中学2020届高三上学期第三次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时3 化学平衡图象山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)湖北省恩施咸丰春晖学校2021-2022学年高二上学期第一次月考化学试题安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题山东省实验中学2021-2022学年高三上学期第二次诊断考试化学试题安徽省青阳县第一中学2021-2022学年高二下学期5月月考化学试题(已下线)第11练 以化学平衡图像突破化学平衡移动原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题广东省深圳外国语学校2022-2023学年高二上学期期末考试化学试题(已下线)第七章 化学反应速率与化学平衡 第42练 化学平衡常数及转化率的计算湖南省张家界市2023届高三下学期模拟考试化学试题河北省衡水中学2023届高三下学期第五次综合素养测评化学试题(已下线)考点23 化学平衡常数(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2023-2024学年高二上学期第一次月考化学试题安徽省芜湖市第十二中学2023-2024学年高二上学期10月月考化学试题江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
名校
6 . N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g)⇌CO2(g)+N2(g)来说,Fe+可作为此反应的催化剂。其总反应分两步进行,第一步为Fe++N2O⇌FeO++N2,第二步为_______ (写方程式)。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)⇌2N2(g)+O2(g)。容器I、II、III中N2O的平衡转化率如图乙所示,请回答:
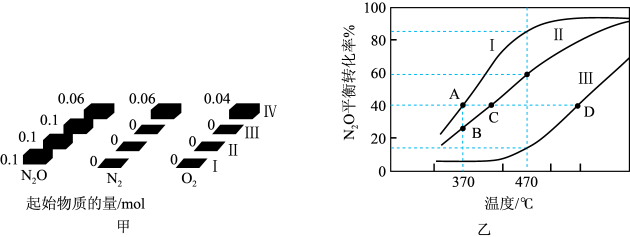
①该反应的ΔH_______ (填“>”或“<”)0.
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为_______ 。B点对应的平衡常数K=_______ (保留两位有效数字)。
③图中A、C、D三点容器内气体密度由大到小的顺序是_______ 。
④若容器IV体积为1L,反应在370℃下进行,则起始时反应______ (填“正向”“逆向”或“不”)进行。
(1)对于反应N2O(g)+CO(g)⇌CO2(g)+N2(g)来说,Fe+可作为此反应的催化剂。其总反应分两步进行,第一步为Fe++N2O⇌FeO++N2,第二步为
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g)⇌2N2(g)+O2(g)。容器I、II、III中N2O的平衡转化率如图乙所示,请回答:

①该反应的ΔH
②若容器I的体积为2L,反应在370℃下进行,20s后达到平衡,则0~20s内容器I中用O2表示的反应速率为
③图中A、C、D三点容器内气体密度由大到小的顺序是
④若容器IV体积为1L,反应在370℃下进行,则起始时反应
您最近半年使用:0次
2022-04-28更新
|
122次组卷
|
2卷引用:河南省信阳市2022-2023学年高二上学期期末考试化学试题
名校
解题方法
7 . 铂和钯同属于铂族元素,其价格均高于黄金,在工业上有广泛的应用。电解精炼铜阳极泥中除含有较多的铂、钯和银以外,还有少量的镍、铜等元素。一种综合提取阳极泥中贵重金属的工艺流程如下:
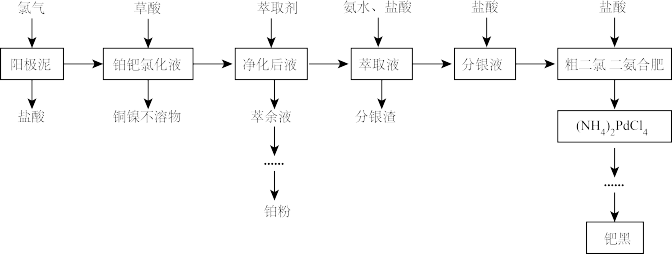
请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是_______ 。
(2)阳极泥中的单质钯反应后转化为 请写出该反应的离子方程式
请写出该反应的离子方程式_______ 。
(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
表2反应温度对铜镍去除率的影响
则草酸的过量系数应为_______ 。实际工业中采用的温度为80—85℃。试分析其原因_______ 。
(4)已知 配离子存在解离平衡:
配离子存在解离平衡: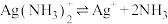 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理_______ 。
(5)分银液中加盐酸把 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为_______ 。
(6)海绵钯具有优良的吸氢功能,其密度为 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=_______  ,氢气的浓度r=
,氢气的浓度r=_______ (吸附容量R是指1g钯吸附氢气的体积;氢气的浓度r为 吸附氢气的物质的量)。
吸附氢气的物质的量)。

请回答以下问题。
(1)铜阳极泥中的铂和钯以游离态存在的理由是
(2)阳极泥中的单质钯反应后转化为
 请写出该反应的离子方程式
请写出该反应的离子方程式(3)用草酸除铜镍时,草酸用量对铜镍去除率的影响如下表1。除铜镍时的温度对去除率的影响如下表2。
表1草酸加入量对铜镍去除率的影响
| 过量系数 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 1.0 | 16.93 | 1.47 | 68.44 | 46.15 |
| 1.5 | 4.67 | 0.61 | 91.30 | 77.66 |
| 2.0 | 0.091 | 0.031 | 99.83 | 98.86 |
| 2.5 | 0.25 | 0.042 | 99.53 | 98.46 |
| 3.0 | 0.28 | 0.040 | 99.48 | 98.53 |
| 4.0 | 0.26 | 0.035 | 99.52 | 98.72 |
| 温度 | 净化后液/( ) ) | 去除率/% | ||
 |  |  |  | |
| 70 | 0.65 | 0.130 | 98.799 | 95.24 |
| 75 | 0.26 | 0.091 | 9.52 | 96.67 |
| 80 | 0.18 | 0.043 | 99.66 | 98.42 |
| 85 | 0.15 | 0.045 | 99.72 | 98.35 |
| 90 | 0.14 | 0.042 | 99.74 | 98.46 |
| 95 | 0.14 | 0.040 | 99.74 | 98.53 |
(4)已知
 配离子存在解离平衡:
配离子存在解离平衡: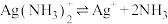 ,根据平衡移动原理说明加盐酸分银的原理
,根据平衡移动原理说明加盐酸分银的原理(5)分银液中加盐酸把
 转化为
转化为 沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为
沉淀,过滤后用适量的盐酸溶解。则加入盐酸溶解时的化学方程式为(6)海绵钯具有优良的吸氢功能,其密度为
 。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R=
。标准状况下,吸附氢气的体积是钯体积的a倍,则此条件下海绵钯的吸附容量R= ,氢气的浓度r=
,氢气的浓度r= 吸附氢气的物质的量)。
吸附氢气的物质的量)。
您最近半年使用:0次
2022-03-31更新
|
458次组卷
|
5卷引用:河南省郑州市2022届高三第二次质量预测理科综合化学试题
河南省郑州市2022届高三第二次质量预测理科综合化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷02(山东卷)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)湖南省湘潭市第一中学2023届高三第六次月考化学试题
名校
8 . 化学与生产生活息息相关,下列说法不正确 的是
| A.泡沫灭火器喷出的主要物质是Al(OH)3和CO2 |
| B.长期使用(NH4)2SO4作化肥会使土壤酸化 |
| C.电解饱和食盐水可以得到金属钠和氯气 |
| D.合成氨工业中,将NH3及时液化分离有利于提高反应物的利用率 |
您最近半年使用:0次
2022-03-23更新
|
226次组卷
|
4卷引用:河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题
名校
9 . 在CuCl2溶液中存在如下平衡:[CuCl4]2-(黄色)+4H2O [Cu(H2O)4]2+(蓝色)+4Cl-下列说法中不正确的是
[Cu(H2O)4]2+(蓝色)+4Cl-下列说法中不正确的是
 [Cu(H2O)4]2+(蓝色)+4Cl-下列说法中不正确的是
[Cu(H2O)4]2+(蓝色)+4Cl-下列说法中不正确的是| A.将CuCl2固体溶于大量水中得到蓝色溶液 |
| B.当[CuCl4]2-和[Cu(H2O)4]2+达一定比例时,溶液呈现绿色 |
| C.1mol[Cu(H2O)4]2+配离子中含σ键数目为4NA |
| D.[CuCl4]2-和[Cu(H2O)4]2+,中心离子为Cu2+,配位数均为4,配位原子分别为Cl和O |
您最近半年使用:0次
2022-03-19更新
|
361次组卷
|
2卷引用:河南省济源高级中学2022-2023学年高二下学期4月月考 化学试卷
名校
解题方法
10 . 温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:
下列说法正确的是
 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
| A.反应0~4min的平均速率v(Z)=0.25mol·L-1·min-1 |
| B.T1时,反应的平衡常数K1=1.2 |
| C.其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0 |
| D.其他条件不变,9min后,向容器中再充入1.6molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大 |
您最近半年使用:0次
2022-03-14更新
|
188次组卷
|
3卷引用:河南省豫南名校2022-2023学年高二上学期期中联考化学试题



