名校
解题方法
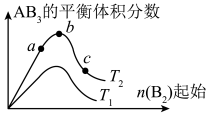
1 . 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
| A.反应速率a>b>c |
| B.达到平衡时,AB3的物质的量大小为:b > c > a |
| C.若T2>T1,则正反应一定是吸热反应 |
| D.达到平衡时A2的转化率大小为:b>a>c |
您最近半年使用:0次
2016-12-09更新
|
828次组卷
|
16卷引用:福建省泰宁第一中学2018-2019学年高二上学期第二阶段考试化学(理)试题
福建省泰宁第一中学2018-2019学年高二上学期第二阶段考试化学(理)试题(已下线)2012-2013学年江西上饶中学高二第一次月考(潜能班)化学试卷(已下线)2012-2013学年天津市天津一中高二上学期期中考试化学试卷(已下线)2012-2013学年河南省河南大学附中高二上学期期中考试化学试卷(已下线)2014秋湖北省武汉市部分重点中学高二上学期期中联考化学试卷2016-2017学年辽宁省鞍山一中高二上期中化学试卷2017届河北省定州中学高三上期中化学试卷1【校级联考】湖北省重点高中联考协作体2018-2019学年高二上学期期中考试化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题江西省南昌市第二中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】1. 新建二中 李莹 梁莎河北省沧州市盐山中学2020-2021学年高二上学期期中考试化学试题江西省南昌市新建区第二中学2020-2021学年高二上学期10月份考试化学试题江西省名校2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2022-2023学年高三8月月考化学试题天津市滨海新区塘沽第一中学2020-2021学年高二上学期第一次月考化学试题
11-12高二上·福建·期中
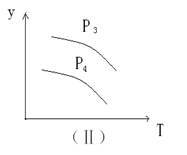
2 . 在某密闭容器中,可逆反应:A(g)+B(g)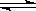 xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
 xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是

| A.P3﹥P4, y轴表示A的百分含量 |
| B.P3﹤P4, y轴表示B的百分含量 |
| C.P3﹤P4, y轴表示混合气体的密度 |
| D.P3﹥P4, y轴表示混合气体的平均相对分子质量 |
您最近半年使用:0次
11-12高二上·福建三明·期中
解题方法
3 . I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________ 。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________ 反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5L。该条件下的平衡常数为K3。则K3________ K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应______________ 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s) 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。

(1)0~10min 容器内气体的压强逐渐___________________ 。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是_____________ ,第13min时曲线变化的原因可能是______________ (填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
 CO + H2O,
CO + H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为
(3)在(1)的基础上,压缩容器体积之0.5L。该条件下的平衡常数为K3。则K3
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)
 2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
(1)0~10min 容器内气体的压强逐渐
(2)推测在第7min时曲线变化的原因可能是
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
您最近半年使用:0次
9-10高二下·福建福州·期末
名校
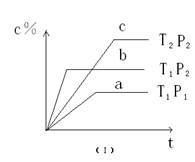
4 . 在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g) 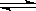 nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是
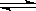 nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
您最近半年使用:0次
2016-12-09更新
|
784次组卷
|
10卷引用:2010年福建省福州八中高二第二学期期末考试化学试题
(已下线)2010年福建省福州八中高二第二学期期末考试化学试题(已下线)2010年广东省东莞市光明、常平、厚街、万江四校高二上学期期中考试化学试卷(已下线)2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷2015届山东省桓台县第二中学高三1月检测化学试卷2016届山东省桓台第二中学高三上学期期中测试化学试卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年陕西省延安市黄陵中学高二下期末化学试卷江西省南昌市进贤县第一中学2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】2019 进贤一中 高二上 期中新疆阿勒泰地区2018-2019学年高二上学期期末考试化学试题
12-13高二下·福建泉州·期中
5 . 在密闭容器中发生反应:X+3Y  2Z ΔH < 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
2Z ΔH < 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
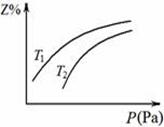
 2Z ΔH < 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
2Z ΔH < 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
| A.T1大于T2 |
| B.Y一定呈气态 |
| C.升高温度,该反应的化学平衡常数增大 |
| D.当n(X):n(Y):n(Z)=1:3:2时,反应一定达到平衡状态 |
您最近半年使用:0次
2016-08-11更新
|
187次组卷
|
4卷引用:2012-2013学年福建省晋江市季延中学高二下学期期中考试化学试卷
(已下线)2012-2013学年福建省晋江市季延中学高二下学期期中考试化学试卷2015-2016学年内蒙古包头九中高一下期末化学试题2016-2017学年四川省新津中学高二上10月月考化学试卷湖北省公安县第三中学2020-2021学年高三上学期8月月考化学试题
6 . 对反应N2O4(g) 2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
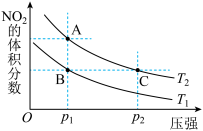
 2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是
2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是 
| A.B、C两点的反应速率:B>C |
| B.由状态B到状态A,可以用加热的方法 |
| C.C点颜色比A点深 |
| D.A、C两点的化学平衡常数:A>C |
您最近半年使用:0次



