名校
1 . T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是
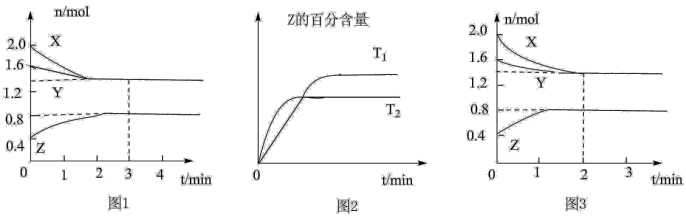

| A.容器中发生的反应可表示为3X(g)+Y(g) ==2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1 |
| C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
| D.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
您最近半年使用:0次
名校
2 . 下列有关图象,其中说法正确的是


| A.由图Ⅰ知,反应在 T1、T3 处达到平衡 |
| B.由图Ⅰ知,该反应的△H<0 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
您最近半年使用:0次
2018-12-05更新
|
1003次组卷
|
10卷引用:【全国百强校】福建省师范大学附属中学2018-2019学年高二(理)上学期期中考试化学试题
【全国百强校】福建省师范大学附属中学2018-2019学年高二(理)上学期期中考试化学试题【全国百强校】福建省师范大学附属中学2018-2019学年高二(实验班)上学期期中考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二上学期期中考试化学试题安徽省蚌埠市六校2019-2020学年高二上学期期中考试化学试题湖北省武汉市蔡甸区汉阳一中2019-2020学年高一下学期期中联考化学试题四川省宜宾翠屏棠湖学校2020-2021学年高二上学期10月月考化学试题江西省南昌市外国语学校2020~2021学年高二上学期期中考试理科化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期初考试化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题陕西省汉中市洋县中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
3 . 反应mX(g) +nY(g)  pZ(g) 在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间的关系如图所示。下述判断
pZ(g) 在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间的关系如图所示。下述判断
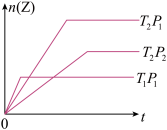
| A.T1<T2 ,P1>P2 |
| B.T1<T2 ,m+n<p |
| C.m+n>p ,正反应放热 |
| D.P1>P2,正反应吸热 |
您最近半年使用:0次
2018-10-31更新
|
207次组卷
|
4卷引用:【全国百强校】福建省仙游第一中学2018-2019学年高二上学期期中考试化学试题
名校
4 . 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)△H=-394.0kJ/mol,保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度)。下列有关说法正确的是
CaS(s)+3CO2(g)△H=-394.0kJ/mol,保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度)。下列有关说法正确的是
 CaS(s)+3CO2(g)△H=-394.0kJ/mol,保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度)。下列有关说法正确的是
CaS(s)+3CO2(g)△H=-394.0kJ/mol,保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度)。下列有关说法正确的是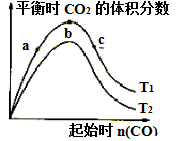
| A.T1比T2高 |
| B.b点SO2转化率最高 |
| C.b点后曲线下降是因CO体积分数升高 |
| D.减小压强可提高CO、SO2转化率 |
您最近半年使用:0次
2018-03-19更新
|
500次组卷
|
7卷引用:【全国百强校】福建省三明市第一中学2019届高三上学期第二次月考化学试题
【全国百强校】福建省三明市第一中学2019届高三上学期第二次月考化学试题河南省天一大联考2017届高三阶段性测试(三)(A)化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题2020届高考化学二轮复习提升练习《 化学反应反应速率与反应平衡》(已下线)专题讲座(五)反应速率、平衡图像题解题策略(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像四川省凉山彝族自治州2022-2023学年高二上学期期末检测化学试题
名校
5 . 反应mA(s)+nB(g) pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
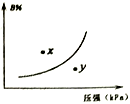
① m+n>p ②x点表示的正反应速率小于逆反应速率 ③n<p
④反应速率x点比y点时的慢 ⑤若升高温度,该反应的平衡常数减小
 pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定不正确的是
① m+n>p ②x点表示的正反应速率小于逆反应速率 ③n<p
④反应速率x点比y点时的慢 ⑤若升高温度,该反应的平衡常数减小
| A.②⑤ | B.②④ | C.①③ | D.①③⑤ |
您最近半年使用:0次
2018-02-24更新
|
314次组卷
|
7卷引用:福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题
福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题湖北省黄冈市2017-2018学年高二上学期期末考试化学试题江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】2019 南昌市三校(一中、十中、铁一中)高二上 期末(已下线)四川省叙州区第一中学2018-2019学年高二下学期开学考试化学试题湖南省新宁县崀山培英学校2020-2021学年高二上学期第二次月考化学试题江西省南昌市八一中学、洪都中学等七校2020-2021学年高二上学期期末联考化学试题
6 . 25 C时,在体积为2 L的密闭容器中,气态物质A、B、C的物质的量n随时间1的变化如图1所示,已知反应达到平衡后,降低温度,A的转化率将增大。

(1)根据图1数据。写出该反应的化学方程式:_____________ ;此反应的平衡常数表达式为K=_________ ,从反应开始到第一次平衡时的平均速率v(A)为________ 。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是_________ 。
(3)图2表示此反应的反应速率v和时间t的关系,t3、t5、t6时刻各改变一个且互不相同的条件,各阶段的平衡常数如下表所示。K1、K2、K3、K4之间的关系为________ (用“>”“<”或“=”连接)。A的转化率最大的一段时间是___________ 。
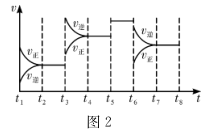

(1)根据图1数据。写出该反应的化学方程式:
(2)在5~7min内,若K值不变,则此处曲线变化的原因是
(3)图2表示此反应的反应速率v和时间t的关系,t3、t5、t6时刻各改变一个且互不相同的条件,各阶段的平衡常数如下表所示。K1、K2、K3、K4之间的关系为
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |

您最近半年使用:0次
2018-02-06更新
|
362次组卷
|
7卷引用:福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题
福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题(已下线)2010年北京市高三上学期起点考试化学试题(已下线)2014届高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(已下线)2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷湖南省长沙市长郡中学2017-2018学年度高二第一学期期末考试化学试题【全国百强校】吉林省实验中学2018-2019学年高二上学期期中考试化学试题陕西省子洲中学2019-2020学年高二下学期第一次月考化学试题
9-10高二下·广东东莞·期末
名校
7 . 在密闭容器中,对于可逆反应:A(?)+3B(?) 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
| A.若正反应方向△H<0,则T1>T2 | B.压强增大时,混合气体的平均相对分子质量减小 |
| C.A一定为气体 | D.B一定为气体 |
您最近半年使用:0次
2018-01-16更新
|
626次组卷
|
19卷引用:2011届福建省三明一中高三上学期第三次月考化学试卷
(已下线)2011届福建省三明一中高三上学期第三次月考化学试卷(已下线)2010年广东省东莞市高二第二学期期末考试化学A卷(已下线)2011-2012学年广东省中山市高二下学期期末考试化学试卷(已下线)2013-2014四川省宜昌市部分市级示范高中春季期中考试高二化学试卷(已下线)2013-2014广东汕头市金山中学第一学期期末高二化学试卷(已下线)2015届山西大学附中高三上学期期中化学试卷2015-2016学年广东省湛江市高二上学期期末质检化学试卷2015-2016学年湖北省武汉三十九中高二上学期期末化学试卷河南省濮阳市2016-2017学年高二下学期升级(期末)考试(A卷)化学试题河北省张家口市第一中学2016-2017学年高一(衔接班)下学期期末考试(理)化学试题陕西省黄陵中学高新部2016-2017学年高一下学期期末考试化学试题广东省佛山市第一中学2017-2018学年高二上学期期中考试化学试题广东省普宁市华美实验学校2017-2018学年高二上学期第二次月考化学试题吉林省吉化第一高级中学校2017-2018学年高二上学期期末考试化学试题北京市通州区2019-2020学年高二下学期期末考试化学试题(已下线)第六单元 化学反应速率和化学平衡测试题-2021年高考化学一轮复习名师精讲练【学科网名师堂】广东省台山市华侨中学2020-2021学年高二上学期第一次月考化学试题江西省吉安三中2021-2022学年高二上学期10月第一次段考化学试题天津市七校联考2022届高三第二次质量调查化学试题
解题方法
8 . 可逆反应:aA(气)+bB(气)  cC(气)+dD(气) △H=Q,试根据图回答
cC(气)+dD(气) △H=Q,试根据图回答
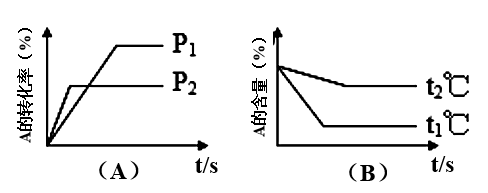
(1)压强P1比P2______ (填大、小)
(2)体积(a+b)比(c+d)____ (填大、小)
(3)温度t1℃比t2℃______ (填高、低)
(4)Q值是______ (填正、负)
 cC(气)+dD(气) △H=Q,试根据图回答
cC(气)+dD(气) △H=Q,试根据图回答
(1)压强P1比P2
(2)体积(a+b)比(c+d)
(3)温度t1℃比t2℃
(4)Q值是
您最近半年使用:0次
2018-01-01更新
|
256次组卷
|
4卷引用:福建省清流一中2017-2018学年高二上学期第二阶段(期中)考试化学(理)试题
福建省清流一中2017-2018学年高二上学期第二阶段(期中)考试化学(理)试题(已下线)2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷河北省唐山市滦县二中2017-2018学年高二期中考试化学(理)试卷甘肃省宁县第二中学2020-2021学年高二上学期期末考试化学试题
名校
9 . 反应aA (g)+bB (g) cC (g)△H=QkJ/mol,生成物C的质量分数与压强p和温度的关系如下图,方程式中的化学计量数和Q值符合图像的是
cC (g)△H=QkJ/mol,生成物C的质量分数与压强p和温度的关系如下图,方程式中的化学计量数和Q值符合图像的是
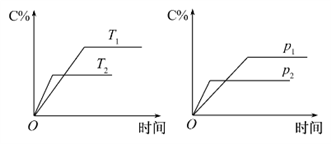
 cC (g)△H=QkJ/mol,生成物C的质量分数与压强p和温度的关系如下图,方程式中的化学计量数和Q值符合图像的是
cC (g)△H=QkJ/mol,生成物C的质量分数与压强p和温度的关系如下图,方程式中的化学计量数和Q值符合图像的是
| A.a+b< cQ> 0 | B.a+b> cQ< 0 |
| C.a+b< cQ< 0 | D.a+b= cQ> 0 |
您最近半年使用:0次
2017-12-11更新
|
151次组卷
|
5卷引用:福建省三明市三地三校2019-2020学年高二上学期期中联考化学试题
福建省三明市三地三校2019-2020学年高二上学期期中联考化学试题(已下线)2014-2015学年贵州省遵义航天高级中学高二上学期半期考试化学试卷甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题安徽省滁州市定远县育才学校2019-2020学年高二(普通班)上学期第三次月考化学试题四川省广安第二中学2020-2021学年高二上学期第一次月考化学试题
名校
10 . 如图所示,与对应的叙述相符的是


| A.图甲表示反应:4CO(g) +2NO2(g)==N2(g) +4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1<T2,b点处NO2的转化率最大 |
| B.图乙表示某条件对2A(g) +B(g)==3C(g)的影响,乙一定使用了催化剂 |
| C.图丙表示的某可逆反应是吸热反应,该图表明催化剂能同时改变正逆反应的活化能 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0 |
您最近半年使用:0次
2017-12-04更新
|
425次组卷
|
4卷引用:福建省三明市第一中学2018届高三上学期第二次月考化学试题



