名校
1 . 对于可逆反应:3A(g)+B(g) 2C(g) ΔH<0,下列各图中正确的是
2C(g) ΔH<0,下列各图中正确的是
 2C(g) ΔH<0,下列各图中正确的是
2C(g) ΔH<0,下列各图中正确的是A.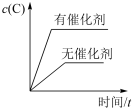 | B.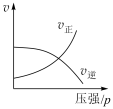 |
C.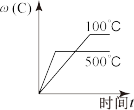 | D.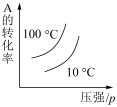 |
您最近半年使用:0次
2022-03-16更新
|
161次组卷
|
2卷引用:福建省福州第三中学2020-2021学年高二上学期期末考化学试题
名校
2 . 现有下列四个图像:
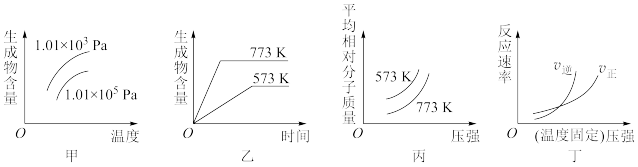
下列反应中全部符合上述图像的反应是

下列反应中全部符合上述图像的反应是
| A.N2(g)+3H2(g)⇌2NH3(g) ΔH1<0 |
| B.2SO3(g)⇌2SO2(g)+O2(g) ΔH2>0 |
| C.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH3<0 |
| D.H2(g)+CO(g)⇌C(s)+H2O(g) ΔH4>0 |
您最近半年使用:0次
2021-12-28更新
|
637次组卷
|
45卷引用:福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题
福建省建瓯市芝华中学2019-2020学年高二上学期期中考试化学(1-2班)试题(已下线)2011届山东省潍坊市诸城一中高三12月阶段测试化学试卷(已下线)2011-2012年黑龙江双鸭山一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东省威海市高二上学期期末考试化学试卷(已下线)2014-2015学年河南省汝州市高二上学期第一次月考化学试卷(已下线)2014-2015学年湖南省衡阳市第八中学高二上学期期中考试化学试卷2015-2016学年黑龙江省红兴隆第一高级中学高二上期中理科化学试卷2015-2016学年陕西省西安第七十中学高二上学期期中测试化学试卷2015-2016学年贵州省思南中学高二上二次月考化学试卷2015-2016学年安徽省宣城郎溪中学高二上学期第三次月考化学试卷2016届陕西省蒲城尧山补习学校高三上学期第四次质检化学试卷2015-2016学年辽宁师大附中高一下学期6月月考化学试卷2016-2017学年辽宁省大连市第二十中学高二上9月月考化学试卷2016-2017学年黑龙江省铁人中学高二上开学测化学卷2017届湖北省武钢三中高三上学期11月月考化学试卷2018版化学(苏教版)高考总复习专题七题型冲关--巧解平衡及速率图像题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题湖北省华中师范大学第一附属中学2018届高三上学期期中考试化学试题2018-2019学年鲁科版高中化学选修四:第2章检测题山东省德州市夏津一中2018-2019学年高二上学期第一次月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题江西省上饶市第二中学2018-2019学年高二上学期期中考试化学试题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题江苏省泰州市第二中学2017-2018学年高二上学期期中考试化学试题云南省大理市下关一中2018-2019学年高二上学期期中考试化学试题【校级联考】湖北省宜昌市协作体2018-2019学年高二上学期期末考试化学试题江西省赣州市南康中学2019-2020学年高二上学期第一次月考化学试题山东省济南外国语学校三箭分校2019-2020学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2019-2020学年高二上学期期中考试化学试题甘肃省定西市岷县第二中学2019-2020学年高二上学期期中考试化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题甘肃省兰州市第十中学、民族中学2019-2020学年高二上学期期末考试化学试题广西钦州市2019-2020学年高二下学期期末教学质量监测化学试题河南省兰考县第三高级中学卫星试验部2020-2021学年高二上学期第一次月考化学试题辽宁省联合校2020-2021学年高二上学期第一次月考化学试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市第一中学2021-2022学年高二上学期学情反馈(一)化学试题河南省洛阳市豫西名校2021-2022学年高二上学期第一次联考化学试题湖北省十堰市2016-2017学年高二上学期期末调研考试化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题江苏省盐城市大丰区新丰中学2021-2022学年高二上学期期中考试化学(选修)试题云南省丽江市第一高级中学2021-2022学年高二上学期元月考化学试题江苏省徐州市睢宁县第一中学2021-2022学年高二下学期第一次月考化学试题(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省竹溪县第二高级中学2021-2022学年高二上学期12月月考化学试题
名校
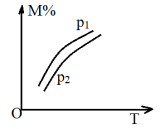
3 . 在一定条件下,对于反应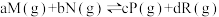
 ,M的物质的量分数(M%)与温度、压强的关系如图所示
,M的物质的量分数(M%)与温度、压强的关系如图所示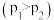 ,则下列判断正确的是
,则下列判断正确的是
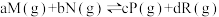
 ,M的物质的量分数(M%)与温度、压强的关系如图所示
,M的物质的量分数(M%)与温度、压强的关系如图所示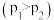 ,则下列判断正确的是
,则下列判断正确的是
A. , , | B. , , |
C. , , | D. , , |
您最近半年使用:0次
2021-12-23更新
|
274次组卷
|
4卷引用:福建省华安县第一中学2022-2023学年高二上学期第二次月考化学试题
名校
解题方法
4 . 在I、II、III三个体积相等的恒容密闭容器中分别充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。在一定条件下能发生如下反应:CO(g)+2H2(g)⇌CH3OH(g),在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,下列说法正确的是

| A.反应CO(g)+2H2(g)═CH3OH(g)的△H>0 |
| B.若三个容器内的反应都达到化学平衡时,温度为T3时CO转化率最大 |
| C.I、II、III三个容器中一定达到化学平衡状态的是II和III |
| D.若再向容器III中充入0.1molCO、0.2molH2和0.4molCH3OH,则平衡时CH3OH的体积分数>40% |
您最近半年使用:0次
2021-12-15更新
|
249次组卷
|
2卷引用:福建省厦门第一中学2021-2022学年高二上学期12月月化学试题
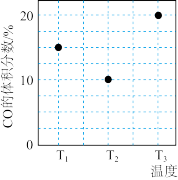
5 . 可逆反应mA(s)+nB(g)e C(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图。
C(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图。
下列叙述不正确的是
 C(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图。
C(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如下图。
下列叙述不正确的是
| A.达平衡后,若升温,平衡左移 |
| B.达平衡后加入催化剂,反应速率加快 |
| C.化学方程式中n<e+f |
| D.达平衡后,增加A的量平衡向右移动 |
您最近半年使用:0次
2021-12-03更新
|
301次组卷
|
3卷引用:福建省南平市浦城县2021-2022学年高二上学期期中考试化学试题
福建省南平市浦城县2021-2022学年高二上学期期中考试化学试题(已下线)专题24 化学平衡图像题的突破-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省西安市阎良区关山中学2021-2022学年高二上学期第三次质量检测化学(理)试题
名校
6 . 甲醇是重要的化工原料,发展前景广阔。研究表明, 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: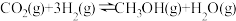
(1)反应的平衡常数表达式为K=___________ 。
(2)有利于提高平衡时 转化率的措施有
转化率的措施有___________ (填字母)。
a.使用催化剂
b.加压
c.增大 和H2的初始投料比
和H2的初始投料比
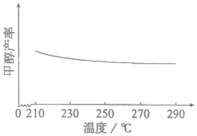
(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
___________ 0(填“>”“=”或“<”),依据是___________ 。
 加氢可以合成甲醇,反应如下:
加氢可以合成甲醇,反应如下: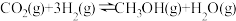
(1)反应的平衡常数表达式为K=
(2)有利于提高平衡时
 转化率的措施有
转化率的措施有a.使用催化剂
b.加压
c.增大
 和H2的初始投料比
和H2的初始投料比(3)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中
 和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的
和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的

您最近半年使用:0次
2021-12-02更新
|
788次组卷
|
4卷引用:福建省上杭县才溪中学2022-2023学年高二上学期10月月考化学试题
名校
7 . 关于下列各图的叙述,正确的是
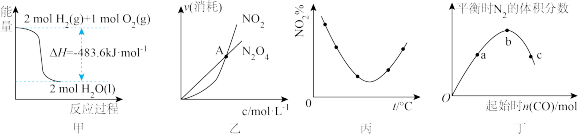
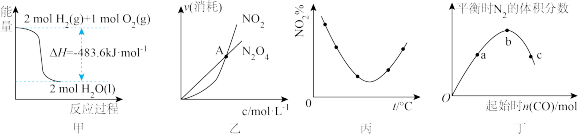
| A.甲表示H2与O2发生反应过程中的能量变化,则H2的摩尔燃烧焓为483.6 kJ·mol-1 |
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.丙表示等量NO2在恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 N2O4(g)相同时间后测得NO2体积分数的曲线。则该反应的正反应ΔH<0 |
D.丁表示反应4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c |
您最近半年使用:0次
8 . 氨是最重要的氮肥,也是产量最大的化工产品之一、合成氨工艺是人工固氮的重要途径。回答下列问题:
(1)已知气态分子中1mol化学键解离成气态原子所吸收的能量, 叫做该化学键的键能(kJ·mol-1)。一些键能数据如表:
反应N2(g)+3H2(g)⇌2NH3(g) ∆H=_______ kJ/mol
(2)化学家格哈德·埃特尔在哈伯研究所证实了部分参加反应的分子在固体催化剂表面合成氨的反应过程,模拟示意图如图:
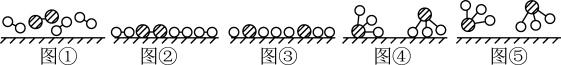
 分别表示N2、H2、NH3
分别表示N2、H2、NH3
i.图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,图②到图③的过程_______ 能量(填“吸收”或“放出”)。
ii.N2的吸附分解反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料N2和H2物质的量之比为1︰2.8,分析说明N2过量的理由是_______ 和_______ 。
iii.关于合成氨工艺,下列说法正确的是_______ 。
A.控制温度(773K)远高于室温,是为了提高平衡转化率和加快化学反应速率。
B.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于化学平衡向正反应方向移动。
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率。
D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(3)在体积相同的密闭容器中按物质的量比 1︰3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g)分别在200℃、400℃、600℃条件下进行反应,平衡时NH3的物质的量分数随总压强的变化曲线如图所示:
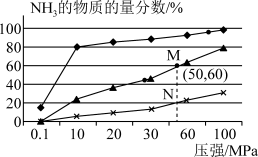
i.M点和N点的平衡常数大小关系是KM_______ KN(填“>”、“<”或者“=”)。
ii.M点的平衡常数Kp=_______ MPa-2(计算结果保留到小数点后两位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
(4)已知液氨中存在:2NH3(l)⇌NH +NH
+NH 。用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是
。用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是_______ 。
(1)已知气态分子中1mol化学键解离成气态原子所吸收的能量, 叫做该化学键的键能(kJ·mol-1)。一些键能数据如表:
| 化学键 |  |  |  |
| 键能E(kJ·mol-1) | 946.0 | 436.0 | 390.8 |
(2)化学家格哈德·埃特尔在哈伯研究所证实了部分参加反应的分子在固体催化剂表面合成氨的反应过程,模拟示意图如图:

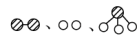 分别表示N2、H2、NH3
分别表示N2、H2、NH3i.图②表示N2、H2被吸附在催化剂表面,图⑤表示生成的NH3离开催化剂表面,图②到图③的过程
ii.N2的吸附分解反应速率慢,决定了合成氨的整体反应速率。实际生产中,原料N2和H2物质的量之比为1︰2.8,分析说明N2过量的理由是
iii.关于合成氨工艺,下列说法正确的是
A.控制温度(773K)远高于室温,是为了提高平衡转化率和加快化学反应速率。
B.基于NH3有较强的分子间作用力,可将其液化,不断将液氨移去,利于化学平衡向正反应方向移动。
C.当温度、体积一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率。
D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生。
(3)在体积相同的密闭容器中按物质的量比 1︰3 投入氮气和氢气,发生反应:N2(g)+3H2(g)⇌2NH3(g)分别在200℃、400℃、600℃条件下进行反应,平衡时NH3的物质的量分数随总压强的变化曲线如图所示:

i.M点和N点的平衡常数大小关系是KM
ii.M点的平衡常数Kp=
(4)已知液氨中存在:2NH3(l)⇌NH
 +NH
+NH 。用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是
。用Pt电极对液氨进行电解也可产生H2和N2.阴极的电极反应式是
您最近半年使用:0次
2021-11-18更新
|
559次组卷
|
5卷引用:福建省莆田锦江中学2023-2024学年高三上学期期中考试化学试题
福建省莆田锦江中学2023-2024学年高三上学期期中考试化学试题黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题
名校
9 . 在恒容密闭容器中充入一定量的CO2和H2,在不同温度下发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H <0。 CH3OH 的体积分数与起始时H2与CO2的投料比值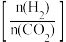 的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
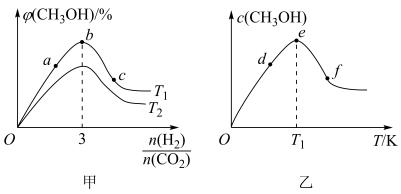
下列推断正确的是
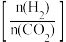 的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
的关系如图甲所示,投料比值 一定时,CH3OH的浓度与温度的关系如图乙所示。
下列推断正确的是
| A.图甲中,T1>T2 |
| B.图甲中,CO2的转化率: b>a>c |
| C.图乙中,T1之前随着温度的升高,平衡正向移动 |
| D.图乙中,CO2的转化率: e>d>f |
您最近半年使用:0次
2021-11-12更新
|
178次组卷
|
2卷引用:福建省南安市侨光中学、昌财实验中学2021-2022学年高二上学期第二次阶段考化学试题
名校
10 . 在恒容密闭容器中充入一定量的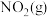 和
和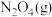 ,发生反应N2O4(g)⇌2NO2(g)
,发生反应N2O4(g)⇌2NO2(g)  ,体系中各物质的百分含量与温度的变化关系如图所示,
,体系中各物质的百分含量与温度的变化关系如图所示,

下列说法错误的是
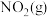 和
和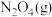 ,发生反应N2O4(g)⇌2NO2(g)
,发生反应N2O4(g)⇌2NO2(g)  ,体系中各物质的百分含量与温度的变化关系如图所示,
,体系中各物质的百分含量与温度的变化关系如图所示,
下列说法错误的是
A.曲线①表示 的百分含量 的百分含量 |
B. 的键能总和大于 的键能总和大于 的键能总和 的键能总和 |
C.若 点为反应平衡点,此时平衡常数 点为反应平衡点,此时平衡常数 |
| D.反应达到平衡后,往该容器中充入少量N2O4,N2O4转化率减小 |
您最近半年使用:0次
2021-11-03更新
|
130次组卷
|
2卷引用:福建省龙岩第一中学2021-2022学年高二上学期第一次月考化学试题



