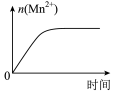
1 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.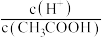 C.
C.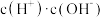 D.
D. E.
E. 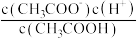
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
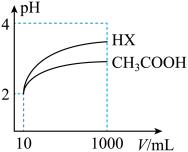
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
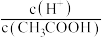 C.
C.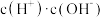 D.
D. E.
E. 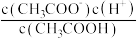
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
您最近一年使用:0次
解题方法
2 . 下列物质的水溶液呈酸性且为弱电解质的是
A. | B. | C. | D. |
您最近一年使用:0次
名校
3 . 草酸( 二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)常温下,pH=3的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,pH=4的
,pH=4的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,则
,则
______ 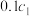 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)已知: 的电离大于
的电离大于 的水解,常温下,用
的水解,常温下,用 溶液滴定20.00mL某未知浓度
溶液滴定20.00mL某未知浓度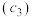 的
的 溶液,滴定曲线如图,c点所示溶液中:
溶液,滴定曲线如图,c点所示溶液中: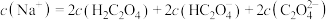 ,a点所示溶液中各离子的浓度由小到大的顺序为
,a点所示溶液中各离子的浓度由小到大的顺序为______ 。 酸性溶液滴定未知浓度
酸性溶液滴定未知浓度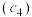 的无色
的无色 溶液,
溶液,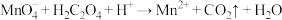 (未配平),滴定终点的判断方法是
(未配平),滴定终点的判断方法是______ 。
(4)乙学生按照滴定步骤进行了4次实验,分别记录有关数据如表:
依据上表数据计算法 溶液的物质的量浓度为
溶液的物质的量浓度为______ mol/L(保留4位有效数字)。
(5)下列操作中可能使测定结果偏高的是______(填字母)。
 二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。(1)常温下,pH=3的
 溶液的物质的量浓度为
溶液的物质的量浓度为 ,pH=4的
,pH=4的 溶液的物质的量浓度为
溶液的物质的量浓度为 ,则
,则
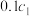 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)已知:
 的电离大于
的电离大于 的水解,常温下,用
的水解,常温下,用 溶液滴定20.00mL某未知浓度
溶液滴定20.00mL某未知浓度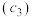 的
的 溶液,滴定曲线如图,c点所示溶液中:
溶液,滴定曲线如图,c点所示溶液中: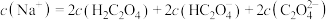 ,a点所示溶液中各离子的浓度由小到大的顺序为
,a点所示溶液中各离子的浓度由小到大的顺序为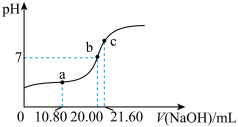
 酸性溶液滴定未知浓度
酸性溶液滴定未知浓度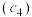 的无色
的无色 溶液,
溶液,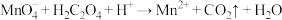 (未配平),滴定终点的判断方法是
(未配平),滴定终点的判断方法是(4)乙学生按照滴定步骤进行了4次实验,分别记录有关数据如表:
滴定次数 | 待测 |
| ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 25.31 | 25.31 |
第二次 | 25.00 | 1.52 | 28.40 | 26.88 |
第三次 | 25.00 | 0.22 | 25.51 | 25.29 |
第四次 | 25.00 | 0.89 | 26.19 | 25.30 |
 溶液的物质的量浓度为
溶液的物质的量浓度为(5)下列操作中可能使测定结果偏高的是______(填字母)。
A.酸式滴定管未用标准液润洗就直接注入 标准液 标准液 |
| B.测定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管尖嘴部分在滴定前有气泡,滴定后没有气泡 |
D.读取 标准液时,开始仰视读数,滴定结束时俯视读数 标准液时,开始仰视读数,滴定结束时俯视读数 |
您最近一年使用:0次
名校
4 . 食醋是厨房常用的调味品,25℃时, 的
的 ,醋酸溶液加水稀释后,下列说法正确的是
,醋酸溶液加水稀释后,下列说法正确的是
 的
的 ,醋酸溶液加水稀释后,下列说法正确的是
,醋酸溶液加水稀释后,下列说法正确的是A. 数目增多 数目增多 |
B. 增大 增大 |
C. 的电离程度减小 的电离程度减小 |
D. 减小 减小 |
您最近一年使用:0次
5 . 已知  时
时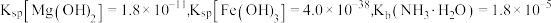 ,下列叙述中不正确的是
,下列叙述中不正确的是
 时
时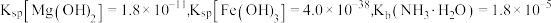 ,下列叙述中不正确的是
,下列叙述中不正确的是A. 时,向等浓度的 时,向等浓度的 和 和 混合溶液中逐滴加入氨水,先出现红褐色沉淀 混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
B. 时, 时, 溶液中有少量 溶液中有少量 时,可以加入 时,可以加入 进行除杂 进行除杂 |
C. 时, 时,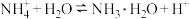 的平衡常数为 的平衡常数为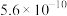 |
D. 时,加大量水稀释氨水,溶液中粒子的浓度均减小 时,加大量水稀释氨水,溶液中粒子的浓度均减小 |
您最近一年使用:0次
名校
6 .  是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。
I二氧化硫在 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。
(1)二氧化硫在 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
①
②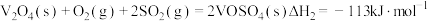
③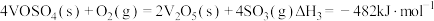
则
_______ 。
(2)硫酸生产中, 催化氧化生成
催化氧化生成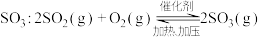 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: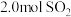 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为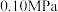 。该反应的平衡常数等于
。该反应的平衡常数等于_______ 。
②平衡状态由A变到B时,平衡常数
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率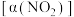 。部分实验结果如图所示:
。部分实验结果如图所示:_______ 。
(4)若A点对应实验中,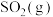 的起始浓度为
的起始浓度为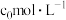 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率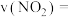
_______  。
。
(5)图中C、D两点对应的实验温度分别为 和
和 ,通过计算判断:
,通过计算判断:
_______  (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。
Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除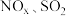 ,同时又变废为宝。
,同时又变废为宝。
(6)写出 转化的电极反应方程式:
转化的电极反应方程式: _______ 。
 。
。 的稀硫酸中,
的稀硫酸中,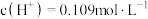 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:_______ (结果保留三位有效数字)。
 是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。I二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。(1)二氧化硫在
 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:①

②
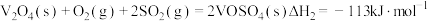
③
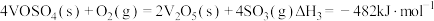
则

(2)硫酸生产中,
 催化氧化生成
催化氧化生成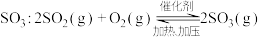 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
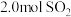 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为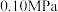 。该反应的平衡常数等于
。该反应的平衡常数等于②平衡状态由A变到B时,平衡常数

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率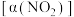 。部分实验结果如图所示:
。部分实验结果如图所示: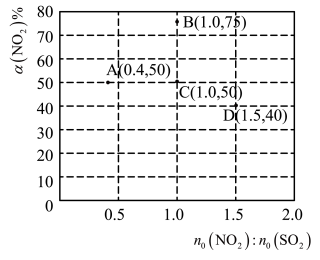
(4)若A点对应实验中,
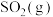 的起始浓度为
的起始浓度为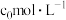 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率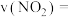
 。
。(5)图中C、D两点对应的实验温度分别为
 和
和 ,通过计算判断:
,通过计算判断:
 (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除
 ,同时又变废为宝。
,同时又变废为宝。(6)写出
 转化的电极反应方程式:
转化的电极反应方程式: 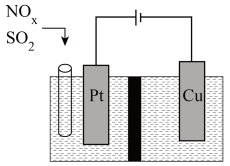

 。
。 的稀硫酸中,
的稀硫酸中,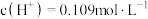 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:
您最近一年使用:0次
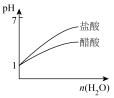
7 . 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是___________ (用字母表示,下同)。
(2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是___________ 。
(3)若三者pH相同时,物质的量浓度由大到小的顺序是___________ 。
(4)将pH相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为___________ 。
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是___________ 。
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
(2)同体积、同物质的量浓度的三种酸,中和NaOH 的能力由大到小的顺序是
(3)若三者pH相同时,物质的量浓度由大到小的顺序是
(4)将pH相同且体积也相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积大小关系为
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是
您最近一年使用:0次
8 . 自然界中含 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、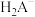 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:__________ (写出其中一个离子方程式即可);加热能降低这种硬水中的 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
(2)表示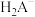 变化曲线的是
变化曲线的是_______ (填字母标号); 为
为_______ 。
(3)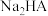 溶液显
溶液显____ (填“酸性”、“中性”或“碱性”),溶液中的电荷守恒关系式为________ 。
(4)向硬水中加入NaF固体可除去溶液中的 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为________  。[已知
。[已知 ,
,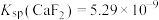 ]
]
 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、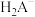 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:
 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为(2)表示
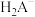 变化曲线的是
变化曲线的是 为
为(3)
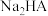 溶液显
溶液显(4)向硬水中加入NaF固体可除去溶液中的
 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为 。[已知
。[已知 ,
,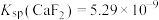 ]
]
您最近一年使用:0次
9 . 完成下列问题。
(1) 水溶液呈酸性的原因是(用离子方程式表示):
水溶液呈酸性的原因是(用离子方程式表示):________ 。
(2)室温时, 的
的 溶液中由水电离出的
溶液中由水电离出的
______  。
。
(3)室温时, 的Ba(OH)2溶液,
的Ba(OH)2溶液,
________ 。
(4)室温下pH=3的 水溶液水电离的c(H+)
水溶液水电离的c(H+)______  。
。
(5)常温下pH=13的 溶液与pH=11
溶液与pH=11 溶液等体积混合,混合溶液pH=
溶液等体积混合,混合溶液pH=______ 。
(6)常温下0.1 的NH3·H2O,pH=11,则Kb=
的NH3·H2O,pH=11,则Kb=_______ ,常温下0.1 的CH3COOH溶液pH=3 ,则Ka=
的CH3COOH溶液pH=3 ,则Ka=_______ 。
(1)
 水溶液呈酸性的原因是(用离子方程式表示):
水溶液呈酸性的原因是(用离子方程式表示):(2)室温时,
 的
的 溶液中由水电离出的
溶液中由水电离出的
 。
。(3)室温时,
 的Ba(OH)2溶液,
的Ba(OH)2溶液,
(4)室温下pH=3的
 水溶液水电离的c(H+)
水溶液水电离的c(H+) 。
。(5)常温下pH=13的
 溶液与pH=11
溶液与pH=11 溶液等体积混合,混合溶液pH=
溶液等体积混合,混合溶液pH=(6)常温下0.1
 的NH3·H2O,pH=11,则Kb=
的NH3·H2O,pH=11,则Kb= 的CH3COOH溶液pH=3 ,则Ka=
的CH3COOH溶液pH=3 ,则Ka=
您最近一年使用:0次
10 . 化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述错误的是
|
|
|
|
 |  |  |  |
A.图 可表示 可表示 酸性溶液与过量的 酸性溶液与过量的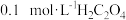 溶液混合时, 溶液混合时, 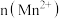 随时间的变化 随时间的变化 |
B.图 可表示体积相等、 可表示体积相等、 的醋酸溶液与盐酸加入等量水稀释时的 的醋酸溶液与盐酸加入等量水稀释时的 变化 变化 |
C.图 可表示温度对可逆反应 可表示温度对可逆反应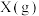  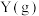 , , 的影响 的影响 |
D.图 可表示压强对可逆反应 可表示压强对可逆反应  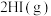 的影响 的影响 |
您最近一年使用:0次