名校
解题方法
1 . I.根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈___________ (填“酸”、“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为___________ 。
(3)常温下,Na2SO3溶液中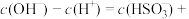
___________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。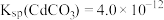 ,
,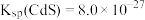 ;回答下列问题:
;回答下列问题:
(4)向某含镉废水中加入Na2S,当 浓度达到
浓度达到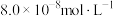 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为___________  ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?____________ (填“是”或“否”)
(5)室温下,反应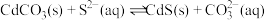 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=___________ (结果保留两位有效数字)
| 物质 | CH3COOH | NH3•H2O | HCN | HClO | H2CO3 | H2SO3 |
| 电离常数(Ka) |  |  |  |  | 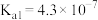 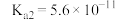 | 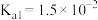  |
(2)常温下,向NaClO溶液中通入少量CO2,发生反应的离子方程式为
(3)常温下,Na2SO3溶液中
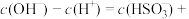
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005
 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。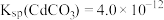 ,
,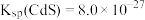 ;回答下列问题:
;回答下列问题:(4)向某含镉废水中加入Na2S,当
 浓度达到
浓度达到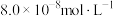 时,废水中Cd2+的浓度为
时,废水中Cd2+的浓度为 ,此时是否符合生活饮用水卫生标准?
,此时是否符合生活饮用水卫生标准?(5)室温下,反应
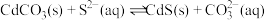 达到平衡,该反应的平衡常数K=
达到平衡,该反应的平衡常数K=
您最近一年使用:0次
名校
2 . 自然界碳的循环与 、碳酸及碳酸盐有着密切的联系。
、碳酸及碳酸盐有着密切的联系。
(1) 的空间构型为
的空间构型为___________ , 分子中σ键与π键的个数比为
分子中σ键与π键的个数比为___________ 。
(2)常温常压下,空气中 溶于水达到平衡时
溶于水达到平衡时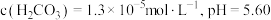 。若忽略水的电离及
。若忽略水的电离及 的第二级电离,则碳酸的一级电离常数
的第二级电离,则碳酸的一级电离常数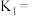
___________ (已知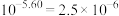 ,结果保留1位小数)。
,结果保留1位小数)。
(3)已知 的二级电离常数
的二级电离常数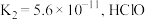 的电离常数
的电离常数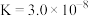 。将少量
。将少量 通入过量的
通入过量的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为___________ 。
(4)在常温下向 水溶液中滴加
水溶液中滴加 溶液,所得溶液的
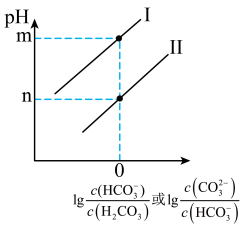
溶液,所得溶液的 与粒子浓度的变化关系如图。则下图中
与粒子浓度的变化关系如图。则下图中___________ 线(填“I”或“Ⅱ”)表示 ,碳酸的两级电离常数
,碳酸的两级电离常数 与
与 的关系为
的关系为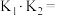
___________ (用含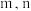 的式子表示)。
的式子表示)。
 、碳酸及碳酸盐有着密切的联系。
、碳酸及碳酸盐有着密切的联系。(1)
 的空间构型为
的空间构型为 分子中σ键与π键的个数比为
分子中σ键与π键的个数比为(2)常温常压下,空气中
 溶于水达到平衡时
溶于水达到平衡时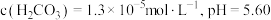 。若忽略水的电离及
。若忽略水的电离及 的第二级电离,则碳酸的一级电离常数
的第二级电离,则碳酸的一级电离常数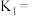
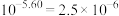 ,结果保留1位小数)。
,结果保留1位小数)。(3)已知
 的二级电离常数
的二级电离常数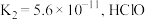 的电离常数
的电离常数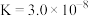 。将少量
。将少量 通入过量的
通入过量的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为(4)在常温下向
 水溶液中滴加
水溶液中滴加 溶液,所得溶液的
溶液,所得溶液的 与粒子浓度的变化关系如图。则下图中
与粒子浓度的变化关系如图。则下图中 ,碳酸的两级电离常数
,碳酸的两级电离常数 与
与 的关系为
的关系为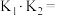
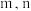 的式子表示)。
的式子表示)。
您最近一年使用:0次
2024-03-16更新
|
159次组卷
|
2卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期末考试化学试题
3 . 研究化学反应意义重大,请就下列现象和实质回答问题。
(1) 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式______ 。
(2)次磷酸( )是一种弱酸,
)是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有 、
、 两种。写出
两种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为_______ 。
(3)已知 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的两种电离方程式
在水中的两种电离方程式_______ 、_______ 。
(4)一定温度下,用水吸收 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡_______ 移动(填“向左”“向右”或“不”);若得到 的
的 溶液,试计算溶液中
溶液,试计算溶液中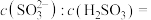
_______ (已知该温度下, 的电离常数:
的电离常数: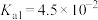 ,
, )。
)。
(5)某温度下, 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为_______ 。
(6) 时,若向
时,若向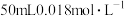 的
的 溶液中加入
溶液中加入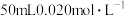 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的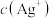 为
为______  (
( 时,
时, )。
)。
(1)
 可用作白色颜料和阻燃剂等。在实验室中可利用
可用作白色颜料和阻燃剂等。在实验室中可利用 的水解反应制取
的水解反应制取 (
( 的水解分三步进行,中间产物有
的水解分三步进行,中间产物有 等),写出
等),写出 水解生成
水解生成 的水解反应方程式
的水解反应方程式(2)次磷酸(
 )是一种弱酸,
)是一种弱酸, 溶液和足量
溶液和足量 溶液混合,所得溶液中阴离子只有
溶液混合,所得溶液中阴离子只有 、
、 两种。写出
两种。写出 溶液与
溶液与 溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为
溶液恰好完全中和的溶液中各离子浓度由大到小的顺序为(3)已知
 与
与 溶液反应生成
溶液反应生成 ,与稀硫酸反应生成
,与稀硫酸反应生成 ,写出
,写出 在水中的两种电离方程式
在水中的两种电离方程式(4)一定温度下,用水吸收
 气体时,溶液中水的电离平衡
气体时,溶液中水的电离平衡 的
的 溶液,试计算溶液中
溶液,试计算溶液中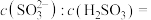
 的电离常数:
的电离常数: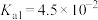 ,
, )。
)。(5)某温度下,
 的盐酸中
的盐酸中 ;该温度下
;该温度下 的
的 溶液与
溶液与 的
的 溶液混合后溶液的
溶液混合后溶液的 ,则
,则 与
与 溶液的体积比为
溶液的体积比为(6)
 时,若向
时,若向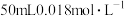 的
的 溶液中加入
溶液中加入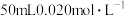 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的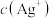 为
为 (
( 时,
时, )。
)。
您最近一年使用:0次
名校
4 . 常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液 ④0.1 mol·L-1 NaHCO3溶液
(1)溶液①中离子的电荷守恒关系式是___________ 。
(2)下列有关①和②两种溶液的说法正确的是___________ (填字母)。
a.两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)___________ (填“>”“<”或“=”,下同)c( ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3)___________ c( ),某同学将
),某同学将 溶液和
溶液和 溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:
溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:___________ 。
(4)某温度时, ,
, ,
, 。某溶液含有
。某溶液含有 、
、 和
和 ,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为___________ (用阴离子符号表示)。
(1)溶液①中离子的电荷守恒关系式是
(2)下列有关①和②两种溶液的说法正确的是
a.两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)
 ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3) ),某同学将
),某同学将 溶液和
溶液和 溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:
溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:(4)某温度时,
 ,
, ,
, 。某溶液含有
。某溶液含有 、
、 和
和 ,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为
您最近一年使用:0次
5 . 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液、②NaClO溶液、③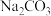 溶液,其pH由大到小的顺序是
溶液,其pH由大到小的顺序是_______ (填标号)。
(2)NaClO溶液显碱性的原因是_______ (用离子方程式表示)。
(3)常温下,将0.1 的氨水和0.1
的氨水和0.1  的
的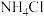 溶液等体积混合,所得混合溶液显
溶液等体积混合,所得混合溶液显_______ (填“酸性”“碱性”或“中性”)。
(4)25℃时,将a 的氨水与0.01
的氨水与0.01  的盐酸等体积混合,反应后所得溶液中
的盐酸等体积混合,反应后所得溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离平衡常数
的电离平衡常数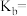
_______ 。
| 化学式 | HF | HClO |  |  |
| 电离常数 | 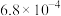 | 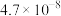 | 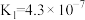 、 、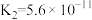 | 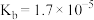 |
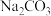 溶液,其pH由大到小的顺序是
溶液,其pH由大到小的顺序是(2)NaClO溶液显碱性的原因是
(3)常温下,将0.1
 的氨水和0.1
的氨水和0.1  的
的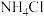 溶液等体积混合,所得混合溶液显
溶液等体积混合,所得混合溶液显(4)25℃时,将a
 的氨水与0.01
的氨水与0.01  的盐酸等体积混合,反应后所得溶液中
的盐酸等体积混合,反应后所得溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离平衡常数
的电离平衡常数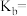
您最近一年使用:0次
6 . 25 ℃时,三种酸的电离平衡常数如表所示。
回答下列问题:
(1)浓度均为0.1 mol·L-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是_______ 。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为_______ 。Na2HPO3是_______ (填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是_______ (填字母)。
A.c(H+) B.
C.c(CH3COO-) D.c(CH3COOH)
| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平 衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1 mol·L-1的CH3COOH 、HClO 、H3PO3溶液中,c(H+)最小的是
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的第二级电离方程式为
(3)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是
A.c(H+) B.

C.c(CH3COO-) D.c(CH3COOH)
您最近一年使用:0次
名校
解题方法
7 . 现有五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
(1)将1L pH=3的HCl溶液分别与0.001mol·L-1 V1L NH3·H2O溶液、0.001mol·L-1 V2L NaOH溶液充分反应至中性,则V1、V2大小关系为V1_______ V2(填“>”“<”或“=”下同);pH相同的HCl溶液和CH3COOH溶液,加水稀释同等倍数后pH大小关系为:HCl_______ CH3COOH。
(2)浓度均为0.1mol·L-1NH4HSO4与NaOH溶液等体积混合,溶液呈酸性的原因:_______ (用离子方程式表示)
(3)用水稀释0.1 mol·L-1NH3·H2O时,溶液中随着水量的增加而减小的是_______ (填写序号)。
①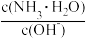 ②
② ③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积
③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积
(4)室温下,将pH=1的HCl溶液aL与pH=12的 NaOH溶液bL混合,所得混合液的pH=3,设混合溶液体积变化忽略不计,则a:b=_______ 。
(5)0.1 mol·L-1 NH4HSO4溶液中各种离子浓度由大到小的顺序是:_______ 。
(1)将1L pH=3的HCl溶液分别与0.001mol·L-1 V1L NH3·H2O溶液、0.001mol·L-1 V2L NaOH溶液充分反应至中性,则V1、V2大小关系为V1
(2)浓度均为0.1mol·L-1NH4HSO4与NaOH溶液等体积混合,溶液呈酸性的原因:
(3)用水稀释0.1 mol·L-1NH3·H2O时,溶液中随着水量的增加而减小的是
①
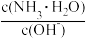 ②
② ③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积
③c(H+) ④ n(OH-) ⑤ c(H+)和c(OH-)的乘积 (4)室温下,将pH=1的HCl溶液aL与pH=12的 NaOH溶液bL混合,所得混合液的pH=3,设混合溶液体积变化忽略不计,则a:b=
(5)0.1 mol·L-1 NH4HSO4溶液中各种离子浓度由大到小的顺序是:
您最近一年使用:0次
名校
解题方法
8 . 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸K=1.75×10-5
碳酸K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸K1=1.54×10-2 K2=1.02×10-7
(1)在相同条件下,试比较H2CO3、 和
和 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:_______ 。
(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是_______ 。(填序号)
A.c(CH3COO-) B.c(H+) C.醋酸的电离平衡常数 D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol/L。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
你认为往废水中投入_______ 沉淀效果最好(填字母)
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表。
则表中X_______ 0.05 (填“大于”“等于”、“小于”); 实验①所得溶液中c(A-)+c(HA)=_______
醋酸K=1.75×10-5
碳酸K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸K1=1.54×10-2 K2=1.02×10-7
(1)在相同条件下,试比较H2CO3、
 和
和 的酸性由强到弱的顺序:
的酸性由强到弱的顺序:(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是
A.c(CH3COO-) B.c(H+) C.醋酸的电离平衡常数 D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol/L。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-16 | 3.4×10-23 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表。
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
您最近一年使用:0次
9 . 回答下列问题:
(1)已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11 CH3COOH:Ka=1.8×10-5 NH3·H2O:Kb=1.8×10-5
①常温下,0.1mol·L-1Na2S溶液和0.1mol·L-1Na2CO3溶液,碱性更强的是______ ,其原因是_______ 。
②25℃时,CH3COONH4溶液显______ 性。NaHCO3溶液的pH______ (填“大于”或“小于”)CH3COONa溶液的pH。
③NH4HCO3溶液显______ 性,原因是_______ 。
(2)25 ℃时,H2SO3⇌HSO +H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=___ ;若向NaHSO3溶液中加入少量的I2,则溶液中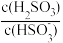 将
将______ (填“增大”“减小”或“不变”)。
(3)能证明Na2SO3溶液中存在SO +H2O⇌HSO
+H2O⇌HSO +OH-水解平衡的事实是
+OH-水解平衡的事实是_____ (填字母,下同)。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)已知:Ka(HClO2)=1.1×10-2,Ka(CH3COOH)=1.8×10-5。25℃时,浓度均为0.1mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO )
)______ (填“>”“<”或“=”)c(CH3COO-)。若要使两溶液的pH相等应________ 。
a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
(5)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_______ (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是________ 。
(1)已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-15 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11 CH3COOH:Ka=1.8×10-5 NH3·H2O:Kb=1.8×10-5
①常温下,0.1mol·L-1Na2S溶液和0.1mol·L-1Na2CO3溶液,碱性更强的是
②25℃时,CH3COONH4溶液显
③NH4HCO3溶液显
(2)25 ℃时,H2SO3⇌HSO
 +H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=
+H+的电离常数Ka=1.0×10-2,则该温度下NaHSO3的水解常数Kh=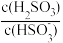 将
将(3)能证明Na2SO3溶液中存在SO
 +H2O⇌HSO
+H2O⇌HSO +OH-水解平衡的事实是
+OH-水解平衡的事实是A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(4)已知:Ka(HClO2)=1.1×10-2,Ka(CH3COOH)=1.8×10-5。25℃时,浓度均为0.1mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO
 )
)a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
(5)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是
您最近一年使用:0次
2020-12-09更新
|
408次组卷
|
2卷引用:安徽省肥东县高级中学2020-2021学年高二上学期期中考试化学试题
10 . 碳酸及碳酸盐与自然界碳的循环有着密切的联系。
(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO + H+的平衡常数K1=
+ H+的平衡常数K1=____ 。(已知10-5.60=2.5×10-6)
(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:____ 。
b.少量CO2通入过量的NaClO溶液中:____ 。
(3)人体血液里主要通过碳酸氢盐缓冲体系( )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈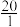 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_____ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将____ (填“变大、变小、不变”)。
(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为____ 之间

(1)已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO
 + H+的平衡常数K1=
+ H+的平衡常数K1=(2)已知H2CO3的第二级电离常数Ka2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:
b.少量CO2通入过量的NaClO溶液中:
(3)人体血液里主要通过碳酸氢盐缓冲体系(
 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈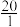 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为
,1g2=0.3。由题给数据可算得正常人体血液的pH约为 的值将
的值将(4)NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO
 、CO
、CO 三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为
您最近一年使用:0次
2020-11-26更新
|
762次组卷
|
6卷引用:安徽省蚌埠市第二中学2020-2021学年高二上学期12月月考化学试题



