1 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
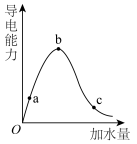
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A.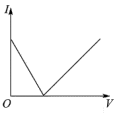 | B.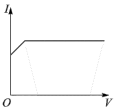 | C.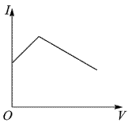 | D.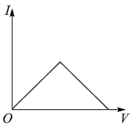 |
您最近一年使用:0次
名校
2 . 按要求完成下列内容:
(1)书写下列物质的电离方程式:
①磷酸___________ ;②氢氧化铁___________ ;③碳酸氢钠___________ ;
④明矾___________ ;⑤氢氟酸___________ ;⑥硫酸氢铵___________ 。
(2)书写下列离子方程式
①泡沫灭火器工作原理___________ 。
②碳酸氢钠溶液与过量澄清石灰水反应___________ 。
③酸性高锰酸钾溶液中通入二氧化硫气体___________ 。
(3)书写下列电化学方程式或电极反应式:
①电解法制备金属铝的总反应___________ 。
②电解精炼铜的阴极反应式___________ 。
③氯碱工业总反应___________ 。
④碱性(KOH)氢氧燃料电池的负极反应式___________ 。
(1)书写下列物质的电离方程式:
①磷酸
④明矾
(2)书写下列离子方程式
①泡沫灭火器工作原理
②碳酸氢钠溶液与过量澄清石灰水反应
③酸性高锰酸钾溶液中通入二氧化硫气体
(3)书写下列电化学方程式或电极反应式:
①电解法制备金属铝的总反应
②电解精炼铜的阴极反应式
③氯碱工业总反应
④碱性(KOH)氢氧燃料电池的负极反应式
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)25℃时,若向50mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,混合后溶液中的c(Ag+)为_______ mol·L-1,pH为_______ 。(已知25 ℃时,Ksp(AgCl)=1.8×10-10)
(2)有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
①常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类_______ (填“相同”或是“不相同”);
②碳酸钠溶液中存在的物料守恒关系式为_______
③写出泡沫灭火器的工作原理_______ (用离子方程式表示)
(1)25℃时,若向50mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,混合后溶液中的c(Ag+)为
(2)有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
①常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类
②碳酸钠溶液中存在的物料守恒关系式为
③写出泡沫灭火器的工作原理
您最近一年使用:0次
4 . 现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于弱电解质的是_______ (填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______ 。
(7)常温下,有 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
a.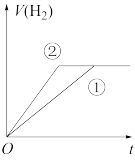 b.
b. 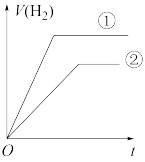 c.
c. 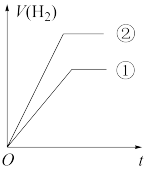 d.
d. 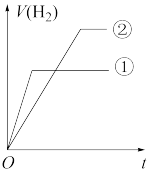
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于弱电解质的是
(4)属于非电解质,但溶于水后的水溶液能导电的是
(5)可以证明④是弱酸的事实是_______(填序号)
| A.乙酸和水能以任意比例混溶 |
| B.在乙酸水溶液中含有未电离的乙酸分子 |
| C.乙酸与Na2CO3溶液反应放出CO2气体 |
| D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色 |
(7)常温下,有
 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b.  c.
c.  d.
d. 
您最近一年使用:0次
2022-12-06更新
|
532次组卷
|
7卷引用:宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题
宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)1.2.1 电解质及其电离(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省武汉市武钢三中2022-2023学年高二上学期第一次月考化学试题广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题
5 . 回答下列问题:
(1)常温下,向20 mL 0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。
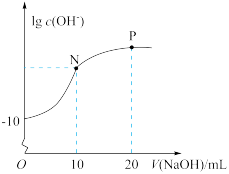
HA是__________ (“强酸”或“弱酸”)。N点溶液中2c(H+)-2c(OH-)=____________ (用含A微粒的符号表示)
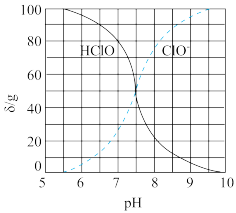
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ(X)= ,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为__________ 。常温下向0.1 mol·L-1的HClO溶液中加入等体积的0.1mol·L-1的NaOH溶液后,c(ClO-)+c(HClO)=__________ mol·L-1。
(3)PH相同、等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是____ (填序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
(4)已知草酸为二元弱酸:H2C2O4 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
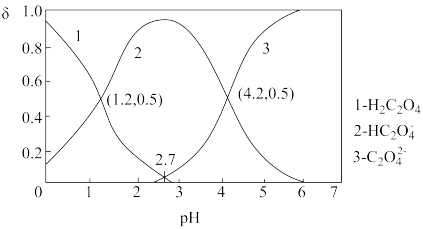
①则常温下0.1 mol/L的NaHC2O4溶液显_________ 填酸性、碱性或中性)
②pH=2.7时,溶液中 =
=______ 。
(1)常温下,向20 mL 0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。

HA是
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ(X)=
 ,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
(3)PH相同、等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
(4)已知草酸为二元弱酸:H2C2O4
 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
①则常温下0.1 mol/L的NaHC2O4溶液显
②pH=2.7时,溶液中
 =
=
您最近一年使用:0次
2022-11-21更新
|
327次组卷
|
3卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题
名校
6 . 按要求书写下列方程式
(1)水溶液中的电离方程式。
①硫酸氢钠_______ 。
②一水合氨_______ 。
③碳酸_______ 。
(2)离子方程式
①硫化亚铁固体转化为硫化铜固体_______ 。
②泡沫灭火器原理_______ 。
③氯化铁溶液显酸性的原因_______ 。
④硫化钠溶液显碱性的原因_______ 。
⑤澄清石灰水与过量的碳酸氢钠溶液混合_______ 。
⑥过量的硫酸氢钠和氢氧化钡溶液混合后显中性_______ 。
⑦醋酸和氨水_______ 。
⑧碳酸氢钠溶液和氢氧化钠溶液混合_______ 。
(3)化学方程式。
①SO2通入BaCl2溶液中,无明显现象,若同时通入氨气,则产生白色沉淀,写出该过程中的化学方程式_______ 。
②SO2通入BaCl2溶液中,无明显现象,若同时通入氯气,则产生白色沉淀,写出该过程中的化学方程式_______ 。
③已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示。反应液经冷却过程中只析出一种晶体,写出冷却过程中的化学方程式_______ 。

(1)水溶液中的电离方程式。
①硫酸氢钠
②一水合氨
③碳酸
(2)离子方程式
①硫化亚铁固体转化为硫化铜固体
②泡沫灭火器原理
③氯化铁溶液显酸性的原因
④硫化钠溶液显碱性的原因
⑤澄清石灰水与过量的碳酸氢钠溶液混合
⑥过量的硫酸氢钠和氢氧化钡溶液混合后显中性
⑦醋酸和氨水
⑧碳酸氢钠溶液和氢氧化钠溶液混合
(3)化学方程式。
①SO2通入BaCl2溶液中,无明显现象,若同时通入氨气,则产生白色沉淀,写出该过程中的化学方程式
②SO2通入BaCl2溶液中,无明显现象,若同时通入氯气,则产生白色沉淀,写出该过程中的化学方程式
③已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示。反应液经冷却过程中只析出一种晶体,写出冷却过程中的化学方程式

您最近一年使用:0次
名校
解题方法
7 . 溶液中的化学反应大多是离子反应。请回答下列问题:
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH_______ a+2(填“>”或“<”)
(2)0.01mol·Lˉ1CH3COOH溶液的pH_______ 2(填“>”或“<”);
(3)0.1mol·Lˉ1CH3COONa溶液的pH_______ 7(填“>”或“<”);
(4)FeCl3溶液呈_______ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______ ;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_______ (填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(5)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)_______ c(CH3COO-)(填“>”“<”或“=”)。
(6)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:_______ (用离子方程式表示);
(1)pH=a的CH3COOH溶液稀释100倍后所得溶液pH
(2)0.01mol·Lˉ1CH3COOH溶液的pH
(3)0.1mol·Lˉ1CH3COONa溶液的pH
(4)FeCl3溶液呈
(5)若将pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
(6)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:
您最近一年使用:0次
8 . 某酸HX是一种弱酸,25 ℃时电离常数K=4×10-8。
(1)写出该酸的电离常数表达式:K=_______ 。
(2)25℃时,往HX溶液中加入1 mol·L-1的盐酸,能_______ (填“抑制”或“促进”)HX的电离,K值将_______ (填“增大”“减小”或“不变”)。
(3)若HX的起始浓度为0.010 mol·L-1,则平衡时c(H+)=_______ [提示:因K很小,平衡时的c(HX)可近似视为仍等于0.010 mol·L-1]。
(1)写出该酸的电离常数表达式:K=
(2)25℃时,往HX溶液中加入1 mol·L-1的盐酸,能
(3)若HX的起始浓度为0.010 mol·L-1,则平衡时c(H+)=
您最近一年使用:0次
名校
9 . 25°C向20mL0.1mol/L CH3COOH溶液中滴入0.1mol/LNaOH溶液过程中,pH变化如图所示。

(1)A点溶液pH_______ 1(填“ ”、“
”、“  ”或“
”或“ ”),用化学用语解释原因:
”),用化学用语解释原因:_______
(2)B点溶液的溶质为_______ ,其中c(Na+)、c(CH3COOH)、c(CH3COO-)满足的等式关系为_______ ,这三种微粒浓度由大到小的顺序为_______
(3)A、C两点水的电离程度:A_______ C(填“ ”、“
”、“  ”或“
”或“ ”)。
”)。
(4)D点溶液中离子浓度由大到小的顺序为:_______

(1)A点溶液pH
 ”、“
”、“  ”或“
”或“ ”),用化学用语解释原因:
”),用化学用语解释原因:(2)B点溶液的溶质为
(3)A、C两点水的电离程度:A
 ”、“
”、“  ”或“
”或“ ”)。
”)。(4)D点溶液中离子浓度由大到小的顺序为:
您最近一年使用:0次
10 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)_______ c(HCO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是_______ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是_______ 。
④室温下,一定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是_______ (用离子方程式表示),溶液中
_______ 。
(2)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中 =
=_______ (保留三位有效数字)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1. 77×10-4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。②常温下,pH相同的三种溶液a.HCOONa b.NaCN c.Na2CO3,其物质的量浓度由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,一定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是

(2)已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
 =
=
您最近一年使用:0次
2022-03-22更新
|
308次组卷
|
2卷引用:宁夏银川一中2021-2022学年高二上学期期末考试化学试题



