名校
解题方法
1 . 已知常温下:部分弱酸的电离平衡常数HCOOH Ka=1.77×10-4 ;HCN Ka=5.0×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11 ;H2C2O4 Ka1=5.60×10-2,Ka2=5.42×10-5
(1)同浓度HCOONa、NaCN溶液中碱性最强是___________ ;
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
(3)NaHC2O4溶液呈___________ 性(酸/碱);Na2C2O4溶液中物料守恒等式___________ ;
(4)常温下pH=3的H2C2O4溶液与pH=11的NaOH溶液等体积混合,所得溶液呈___________ 性(酸/碱)
(5)等浓度、等体积的HCOOH与HCOONa溶液混合后pH<7,则溶液中离子浓度从大到小排序为___________ :
(1)同浓度HCOONa、NaCN溶液中碱性最强是
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
(3)NaHC2O4溶液呈
(4)常温下pH=3的H2C2O4溶液与pH=11的NaOH溶液等体积混合,所得溶液呈
(5)等浓度、等体积的HCOOH与HCOONa溶液混合后pH<7,则溶液中离子浓度从大到小排序为
您最近一年使用:0次
名校
解题方法
2 . 完成下列离子方程式或化学方程式
(1)过量的硫化钠溶液与少量的三氯化铁溶液反应的离子方程式:_______
(2)次氯酸钠与少量的二氧化碳反应的离子方程式:_______
(3)苯甲醛与新制的氢氧化铜溶液反应的化学方程式:_______
(4)向硫酸氢钠溶液中水滴入少量的氢氧化钡溶液反应的离子方程式:_______
(5)间甲基苯酚与浓溴水反应的化学方程式:_______
(1)过量的硫化钠溶液与少量的三氯化铁溶液反应的离子方程式:
(2)次氯酸钠与少量的二氧化碳反应的离子方程式:
(3)苯甲醛与新制的氢氧化铜溶液反应的化学方程式:
(4)向硫酸氢钠溶液中水滴入少量的氢氧化钡溶液反应的离子方程式:
(5)间甲基苯酚与浓溴水反应的化学方程式:
您最近一年使用:0次
解题方法
3 . (1)已知反应C(s)+H2O(g)⇌CO(g)+H2(g),填写出该反应的平衡常数表达式K=_____ 。
(2)写出乙酸电离方程式:_______________________ 。并写出乙酸电离平衡常数的表达式:K=____ 。
(3)用离子方程式表达纯碱溶液为什么可去油污:_____________ 。
(4)请写CH3COONa溶液的电荷守恒式:__________________________ ,和该溶液各离子浓度从大到小的序列式:___________________________ 。
(5)写出泡沫灭火器工作原理的离子方程式:____________________________________ 。
(2)写出乙酸电离方程式:
(3)用离子方程式表达纯碱溶液为什么可去油污:
(4)请写CH3COONa溶液的电荷守恒式:
(5)写出泡沫灭火器工作原理的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___ (填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______ 。
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________ (填序号)。
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________ 0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________ 。
 H++B2-,回答下列问题:
H++B2-,回答下列问题:(1)NaHB溶液显
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是
您最近一年使用:0次
2019-11-21更新
|
99次组卷
|
2卷引用:吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题
名校
5 . 常温下,溶液M中存在的离子有A2- HA- H+ OH-等,存在的分子有H2O 、H2A 。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:__________________________________________
(2)若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为_____________________ 。已知常温下,Ksp(BaA)=1.8×10-10,向该混合溶液中加入10mL 1mol.L-1BaCl2溶液,混合后溶液中的C(Ba2+)为__________ mol.L-1。
(3)若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为__________ (填序号,下同);pH由大到小的顺序为_______
(1)写出酸H2A的电离方程式:
(2)若溶液M由10mL 2mol.L-1NaHA溶液与10mL 2mol.L-1NaOH溶液混合而得,则溶液M中离子浓度由大到小的顺序为
(3)若NaHA溶液呈碱性,则溶液M有下列三种情况:①0.01 mol.L-1的H2A溶液;②0.01 mol.L-1的NaHA溶液;③0.02 mol.L-1的HCl溶液与0.04 mol.L-1的NaHA溶液等体积混合而成。则三种情况的溶液中C(H2A)最大的为
您最近一年使用:0次
名校
6 . 判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________ ,②__________________________________ 。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________ ,写出化学方程式:____________________________________________________ 。
含氧酸酸性强弱与非羟基氧原子数的关系
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl—OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况
您最近一年使用:0次
名校
解题方法
7 . 现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡____ (填“向左”、“向右”或“不”)移动,若加入少量的冰醋酸,醋酸的电离平衡______ (填“向左”、“向右”或“不”)移动,若加入少量无水醋酸钠固体,待固体溶解后,溶液中c(H+)/c(CH3COOH)的值将________ (填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)______ pH(乙)(填“大于”、“小于”或“等于”)。若将甲、乙两溶液等体积混合,溶液的pH=_______ 。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)_____ V(乙)(填“大于”、“小于”或“等于”)。
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)_____ c(CH3COO-)(填“大于”、“小于”或“等于”)。
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为V(甲)
(4)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+)
您最近一年使用:0次
2019-07-02更新
|
427次组卷
|
10卷引用:【市级联考】吉林省公主岭市2018-2019学年高二上学期期末考试化学试题
【市级联考】吉林省公主岭市2018-2019学年高二上学期期末考试化学试题2015-2016学年贵州省思南中学高二上二次月考化学试卷(已下线)第18天 强电解质和弱电解质的比较——《2019年暑假作业总动员》高二化学(已下线)2019年10月5日 《每日一题》2020年高考一轮复习 ——周末培优(已下线)专题8.1 弱电解质的电离平衡(练)-《2020年高考一轮复习讲练测》(已下线)专题24 弱电解质的电离(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题3 溶液中的离子反应 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)云南省瑞丽市第一民族中学2021-2022学年高二下学期2月份开学测试化学试题云南省楚雄彝族自治州民族中学2021-2022学年高二下学期3月月考化学试题(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)
名校
8 . (1)某温度下纯水中c(H+)=2×10-7 mol/L,若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6 mol/L,此时溶液中的c(OH-)=___ 8×10-9 mol/L,滴入盐酸后水的离子积______ 不变(填“变大”“变小”或“不变”,下同),水的电离度__________ 变小
(2)今有A. CH3COOH B. HCl C. H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度由大到小是_______________ A>B>C(用字母表示,下同);
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积由大到小为_______
(3)体积相同pH均等于12的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为_____________
(2)今有A. CH3COOH B. HCl C. H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度由大到小是
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积由大到小为
(3)体积相同pH均等于12的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
您最近一年使用:0次
名校
9 . 弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为___________________ 。
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是__________________ (填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。
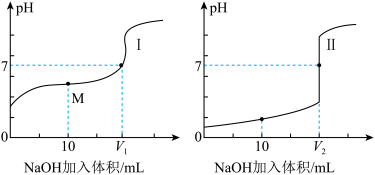
①滴定醋酸的曲线是_______________ (填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________ 。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________ 。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是________________ 。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象_______________________________________ 。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液 pH随加入 NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定用酚酞作指示剂,滴定终点的现象
您最近一年使用:0次
2019-04-28更新
|
368次组卷
|
4卷引用:吉林省白城市通榆县第一中学2019-2020学年高二上学期第三次月考化学试题
10 . 写出下列电解质在水溶液中的电离方程式
NaHCO3_______________________ .
CH3COOH_______________________ .
Fe(OH)3_______________________ .
NaHCO3
CH3COOH
Fe(OH)3
您最近一年使用:0次
2019-01-23更新
|
509次组卷
|
2卷引用:吉林省汪清县第六中学2018-2019学年高二上学期期末考试化学试题



