1 . 已知: ,
, 。25℃时,向
。25℃时,向 溶液中滴加
溶液中滴加 的NaOH溶液。溶液中
的NaOH溶液。溶液中 与加入NaOH溶液体积的关系如图所示。下列说法
与加入NaOH溶液体积的关系如图所示。下列说法错误 的是
 ,
, 。25℃时,向
。25℃时,向 溶液中滴加
溶液中滴加 的NaOH溶液。溶液中
的NaOH溶液。溶液中 与加入NaOH溶液体积的关系如图所示。下列说法
与加入NaOH溶液体积的关系如图所示。下列说法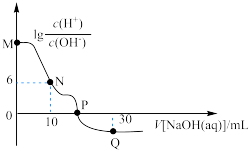
A.M点溶液中存在: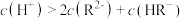 |
B.25℃时.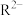 的水解常数 的水解常数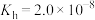 |
| C.P点加入NaOH溶液的体积小于20mL |
D.Q点溶液中存在: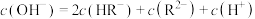 |
您最近一年使用:0次
名校
解题方法
2 . 溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多 、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:
、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:_______ ;农业上用石膏降低其碱性的反应原理:_______ 。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m_______ (填“>”“<”或“=”)n。
(3)氨气的水溶液称为氨水,其中存在的主要溶质微粒是 。
。
已知:a.常温下,醋酸和 的电离平衡常数均为
的电离平衡常数均为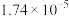 ;
;
b.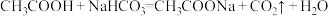 。
。
则 溶液呈
溶液呈_______ 性(填“酸”“碱”或“中”,下同), 溶液呈
溶液呈_______ 性, 溶液中物质的量浓度最大的离子是
溶液中物质的量浓度最大的离子是_______ (填化学式)。
(1)盐碱地(含较多
 、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:
、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m
(3)氨气的水溶液称为氨水,其中存在的主要溶质微粒是
 。
。已知:a.常温下,醋酸和
 的电离平衡常数均为
的电离平衡常数均为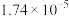 ;
;b.
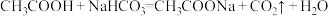 。
。则
 溶液呈
溶液呈 溶液呈
溶液呈 溶液中物质的量浓度最大的离子是
溶液中物质的量浓度最大的离子是
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
(1)在H-S、H-Cl两种共价键中,键的极性较强的是_______ ,键长较长的是_______ 。在四种酸①HClO4;②H2SO4;③HNO2;④HClO中,酸性由弱到强的顺序为_______ 。(用序号表示)
(2)下列气态分子①BeCl2;②BCl3;③CCl4;④H2O中,其键角由大到小的顺序为_______ 。(用序号表示)
(3)SO2与CO2在相同条件下两者在水中的溶解度较大的是____ (写分子式),理由是_____ 。
(1)在H-S、H-Cl两种共价键中,键的极性较强的是
(2)下列气态分子①BeCl2;②BCl3;③CCl4;④H2O中,其键角由大到小的顺序为
(3)SO2与CO2在相同条件下两者在水中的溶解度较大的是
您最近一年使用:0次
名校
4 . 下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)当温度升高时, 值
值___________ (填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是___________ 、___________ (用化学式表示),
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是___________ (填序号),
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________ 。
(3)已知草酸是一种二元弱酸,其电离常数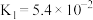 ,
,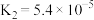 ,写出草酸的电离方程式
,写出草酸的电离方程式___________ 、___________ ,试从电离平衡移动的角度解释 的原因
的原因___________ 。
(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实___________ (填“能”或“不能”)比较醋酸与碳酸的酸性强弱,请设计一个简单的实验验证醋酸与碳酸的酸性强弱。方案:___________ 。
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) | 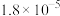 |  | 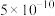 |  |
 值
值(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知草酸是一种二元弱酸,其电离常数
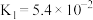 ,
,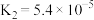 ,写出草酸的电离方程式
,写出草酸的电离方程式 的原因
的原因(4)用食醋浸泡有水垢的水壶,可以清除其中的水垢,通过该事实
您最近一年使用:0次
2021-07-22更新
|
2070次组卷
|
7卷引用:内蒙古赤峰市2020-2021学年高二下学期期末考试化学(B)试题。
内蒙古赤峰市2020-2021学年高二下学期期末考试化学(B)试题。(已下线)专题3.1 电离平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.2 电离平衡常数-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.1.2 电离平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)甘肃省张掖市高台县第一中学2022--2023学年高二上学期10月模拟考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
解题方法
5 . 25℃时,有关物质的电离平衡常数如下:
(1)电解质酸性由强到弱的顺序为___ (用化学式表示,下同)。
(2)常温下,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___ 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO 、HSO
、HSO 、SO
、SO 在溶液中结合H+的能力由大到小的顺序为
在溶液中结合H+的能力由大到小的顺序为___ 。
(4)NaHSO3溶液显酸性的原因___ (离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是___ 。
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=4.5×10-2 K2=1.02×10-7 |
(2)常温下,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者
(3)下列离子CH3COO-、CO
 、HSO
、HSO 、SO
、SO 在溶液中结合H+的能力由大到小的顺序为
在溶液中结合H+的能力由大到小的顺序为(4)NaHSO3溶液显酸性的原因
您最近一年使用:0次
2020-10-28更新
|
79次组卷
|
3卷引用:内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题
名校
6 . 醋酸、盐酸是生活中常见的物质。
(1)25℃时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是___ 。
a.两溶液的pH相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)25℃时,pH均等于4的醋酸溶液和盐酸溶液,醋酸溶液中水电离出的H+浓度与盐酸溶液中水电离出的H+浓度之比是___ 。
(3)醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,下列叙述不正确的是
CH3COO-+H+,下列叙述不正确的是___ 。
a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO‾)
b.0.1mol·L-1的CH3COOH溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中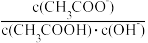 不变
不变
(4)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
a.加水稀释10倍后,醋酸溶液中的c(H+)__ (填“>”“=”或“<”)盐酸溶液中的c(H+)。
b.加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸__ (填“>”“=”或“<”)盐酸。
c.使温度都升高20℃,溶液中c(H+):醋酸__ (填“>”“=”或“<”)盐酸。
d.分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是__ (填字母)。(①表示盐酸,②表示醋酸)

(5)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是__ (填字母)。
a.电离程度增大
b.溶液中离子总数增多
c.溶液导电性增强
d.溶液中醋酸分子增多
(1)25℃时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是
a.两溶液的pH相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)25℃时,pH均等于4的醋酸溶液和盐酸溶液,醋酸溶液中水电离出的H+浓度与盐酸溶液中水电离出的H+浓度之比是
(3)醋酸溶液中存在电离平衡:CH3COOH
 CH3COO-+H+,下列叙述不正确的是
CH3COO-+H+,下列叙述不正确的是a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO‾)
b.0.1mol·L-1的CH3COOH溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中
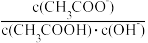 不变
不变(4)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
a.加水稀释10倍后,醋酸溶液中的c(H+)
b.加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
c.使温度都升高20℃,溶液中c(H+):醋酸
d.分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是

(5)将0.1mol·L-1的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,正确的是
a.电离程度增大
b.溶液中离子总数增多
c.溶液导电性增强
d.溶液中醋酸分子增多
您最近一年使用:0次
2020-03-18更新
|
240次组卷
|
2卷引用:内蒙古包钢第一中学2019-2020学年高二上学期10月月考化学试题
名校
7 . 电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______ b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的__________ (填字母)。
A. c(H+) B. C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:
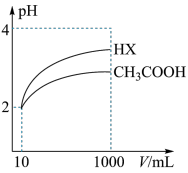
①25℃时,醋酸的电离常数________ HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
(1)已知:
| 化学式 | CH3COOH | HClO |
| 电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的
A. c(H+) B.
 C. c(H+)·c(OH-)
C. c(H+)·c(OH-) (3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)
您最近一年使用:0次
2019-11-30更新
|
620次组卷
|
3卷引用:内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期期中考试化学试题
名校
8 . 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:

(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为________ 。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是__________ 。
(2)从图中推断NaH2PO4溶液呈______ 性(填“酸”“碱”或“中”),其原因是_________ 。
(3)在Na3PO4溶液中,c(Na+)/c(PO43-)______ 3(填“>”“=”或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是____ 。

(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为
(2)从图中推断NaH2PO4溶液呈
(3)在Na3PO4溶液中,c(Na+)/c(PO43-)
您最近一年使用:0次
名校
解题方法
9 . 按要求回答下列问题:
Ⅰ.(1)下列措施中可以使0.10mol·L-1 CH3COOH溶液的电离程度增大的是__________ (填序号)。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________ V(醋酸)(填">" "<"或“=”)。
(3)某温度下,Kw=1×10-12,将 0.02mol·L-1 的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH =__________ 。
Ⅱ.实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是__________
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)__________ (填“>”“<”或“=”)1×10-14
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________ .
Ⅰ.(1)下列措施中可以使0.10mol·L-1 CH3COOH溶液的电离程度增大的是
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
(3)某温度下,Kw=1×10-12,将 0.02mol·L-1 的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH =
Ⅱ.实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O
 H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:(1)纯硫酸在液态时自身电离的方程式是
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是
您最近一年使用:0次
2019-04-21更新
|
214次组卷
|
3卷引用:【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题
【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江西省萍乡市芦溪中学2021-2022学年高二上学期期中考试化学(理)试题
名校
10 . 现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。

(1)a点时的溶液中由水电离出的c(H+)=________ mol·L-1,Ka(HB)=________ 。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________ ;b点对应的溶液中c(HB)____ c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________ 。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________ c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________ 0.01mol·L-1(填“>”“<”或“=”)。
(4)已知温度时,0.1 mol·L-1的某一元酸HB在水中有 0.1% 发生电离,回答下列各问题:
①该溶液的pH=________ 。
②HB的电离平衡常数K=________ 。
③由HB电离出的c(H+)约为水电离出的c(H+)的________ 倍。

(1)a点时的溶液中由水电离出的c(H+)=
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)
(4)已知温度时,0.1 mol·L-1的某一元酸HB在水中有 0.1% 发生电离,回答下列各问题:
①该溶液的pH=
②HB的电离平衡常数K=
③由HB电离出的c(H+)约为水电离出的c(H+)的
您最近一年使用:0次
2018-12-17更新
|
583次组卷
|
2卷引用:【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高二下学期开学考试化学试题



