名校
解题方法
1 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径、CO、捕获与CO2重整是CO2利用的研究热点,
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则 △H=
△H=________ kJ∙mol−1。
(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:_____ T2(填“>”“<”或“=”),依据为________ ;
②图中a=________ ;
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为________ 。
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液

 溶液pH=
溶液pH=_____ (室温下,
 的
的
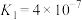 ;
;
 )。
)。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是___________ 。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
| 共价键 | C=O | C-O | H-H | H-O | C-H |
| 键能/(kJ·mol⁻¹) | 799 | 343 | 436 | 463 | 413 |
 △H=
△H=(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为

 溶液pH=
溶液pH= 的
的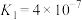 ;
; )。
)。(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是
您最近一年使用:0次
2023-10-29更新
|
376次组卷
|
2卷引用:内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题
名校
2 . 在室温下,下列五种溶液:
①0.1 mol·L-1NH4Cl ②0.1 mol·L-1CH3COONH4 ③0.1 mol·L-1NH4HSO4
④0.1 mol·L-1NH3·H2O和 0.1 mol·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈酸性的原因是___________ (用离子方程式表示)。
(2)比较溶液②、③中c(NH )的大小关系是②
)的大小关系是②___________ ③(填“>”“<”或“=”)。
(3)在溶液④中,NH3·H2O和______ 物质的量浓度之和为0.2 mol·L-1(填微粒符号)。
(4)室温,溶液②的pH=7,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-)______ c(NH )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(5)溶液⑤稀释100倍后所得溶液pH___ a+2(填“>”或“<”或“=”)。
①0.1 mol·L-1NH4Cl ②0.1 mol·L-1CH3COONH4 ③0.1 mol·L-1NH4HSO4
④0.1 mol·L-1NH3·H2O和 0.1 mol·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈酸性的原因是
(2)比较溶液②、③中c(NH
 )的大小关系是②
)的大小关系是②(3)在溶液④中,NH3·H2O和
(4)室温,溶液②的pH=7,CH3COO-与NH
 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-) )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。(5)溶液⑤稀释100倍后所得溶液pH
您最近一年使用:0次
2022-04-01更新
|
696次组卷
|
4卷引用:内蒙古赤峰实验中学2023-2024学年高二下学期开学化学试题
名校
3 . 氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+H2(g)⇌2NH3(g)△H<0的模拟研究,在密闭容器中,进行三次实验,每次开始时均通入0.1mol N2(g)、0.3molH2(g)。与实验①相比较,实验②、③都各改变了一个条件,三次实验中c(N2)随时间(t)的变化如图所示。
与实验①相比,实验②所采用的实验条件可能为_______ (填字母),实验③所采用的实验条件可能为_______ (填字母)。
a.加压缩小容器体积 b.减压扩大容器体积c.升高温度 d.降低温度 e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为:2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g) △H<0。欲提高平衡时废气中氮氧化物的转化率,可采取的措施是________ (填字母)。
a.降低温度 b.增大压强 c.增大NH3的浓度 d.使用催化剂
(3)NCl3遇水发生水解反应,生成NH3的同时得到_______ (填化学式)。
(4)25℃时,将amol/L的氨水与bmol/L盐酸等体积混合(忽略溶液体积变化),反应后溶液恰好显中性,则a____ b(填“>”“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为_____ 。
(1)某小组进行工业合成氨N2(g)+H2(g)⇌2NH3(g)△H<0的模拟研究,在密闭容器中,进行三次实验,每次开始时均通入0.1mol N2(g)、0.3molH2(g)。与实验①相比较,实验②、③都各改变了一个条件,三次实验中c(N2)随时间(t)的变化如图所示。

与实验①相比,实验②所采用的实验条件可能为
a.加压缩小容器体积 b.减压扩大容器体积c.升高温度 d.降低温度 e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为:2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g) △H<0。欲提高平衡时废气中氮氧化物的转化率,可采取的措施是
a.降低温度 b.增大压强 c.增大NH3的浓度 d.使用催化剂
(3)NCl3遇水发生水解反应,生成NH3的同时得到
(4)25℃时,将amol/L的氨水与bmol/L盐酸等体积混合(忽略溶液体积变化),反应后溶液恰好显中性,则a
您最近一年使用:0次
2020-09-02更新
|
338次组卷
|
3卷引用:内蒙古喀喇沁旗锦山蒙古族中学2021-2022学年高二上学期第二次调研考试化学试题
4 . 按要求填空。
(1) Na2CO3溶液中滴入酚酞试液呈红色,原因是(用离子方程式表示)_____ ;加热后颜色变深,原因_____ 。
(2) FeCl3具有净水作用的原理(用离子方程式表示)_______ 。
(3)将NaHCO3溶液与AlCl3溶液混合(写出反应的离子方程式)_______ 。
(4)已知25℃时,Ksp[Mg(OH)2]=1.6×10-11。向0.01 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的c(OH-)为_____ mol/L;
(5)常温时,Fe(OH)3的溶度积常数Ksp=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5 mol/L],则溶液的pH应大于_______ 。
(6) 25℃时,在2.0×10-3 mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液 pH的关系如下图。则25℃时,HF电离平衡常数为Ka(HF)=______ 。

(1) Na2CO3溶液中滴入酚酞试液呈红色,原因是(用离子方程式表示)
(2) FeCl3具有净水作用的原理(用离子方程式表示)
(3)将NaHCO3溶液与AlCl3溶液混合(写出反应的离子方程式)
(4)已知25℃时,Ksp[Mg(OH)2]=1.6×10-11。向0.01 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的c(OH-)为
(5)常温时,Fe(OH)3的溶度积常数Ksp=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5 mol/L],则溶液的pH应大于
(6) 25℃时,在2.0×10-3 mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液 pH的关系如下图。则25℃时,HF电离平衡常数为Ka(HF)=

您最近一年使用:0次
解题方法
5 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________ (填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10mol•L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ⇌ COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=___________ %,反应平衡常数K=___________ ;
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2___________ α1,该反应的ΔH__________ 0;(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是__________ (填标号);
A.H2S B.CO2 C.COS D.N2
(3)25°C时,①S(s)+H2(g)⇌H2S(g)Kp1=6.0×105
②Si(s)+2H2(g) ⇌SiH4(g)Kp2=7.8×106。
则Si(s)+2H2S(g) ⇌SiH4(g)+2S(s)的Kp=__________ (保留两位有效数字,Kp为以分压表示的平衡常数)。
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10mol•L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ⇌ COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2
③向反应器中再分别充入下列气体,能使H2S转化率增大的是
A.H2S B.CO2 C.COS D.N2
(3)25°C时,①S(s)+H2(g)⇌H2S(g)Kp1=6.0×105
②Si(s)+2H2(g) ⇌SiH4(g)Kp2=7.8×106。
则Si(s)+2H2S(g) ⇌SiH4(g)+2S(s)的Kp=
您最近一年使用:0次
名校
解题方法
6 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中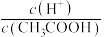 值增大的措施是
值增大的措施是_______________ (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________ 。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________ ;该混合溶液中:c(A-)-c(Na+)=______________________ mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________ (填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____ c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL 0.2mol/LAgNO3溶液中;
c.100mL 0.1mol/L氯化铝溶液中;
d.100mL 0.1mol/L盐酸溶液中。
充分搅拌后,相同温度下银离子浓度由大到小的顺序是________________ (填写序号);b中氯离子的浓度为_________________ 。
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中
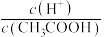 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:
②溶液a的pH大于8,则溶液中c(H2CO3)
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL 0.2mol/LAgNO3溶液中;
c.100mL 0.1mol/L氯化铝溶液中;
d.100mL 0.1mol/L盐酸溶液中。
充分搅拌后,相同温度下银离子浓度由大到小的顺序是
您最近一年使用:0次
2020-04-18更新
|
388次组卷
|
3卷引用:内蒙古赤峰市赤峰二中2019-2020学年高二下学期第一次月考化学试题
名校
解题方法
7 . 工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收 SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素)。

请回答下列问题:
(1)装置 I 中生成 HSO3-的离子方程式为_______ 。
(2)含硫各微粒(H2SO3、HSO3-和 SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图所示:
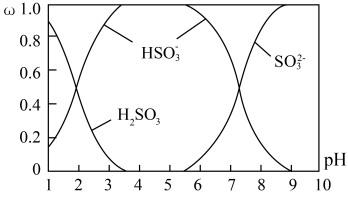
①下列说法正确的是_______ (填标号)。
A. pH=7 时,溶液中 c( Na+)<c(HSO3-)+c(SO32-)
B. 由图中数据,可以估算出 H2SO3 的第二级电离平衡常数 K2≈10-7
C. 为获得尽可能纯的 NaHSO3,应将溶液的 pH 控制在 4~5 为宜
D. pH=9时溶液中 c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3)
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为 2,用化学平衡移动原理解释溶液pH降低的原因_______ 。
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-离子方程式_______ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。
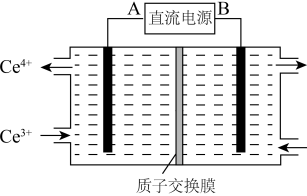
图中A为电源的_______ (填“正”或“负”)极。右侧反应室中发生的主要电极反应为_______ 。
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为0.75 mol/L,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为_______ L

请回答下列问题:
(1)装置 I 中生成 HSO3-的离子方程式为
(2)含硫各微粒(H2SO3、HSO3-和 SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图所示:

①下列说法正确的是
A. pH=7 时,溶液中 c( Na+)<c(HSO3-)+c(SO32-)
B. 由图中数据,可以估算出 H2SO3 的第二级电离平衡常数 K2≈10-7
C. 为获得尽可能纯的 NaHSO3,应将溶液的 pH 控制在 4~5 为宜
D. pH=9时溶液中 c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3)
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为 2,用化学平衡移动原理解释溶液pH降低的原因
(3)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-离子方程式
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

图中A为电源的
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为0.75 mol/L,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为
您最近一年使用:0次
名校
8 . 已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是__________ (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__________ (填字母)。
a. b.
b.  c.
c. 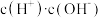 d.
d.  e.
e. 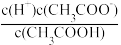
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式__________ 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=__________ (填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为__________
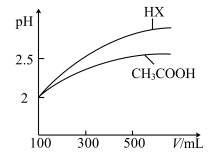
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数__________ (填“>”、”=”或“<”)CH3COOH的电离平衡常数。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | 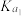 =4.3×10-7 =4.3×10-7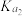 =5.6×10-11 =5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是
a.
 b.
b.  c.
c. 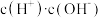 d.
d.  e.
e. 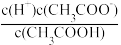
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数

您最近一年使用:0次
9 . (1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
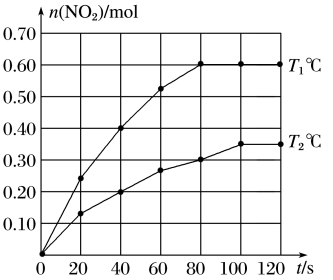
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________ mol/(L·s)。
②ΔH________ 0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

①甲容器平衡后物质B的转化率为_______ ;
②T℃ 时该反应的平衡常数为________ 。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________ 性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g)
 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为
②ΔH
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)
 xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
①甲容器平衡后物质B的转化率为
②T℃ 时该反应的平衡常数为
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显
②用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
2019-03-12更新
|
221次组卷
|
2卷引用:内蒙古集宁一中2018-2019学年高一下学期期末考试化学试题
名校
10 . 一定温度下,有 盐酸;
盐酸; 硫酸;
硫酸; 醋酸三种酸的稀溶液
醋酸三种酸的稀溶液 用a、b、c、
用a、b、c、 、
、 、
、 号填写
号填写
 当其物质的量浓度相同时,
当其物质的量浓度相同时, 由大到小的顺序是
由大到小的顺序是____________ ,
 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是____________ ,
 当其
当其 相同时,物质的量浓度由大到小的顺序为
相同时,物质的量浓度由大到小的顺序为____________ ,
 当
当 相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气 相同状况
相同状况 ,则开始时反应速率的大小关系是
,则开始时反应速率的大小关系是____________ .
 将
将 相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍, 由大到小的顺序为
由大到小的顺序为_____________ .
 盐酸;
盐酸; 硫酸;
硫酸; 醋酸三种酸的稀溶液
醋酸三种酸的稀溶液 用a、b、c、
用a、b、c、 、
、 、
、 号填写
号填写
 当其物质的量浓度相同时,
当其物质的量浓度相同时, 由大到小的顺序是
由大到小的顺序是 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是 当其
当其 相同时,物质的量浓度由大到小的顺序为
相同时,物质的量浓度由大到小的顺序为 当
当 相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气 相同状况
相同状况 ,则开始时反应速率的大小关系是
,则开始时反应速率的大小关系是 将
将 相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍, 由大到小的顺序为
由大到小的顺序为
您最近一年使用:0次
2018-12-31更新
|
143次组卷
|
2卷引用:【全国百强校】内蒙古杭锦后旗奋斗中学2018-2019学年高二下学期第一次月考化学试题



