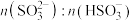1 . 氯化磷酸三钠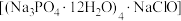 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为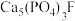 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
b.常温下 的
的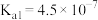 ,
,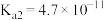 ;
; 。
。
c.常温下,磷酸中含磷微粒分布分数[如 的分布分数表示为
的分布分数表示为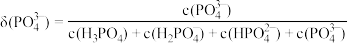 ]与pH的关系如下图所示:
]与pH的关系如下图所示:___________ 。
(2)常温下,“中和Ⅰ”应控制的pH约为___________ , 的
的
___________ 。
(3)“中和Ⅱ”不用 溶液,其原因是
溶液,其原因是___________ 。
(4)“合成”过程中两种溶液混合后需快速冷却,原因是___________ ;“系列操作”中包含“蒸发浓缩、冷却结晶、过滤、洗涤、干燥”,干燥时需控制温度不超过60℃的原因是___________ 。母液可以进入___________ (填操作单元名称)进行循环利用。
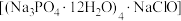 具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为
具有良好的灭菌、消毒、漂白作用,常温下较稳定,受热易分解。以磷矿石[主要成分为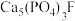 ,含杂质
,含杂质 、
、 等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题:
等]为原料制取氯化磷酸三钠的工艺流程如下。回答下列问题: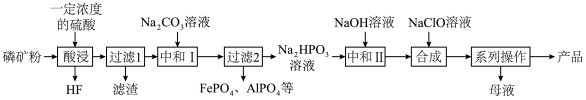
b.常温下
 的
的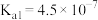 ,
,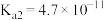 ;
; 。
。c.常温下,磷酸中含磷微粒分布分数[如
 的分布分数表示为
的分布分数表示为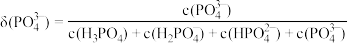 ]与pH的关系如下图所示:
]与pH的关系如下图所示: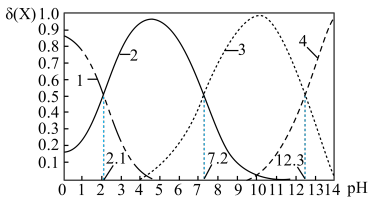
(2)常温下,“中和Ⅰ”应控制的pH约为
 的
的
(3)“中和Ⅱ”不用
 溶液,其原因是
溶液,其原因是(4)“合成”过程中两种溶液混合后需快速冷却,原因是
您最近一年使用:0次
解题方法
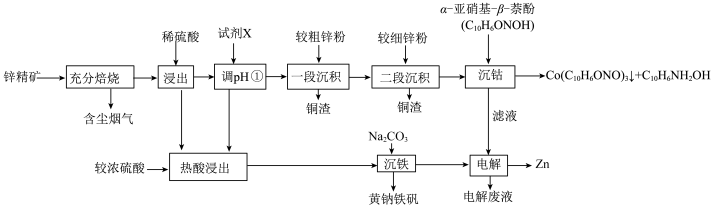
2 . 一种以锌精矿(主要成分是ZnS,还含有铁、钴、铜等元素的氧化物)为原料制备纯锌并将其它金属元素回收利用的工艺流程如下: ),铁酸锌不溶于稀硫酸
),铁酸锌不溶于稀硫酸
②黄钠铁矾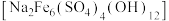 是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成
是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成
③ ;
;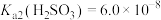 ;
;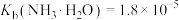
回答下列问题:
(1)常温下,“含尘烟气”中的 用氨水吸收至溶液的
用氨水吸收至溶液的 时,
时, 的平衡常数
的平衡常数
_______ 。
(2)“调pH①”试剂X可选用_______ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,一段时间后反应速率显著增大,请解释此现象产生的原因_______ 。
(4)“沉铁”步骤中,pH不宜过大或过小,原因是_______ ,“沉铁”时生成黄钠铁矾的离子方䅠式为_______ 。
(5)电解废液可返回到_______ 。操作进行循环利用。
(6)“沉钴”的离子方程式为_______ 。
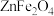 ),铁酸锌不溶于稀硫酸
),铁酸锌不溶于稀硫酸②黄钠铁矾
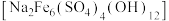 是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成
是一种浅黄色晶体,过滤及沉淀性能较好,但溶液酸性较强时不易生成③
 ;
;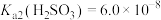 ;
;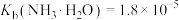
回答下列问题:
(1)常温下,“含尘烟气”中的
 用氨水吸收至溶液的
用氨水吸收至溶液的 时,
时, 的平衡常数
的平衡常数
(2)“调pH①”试剂X可选用
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,一段时间后反应速率显著增大,请解释此现象产生的原因
(4)“沉铁”步骤中,pH不宜过大或过小,原因是
(5)电解废液可返回到
(6)“沉钴”的离子方程式为
您最近一年使用:0次
3 . 以电子废弃物(主要含Au、Cu、Co、Ni等金属单质)为原料绿色化回收这些金属的工艺流程如下。 (离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(1)滤渣3的主要成分是_______ 。
(2)Co(OH)₂的酸式电离方程式为_______ ,其平衡常数为_______ ,滤液1中金属离子的浓度均为10⁻³mol⋅L⁻¹,加碱调pH的过程中溶液体积变化忽略平计,则a=_______ ,此时Ni²⁺的浓度为_______ mol·L⁻¹。
(3)滤液4的主要阴离子是Aul ,加入Na2S2O5溶液反应的离子方程式是
,加入Na2S2O5溶液反应的离子方程式是_______ 。
(4)已知: 滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是_______ 。
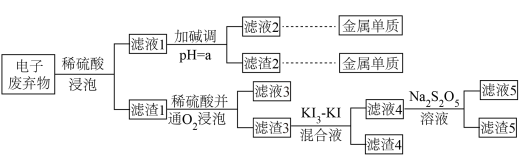
 (离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。
(离子浓度小于10⁻⁵ mol·L⁻¹时通常被认为不存在)。(1)滤渣3的主要成分是
(2)Co(OH)₂的酸式电离方程式为
(3)滤液4的主要阴离子是Aul
 ,加入Na2S2O5溶液反应的离子方程式是
,加入Na2S2O5溶液反应的离子方程式是(4)已知:
 滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
滤液5经过简单处理就可以循环利用碘,处理过程需要加入的关键试剂应该是
您最近一年使用:0次
4 . Ⅰ.太空很神秘,水的世界也深不可测,从水作溶剂、水分子运动到水的电离、水与活泼金属反应等等。结合书本知识,回答下列问题:
(1)标准状况下,0.01 的NaOH溶液的pH
的NaOH溶液的pH_______ (填“>”“<”或“=”,下同)12,该温度下,水的离子积常数
_______ 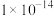 。
。
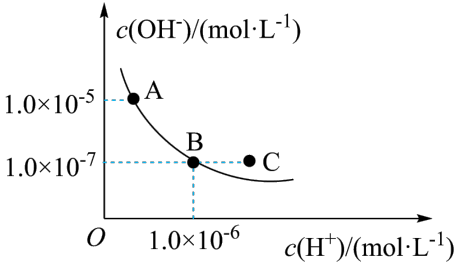
(2)T℃下,水的离子积曲线如图所示。_______ (填字母)。
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将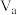 L pH=a NaOH溶液与
L pH=a NaOH溶液与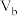 L
L 硫酸混合。
硫酸混合。
若所得混合溶液呈中性,且a=12,b=1,则
_______ ;若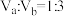 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=_______ 。
(3)现有以下五种电解质溶液,回答下列问题:
① ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是_______ (填序号)。
②浓度均为0.1 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为_______ (填序号)。
Ⅱ. 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
回答下列问题:
(4)常温下,下列事实能说明 是弱电解质的是
是弱电解质的是_______ (填写序号)
① 与水能以任意比互溶
与水能以任意比互溶
②0.1mol/L 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱
③常温下pH=3的 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4
④ 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大
⑥大小相同的锌片与同体积同浓度的盐酸和 反应,产生
反应,产生 的物质的量相同
的物质的量相同
(5)已知 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=_______ 。用水缓慢稀释该氨水的过程中,溶液中随着水量的增加,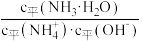
_______ 。(填“增大”“减小”或“不变”)
(1)标准状况下,0.01
 的NaOH溶液的pH
的NaOH溶液的pH
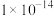 。
。(2)T℃下,水的离子积曲线如图所示。
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将
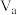 L pH=a NaOH溶液与
L pH=a NaOH溶液与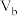 L
L 硫酸混合。
硫酸混合。若所得混合溶液呈中性,且a=12,b=1,则

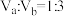 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=(3)现有以下五种电解质溶液,回答下列问题:
①
 ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1
 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是②浓度均为0.1
 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为Ⅱ.
 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:| 物质 |  |  |  |
| 电离常数 | 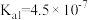 , ,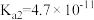 | 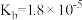 | 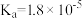 |
(4)常温下,下列事实能说明
 是弱电解质的是
是弱电解质的是①
 与水能以任意比互溶
与水能以任意比互溶②0.1mol/L
 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱③常温下pH=3的
 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4④
 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向
 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大⑥大小相同的锌片与同体积同浓度的盐酸和
 反应,产生
反应,产生 的物质的量相同
的物质的量相同(5)已知
 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=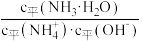
您最近一年使用:0次
5 . 烟气中的SO2可以用钠碱循环法加以处理,用Na2SO3溶液作为吸收液,当吸收液与SO2反应至pH为6左右时,可将吸收液通入电解槽进行再生,吸收液pH随微粒组成的变化关系见表:
| 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
回答下列问题:
(1)吸收液pH由8.2下降至6.2过程中发生反应的离子方程式为
(2)当吸收液呈中性时,溶液中

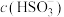 (填“>”“<”或“=”,下同);pH=7.2时,
(填“>”“<”或“=”,下同);pH=7.2时,
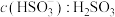 第二步电离平衡常数
第二步电离平衡常数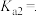
(3)NaHSO3﹣Na2SO3、H2CO3﹣NaHCO3,Na2HPO4﹣NaH2PO4都可组成缓冲溶液,缓冲溶液中lgx[x表示
 或
或 ]与pH的关系如图,当lgx数值在﹣1~1之间时具有可实用价值的缓冲能力,曲线
]与pH的关系如图,当lgx数值在﹣1~1之间时具有可实用价值的缓冲能力,曲线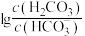 与pH的变化关系,应控制Na2HPO4﹣NaH2PO4缓冲溶液的pH范围为
与pH的变化关系,应控制Na2HPO4﹣NaH2PO4缓冲溶液的pH范围为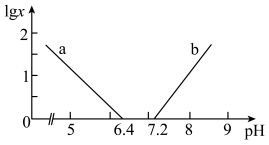
您最近一年使用:0次
名校
6 . 化学反应原理在生产、生活及科学研究中有着广泛的应用。25℃时,部分物质的电离平衡常数如表所示,请结合所提供的数据回答下列问题(注:本题所涉及的选择题,选项不唯一)。
化学式 电离平衡常数(25℃)
HCN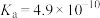
CH3COOH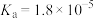
H2CO3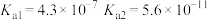
HClO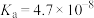
NH3·H2O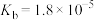
(1)根据上表数据,判断下列反应不能发生的是_______ (填字母)。
A.
B.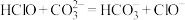
C.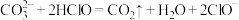
D.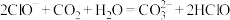
E.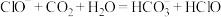
(2)氨水可以吸收CO2.常温下,某氨水的浓度为2mol/L,则溶液中
_______  。将CO2通入氨水中使溶液恰好呈中性,则此时
。将CO2通入氨水中使溶液恰好呈中性,则此时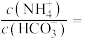
_______ 保留小数点后4位数字)
(3)25℃时,在浓度均为 的①
的① 、②
、② 、③
、③ 的溶液中,
的溶液中,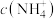 由大到小的顺序为
由大到小的顺序为_______ (用序号表示)。
(4)25℃时,将 HCN溶液与
HCN溶液与 NaOH溶液等体积混合,混合溶液中①c(Na+)、②c(CN-)、③c(HCN)由大到小的顺序为
NaOH溶液等体积混合,混合溶液中①c(Na+)、②c(CN-)、③c(HCN)由大到小的顺序为_______ (用序号表示)。
(5)25℃时,用 的NaOH溶液滴定20mL
的NaOH溶液滴定20mL 的HCN溶液,当滴加VmLNaOH溶液时,混合溶液的pH=7.HCN的电离常数以
的HCN溶液,当滴加VmLNaOH溶液时,混合溶液的pH=7.HCN的电离常数以 表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_______(填写字母)。
表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_______(填写字母)。
化学式 电离平衡常数(25℃)
HCN
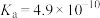
CH3COOH
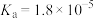
H2CO3
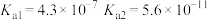
HClO
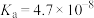
NH3·H2O
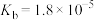
(1)根据上表数据,判断下列反应不能发生的是
A.

B.
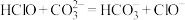
C.
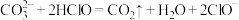
D.
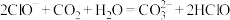
E.
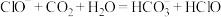
(2)氨水可以吸收CO2.常温下,某氨水的浓度为2mol/L,则溶液中

 。将CO2通入氨水中使溶液恰好呈中性,则此时
。将CO2通入氨水中使溶液恰好呈中性,则此时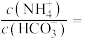
(3)25℃时,在浓度均为
 的①
的① 、②
、② 、③
、③ 的溶液中,
的溶液中,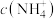 由大到小的顺序为
由大到小的顺序为(4)25℃时,将
 HCN溶液与
HCN溶液与 NaOH溶液等体积混合,混合溶液中①c(Na+)、②c(CN-)、③c(HCN)由大到小的顺序为
NaOH溶液等体积混合,混合溶液中①c(Na+)、②c(CN-)、③c(HCN)由大到小的顺序为(5)25℃时,用
 的NaOH溶液滴定20mL
的NaOH溶液滴定20mL 的HCN溶液,当滴加VmLNaOH溶液时,混合溶液的pH=7.HCN的电离常数以
的HCN溶液,当滴加VmLNaOH溶液时,混合溶液的pH=7.HCN的电离常数以 表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_______(填写字母)。
表示,忽略混合时引起的溶液体积的变化,下列叙述不正确的是_______(填写字母)。| A.V>20 | B.混合溶液的pH=7时: |
C.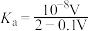 | D.滴定过程中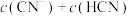 始终不变 始终不变 |
您最近一年使用:0次
名校
解题方法
7 . 活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe、Zn等。如图是利用钯碳制备氧化钯( )和Pd的流程。
)和Pd的流程。______ (填仪器名称)中模拟“焚烧”过程。 为二元弱碱,常温下
为二元弱碱,常温下 的电离常数
的电离常数 、
、 ,则常温下0.1mol/L
,则常温下0.1mol/L  水溶液pH=
水溶液pH=______ 。
(2)“溶浸”步骤中钯与王水发生反应生成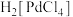 和一种有毒的无色气体A,A为
和一种有毒的无色气体A,A为______ (填化学式),钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为______ ,写出“除锌铁”步骤中钯的化合物与试剂Ⅰ反应的化学方程式______ 。______ (填名称),加入该试剂的目的是______ 。
(4)海绵钯具有优良的储氢功能。假设海绵钯的密度为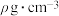 ,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
______ mol(氢气的浓度r为1mol Pd吸附氢气的物质的量,用含 、n的分数式表示)。
、n的分数式表示)。
 )和Pd的流程。
)和Pd的流程。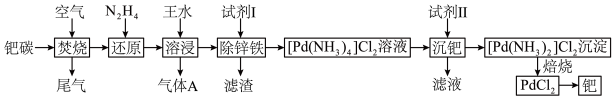
 为二元弱碱,常温下
为二元弱碱,常温下 的电离常数
的电离常数 、
、 ,则常温下0.1mol/L
,则常温下0.1mol/L  水溶液pH=
水溶液pH=(2)“溶浸”步骤中钯与王水发生反应生成
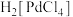 和一种有毒的无色气体A,A为
和一种有毒的无色气体A,A为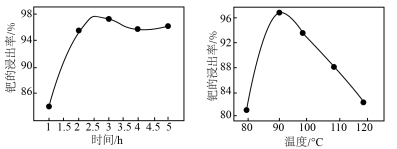
(4)海绵钯具有优良的储氢功能。假设海绵钯的密度为
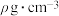 ,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
 、n的分数式表示)。
、n的分数式表示)。
您最近一年使用:0次
2024-03-15更新
|
503次组卷
|
4卷引用:山东省聊城市2023-2024学年高三下学期一模化学试题
山东省聊城市2023-2024学年高三下学期一模化学试题 (已下线)化学(山东卷02)-2024年高考押题预测卷山东省聊城市2024年高考模拟试题(一) 化学2024届四川省绵阳南山中学高三下学期高考仿真演练(一) 理科综合试题-高中化学
8 . 一定条件下,水气变换反应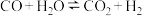 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
Ⅰ.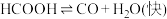
Ⅱ.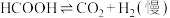
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
_____ (用含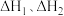 的代数式表示)。
的代数式表示)。
(2)反应Ⅰ正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为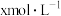 时,
时, 浓度为
浓度为_____  ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
_____  (用含
(用含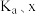 和k的代数式表示)。
和k的代数式表示)。
(3) 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满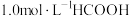 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为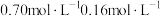 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为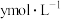 。体系达平衡后
。体系达平衡后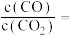
_____ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为_____ 。
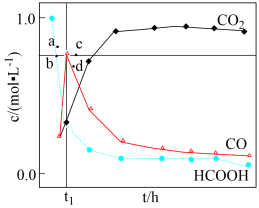
相同条件下,若反应起始时溶液中同时还含有 盐酸,则图示点
盐酸,则图示点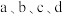 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是_____ (填标号)。与不含盐酸相比, 达浓度峰值时,
达浓度峰值时, 浓度
浓度_____ (填“增大”“减小”或“不变”), 的值
的值_____ (填“增大”“减小”或“不变”)。
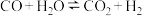 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:Ⅰ.
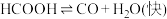
Ⅱ.
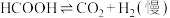
研究发现,在反应Ⅰ、Ⅱ中,
 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为
 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
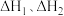 的代数式表示)。
的代数式表示)。(2)反应Ⅰ正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为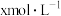 时,
时, 浓度为
浓度为 ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
 (用含
(用含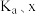 和k的代数式表示)。
和k的代数式表示)。(3)
 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满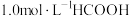 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为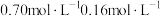 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为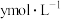 。体系达平衡后
。体系达平衡后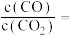

相同条件下,若反应起始时溶液中同时还含有
 盐酸,则图示点
盐酸,则图示点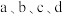 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是 达浓度峰值时,
达浓度峰值时, 浓度
浓度 的值
的值
您最近一年使用:0次
2023-06-19更新
|
10606次组卷
|
10卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(原理综合题)四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市第二中学2023-2024学年高三上学期10月月考化学试题(已下线)专题04 电离平衡 水的电离和溶液的pH-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
名校
9 . 单质硼是高效的中子吸收剂,一种利用硼镁矿(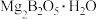 )制备粗硼的工艺流程如图所示。
)制备粗硼的工艺流程如图所示。

(1)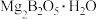 中硼元素的化合价为
中硼元素的化合价为___________ 。
(2)碱溶后所得滤液1的主要成分为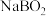 ,则滤渣为
,则滤渣为___________ (填化学式)。
(3)向滤液1中通入适量 后得到硼砂(
后得到硼砂(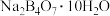 ),将硼砂溶于热水后,用硫酸调节溶液的
),将硼砂溶于热水后,用硫酸调节溶液的 值为
值为 以制备
以制备 ,该反应的离子方程式为
,该反应的离子方程式为___________ ,已知 是一元弱酸,但自身不能电离出氢离子,其电离方程式为
是一元弱酸,但自身不能电离出氢离子,其电离方程式为___________ 。
(4)滤液2的主要成分是___________ (填化学式)。
(5)加热硼酸脱水得到氧化物,热还原得到粗硼的化学方程式为___________ ,上述滤渣经过一系列转化可得金属镁,若硼镁矿中硼、镁元素充分利用,理论上制得1.1吨硼时,需要额外提供金属镁的质量为___________ 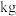 。
。
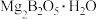 )制备粗硼的工艺流程如图所示。
)制备粗硼的工艺流程如图所示。
(1)
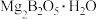 中硼元素的化合价为
中硼元素的化合价为(2)碱溶后所得滤液1的主要成分为
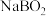 ,则滤渣为
,则滤渣为(3)向滤液1中通入适量
 后得到硼砂(
后得到硼砂(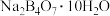 ),将硼砂溶于热水后,用硫酸调节溶液的
),将硼砂溶于热水后,用硫酸调节溶液的 值为
值为 以制备
以制备 ,该反应的离子方程式为
,该反应的离子方程式为 是一元弱酸,但自身不能电离出氢离子,其电离方程式为
是一元弱酸,但自身不能电离出氢离子,其电离方程式为(4)滤液2的主要成分是
(5)加热硼酸脱水得到氧化物,热还原得到粗硼的化学方程式为
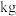 。
。
您最近一年使用:0次
2023-05-19更新
|
178次组卷
|
2卷引用:山东省聊城市百师联盟2023届高三下学期(二轮复习联考)模拟预测(三)化学试题
10 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ。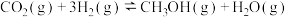
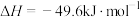
反应ⅱ。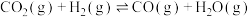

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为___________ 。
(2)在催化剂 的作用下,
的作用下, 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示
表示 ,
, 表示
表示 ,
, 表示
表示 。
。
历程Ⅰ: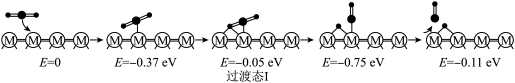
反应甲: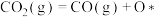
历程Ⅱ: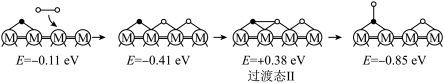
反应乙:
历程Ⅲ: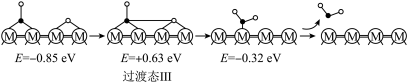
反应丙:___________
①历程Ⅲ中的反应丙可表示为___________ 。
②决定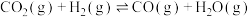 的总反应速率的是历程
的总反应速率的是历程___________ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(3)将 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。 、
、 、
、 的大小关系为
的大小关系为___________ 。
② 点、
点、 点的化学反应速率大小:
点的化学反应速率大小: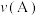
___________ (填“<”、“=”或“>”) 。
。
③温度高于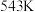 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是___________ 。
④图中 点对应的温度下,已知
点对应的温度下,已知 的选择性(生成的
的选择性(生成的 与转化的
与转化的 的百分比)为50%,该温度下反应ⅱ的平衡常数为
的百分比)为50%,该温度下反应ⅱ的平衡常数为___________ (结果保留3位小数)。
(4)催化 加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
,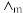 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,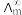 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,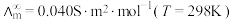 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的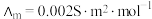 。
。
①该条件下测定的乙酸的电离平衡常数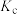 为
为___________ (列出计算式,不需化简)。
②在 时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现
时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现 的再生,从导电性角度选择,最适宜的电解质为
的再生,从导电性角度选择,最适宜的电解质为___________ (填化学式)。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ。
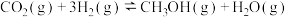
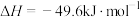
反应ⅱ。
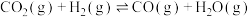

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在催化剂
 的作用下,
的作用下,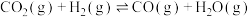 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示
表示 ,
, 表示
表示 ,
,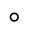 表示
表示 。
。历程Ⅰ:

反应甲:
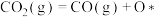
历程Ⅱ:

反应乙:

历程Ⅲ:

反应丙:
①历程Ⅲ中的反应丙可表示为
②决定
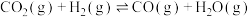 的总反应速率的是历程
的总反应速率的是历程(3)将
 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。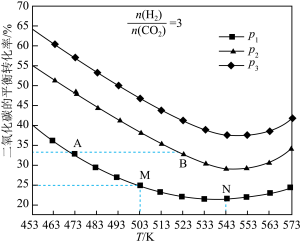
 、
、 、
、 的大小关系为
的大小关系为②
 点、
点、 点的化学反应速率大小:
点的化学反应速率大小: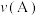
 。
。③温度高于
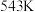 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是④图中
 点对应的温度下,已知
点对应的温度下,已知 的选择性(生成的
的选择性(生成的 与转化的
与转化的 的百分比)为50%,该温度下反应ⅱ的平衡常数为
的百分比)为50%,该温度下反应ⅱ的平衡常数为(4)催化
 加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
,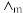 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,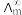 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,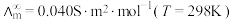 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的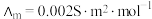 。
。①该条件下测定的乙酸的电离平衡常数
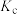 为
为②在
 时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现
时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现 的再生,从导电性角度选择,最适宜的电解质为
的再生,从导电性角度选择,最适宜的电解质为| 离子种类 |  |  |  | 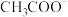 |  |  |
| 摩尔电导率 /(  ) ) | 349.82 | 79.8 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
2023-04-28更新
|
657次组卷
|
4卷引用:2024届山东省泰安肥城市高考仿真模拟(二)化学试题